放化疗抵抗的胰腺癌细胞中干细胞标志物的表达
杜志勇 魏翠凤 田锐 江建新 王敏 秦仁义
·论著·
放化疗抵抗的胰腺癌细胞中干细胞标志物的表达
杜志勇 魏翠凤 田锐 江建新 王敏 秦仁义
目的观察放化疗抵抗的胰腺癌细胞的Bcl-2、survivin及干细胞标志物Oct-4、ABCG2蛋白表达的变化,探讨这部分肿瘤细胞耐受放化疗的原因。方法采用同步放化疗干预人胰腺癌细胞系SW1990、BxPC3、pc3、jf305,获得放化疗抵抗的胰腺癌细胞,以不行放化疗处理的细胞作为对照。采用Western blotting检测它们的Bcl-2、survivin、Oct-4和ABCG2蛋白的表达变化。结果放化疗抵抗的SW1990、BxPC3、pc3、jf305胰腺癌细胞Bcl-2蛋白表达量分别为0.7955±0.0326、0.5718±0.0212、0.6137±0.0382和0.8733±0.0461;survivin蛋白表达量分别为0.8207±0.0490、0.6973±0.0211、0.7967±0.0346和0.8013±0.0398;Oct-4蛋白表达量分别为0.8728±0.0177、0.7861±0.0139、0.4794±0.0932和0.4216±0.1043;ABCG2蛋白表达量分别为0.7810±0.1370、0.4957±0.1126、0.6102±0.1358和0.4670±0.1274。对照组相应细胞系的4种蛋白表达量分别为0.4723±0.018、0.2954±0.0103、0.3587±0.0201和0.2718±0.0136;0.4717±0.0274、0.3587±0.0113、0.3891±0.0147和0.3326±0.0124;0.6053±0.0142、0.4236±0.0086、0.2385±0.0671和0.1985±0.0582;0.3156±0.0582、0.2360±0.0423、0.2813±0.0512和0.1808±0.0370。放化疗后胰腺癌细胞的4种蛋白表达量均显著增加(P﹤0.05)。结论放化疗抵抗的胰腺癌细胞中可能富含肿瘤干细胞。
胰腺肿瘤; 干细胞; 肿瘤细胞系; 抗药性,肿瘤; 标志物
放化疗主要是通过诱导凋亡来杀死肿瘤细胞,肿瘤细胞耐受凋亡则导致治疗失败。现在认为治疗失败最根本的原因是肿瘤干细胞的存在[1]。肿瘤干细胞通常高表达抗凋亡蛋白而低表达促凋亡蛋白,因此较普通肿瘤细胞更加耐受凋亡。一般而言,肿瘤细胞系中的干细胞含量通常较少。我们以前的实验结果显示[2],单独给予极高浓度的化疗药物很难杀死大部分胰腺癌细胞,而放化疗同步往往能获得最佳效果。因此,本文采用同步放化疗的办法杀死大部分胰腺癌细胞,检测残存的小部分放化疗抵抗的胰腺癌细胞中干细胞标志物Oct-4、ABCG2及凋亡相关蛋白Bcl-2和survivin的表达变化,探讨胰腺癌细胞耐受放化疗的原因。
材料和方法
一、放化疗抵抗胰腺癌细胞的获取
人胰腺癌细胞系SW1990、BxPC3、pc3、jf305为本实验室保存,复苏后用含10%胎牛血清的RPMI1640培养基常规培养。取指数生长期细胞,SW1990、BxPC3和jf305细胞加入健择(法国礼来有限公司产品,0.2 g/支)终浓度为10-6mol/L的培养基,pc3细胞加入健择终浓度为5×10-7mol/L的培养基,培养24 h后2Gy照射一次,以后持续用含药培养基培养,每天观察细胞生长情况,当瓶底贴壁细胞不再明显减少时收集剩余细胞。以不行放化疗处理的细胞作为对照。
二、Oct-4、ABCG2、Bcl-2和survivin蛋白检测
收集上述各组1×107个细胞,充分洗涤,置于冰上加入100 μl冷裂解液(pH 8.0的50 mmol/L Tris-HCl、150 mmol/L NaCl、0.02% NaN3、0.1% NP-40)。离心后取上清,考马斯亮蓝法测定蛋白浓度。取100 μg蛋白质,常规行Western blotting。兔抗人Oct-4 IgG及鼠抗人ABCG2 IgG(abcam公司)1∶500稀释;鼠抗人survivin IgG和鼠抗人Bcl-2 IgG(santa cruz公司)1∶200稀释。化学发光法显示条带,压片曝光。测定各条带吸光值,以目的蛋白条带和内参条带的吸光值积分比值表示目的蛋白的相对表达量。
三、统计学处理
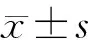
结 果
一、残存胰腺癌细胞量
同步放化疗导致细胞生长减慢,大部分细胞死亡。连续培养10~12 d后,细胞数量不再明显减少,此时细胞还剩10%左右。
二、胰腺癌细胞Bcl-2、survivin蛋白表达
放化疗抵抗的SW1990、BxPC3、pc3、jf305胰腺癌细胞Bcl-2蛋白表达量分别为0.7955±0.0326、0.5718±0.0212、0.6137±0.0382和0.8733±0.0461,较相应对照组0.4723±0.018、0.2954±0.0103、0.3587±0.0201和0.2718±0.0136的表达量均显著增加(图1,P﹤0.05)。
放化疗抵抗的SW1990、BxPC3、pc3、jf305胰腺癌细胞survivin蛋白表达量分别为0.8207±0.0490、0.6973±0.0211、0.7967±0.0346和0.8013±0.0398,较相应对照组0.4717±0.0274、0.3587±0.0113、0.3891±0.0147和0.3326±0.0124的表达量也均显著增加(图1,P﹤0.05)。
三、胰腺癌细胞Oct-4、ABCG2蛋白表达
放化疗抵抗的SW1990、BxPC3、pc3、jf305胰腺癌细胞Oct-4蛋白表达量分别为0.8728±0.0177、0.7861±0.0139、0.4794±0.0932和0.4216±0.1043,较相应对照组的0.6053±0.0142、0.4236±0.0086、0.2385±0.0671和0.1985±0.0582的表达量均显著增加(图1,P﹤0.05)。
放化疗抵抗的SW1990、BxPC3、pc3、jf305胰腺癌细胞ABCG2蛋白表达量分别为0.7810±0.1370、0.4957±0.1126、0.6102±0.1358和0.4670±0.1274,较相应对照组的0.3156±0.0582、0.2360±0.0423、0.2813±0.0512和0.1808±0.0370的表达量也均显著增加(图1,P﹤0.05)。
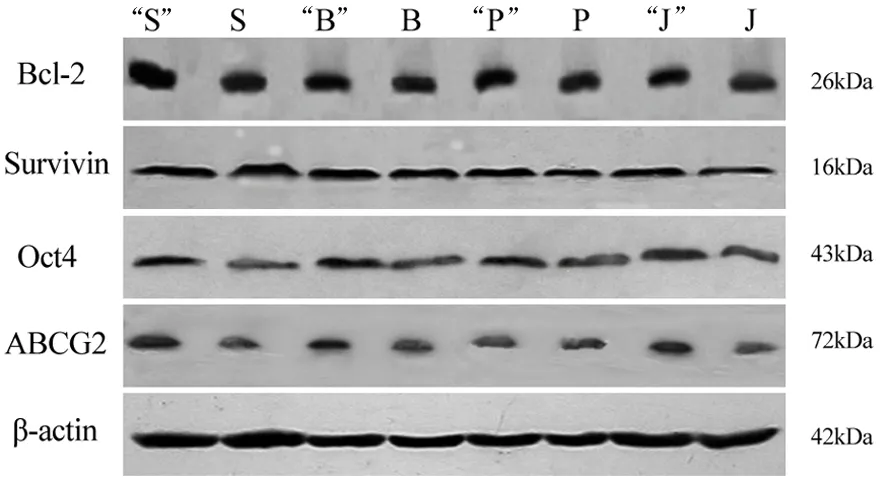
图1SW1990(S)、BxPC(B)、pc3(P)和jf305(J)细胞的Oct-4、ABCG2、Bcl-2和survivin蛋白表达(加“”者为放化疗抵抗组)
讨 论
目前已经在血液系统肿瘤和多种实体肿瘤中发现了相应的肿瘤干细胞[1,3-4]。这些肿瘤干细胞和正常的干细胞一样,通常处于G0期,高表达耐药蛋白,并且具有强大的DNA修复能力和抗凋亡活性等[5],因此较常规的肿瘤细胞更能耐受凋亡,从而对放化疗不敏感[3-4,6-8]。
肿瘤干细胞较普通肿瘤细胞更为耐受凋亡的主要原因是:⑴高表达Bcl-2等多种抗凋亡蛋白及survivin等多种凋亡抑制蛋白;⑵高表达包括ABCG2在内的多种耐药蛋白。因此,肿瘤干细胞可能是肿瘤耐药、复发转移的重要原因[1,5]。此外,干细胞可通过Wnt/β-catenin信号途径介导其放疗抵抗[9]。本结果显示,4株胰腺癌细胞经放化疗处理后,残存胰腺癌细胞Bcl-2、survivin和ABCG2蛋白表达均显著增加,支持上述观点。
采用放化疗干预获得放化疗抵抗的肿瘤细胞,其可能富含肿瘤干细胞。ABCG2被认为是一个具有普遍意义的干细胞标志物[10],在干细胞低氧发育过程中发挥着重要的生理功能,在多种肿瘤干细胞高表达。Oct-4是另一个重要的干细胞标志物,对于维持干细胞的自我更新和多能性起着重要作用,并与肿瘤分化及恶性程度相关[11-12]。我们之前的研究和他人研究都已经证实胰腺癌细胞系表达干细胞标志物Oct-4和ABCG2[12-14]。Shah等[15]用浓度梯度递增法得到健择耐药的胰腺癌细胞系,其CD24、CD44、ESA表达增加,而CD44+CD24+ESA+表型胰腺癌细胞(约占细胞总数的0.2%~0.8%)被认为是胰腺癌干细胞,这说明健择耐药的胰腺癌细胞中可能富含胰腺癌干细胞。Olempska等[14]认为,ABCG2和(或)CD133阳性的胰腺癌细胞可能是胰腺癌干细胞。本实验结果显示,放化疗抵抗的胰腺癌细胞高表达Oct-4及ABCG2蛋白,也说明这部分残存的胰腺癌细胞富含胰腺癌干细胞。
[1] Dean M,Fojo T,Bates S.Tumour stem cells and drug resistance.Nat Rev Cancer,2005,5:275-284.
[2] Chang Q,Qin R,Huang T,et al.Effect of antisense hypoxia-inducible factor 1 alpha on progression,metastasis,and chemosensitivity of pancreatic cancer.Pancreas,2006,32:297-305.
[3] Liu G,Yuan X,Zeng Z,et al.Analysis of gene expression and chemoresistance of CD133+cancer stem cells in glioblastoma. Mol Cancer,2006,5:67.
[4] Zhang S,Balch C,Chan MW,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors.Cancer Res,2008,68:4311-4320.
[5] Lobo NA,Shimono Y,Qian D,et al.The biology of cancer stem cells.Annu Rev Cell Dev Biol,2007,23:675-699.
[6] Bao S,Wu Q,McLendon RE,et al.Glioma stem cells promote radioresistance by preferential activation of the DNA damage response.Nature,2006,444:756-760.
[7] Phillips TM,McBride WH,Pajonk F.The response of CD24(-/low)/CD44+breast cancer-initiating cells to radiation.J Natl Cancer Inst,2006,98:1777-1785.
[8] Eramo A,Ricci-Vitiani L,Zeuner A,et al.Chemotherapy resistance of glioblastoma stem cells.Cell Death Differ,2006,13:1238-1241.
[9] Woodward WA,Chen MS,Behbod F,et al.WNT/beta-catenin mediates radiation resistance of mouse mammary progenitor cells.Proc Natl Acad Sci USA,2007,104:618-623.
[10] Hadnagy A,Gaboury L,Beaulieu R,et al.SP analysis may be used to identify cancer stem cell populations.Exp Cell Res,2006,312:3701-3710.
[11] Gidekel S,Pizov G,Bergman Y,et al.Oct-3/4 is a dose-dependent oncogenic fate determinant.Cancer Cell,2003,4:361-370.
[12] Tai MH,Chang CC,Kiupel M,et al.Oct4 expression in adult human stem cells:evidence in support of the stem cell theory of carcinogenesis.Carcinogenesis,2005,26:495-502.
[13] 杜志勇,魏翠凤,胡君,等.胚胎干细胞标志物Oct-4在胰腺癌的表达.胰腺病学,2007,7:357-359.
[14] Olempska M,Eisenach PA,Ammerpohl O,et al.Detection of tumor stem cell markers in pancreatic carcinoma cell lines.Hepatobiliary Pancreat Dis Int,2007,6:92-97.
[15] Shah AN,Summy JM,Zhang J,et al.Development and characterization of gemcitabine-resistant pancreatic tumor cells.Ann Surg Oncol,2007,14:3629-3637.
2009-01-06)
(本文编辑:屠振兴)
Expressionofstemcellmarkersinpancreaticcancercellsresistanttochemoradiotherapy
DU Zhi-yong, WEI Cui-feng, TIAN Rui, JIANG Jian-xin, WANG Min, QIN Ren-yi.
Department of Pancreatic-Biliary Surgery, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
QINRen-yi,Emailryqin@tjh.tjmu.edu.cn
ObjectiveTo investigate the expression of Bcl-2, survivin and pancreatic cancer stem cells markers Oct-4 and ABCG2 in pancreatic cancer cells resistance to chemoradiotherapy, and explore its mechanism.MethodsConcurrent chemoradiotherapy was used to obtain pancreatic cancer cells resistant to chemoradiotherapy, the pancreatic cancer cells without chemoradiotherapy treatment were used as control. Western-blot was applied to detect the expression of Bcl-2, survivin, Oct-4, ABCG2.ResultsThe expression of Bcl-2 was 0.7955±0.0326, 0.5718±0.0212, 0.6137±0.0382 and 0.8733±0.0461, respectively; the expression of survivin protein was 0.8207±0.0490, 0.6973±0.0211, 0.7967±0.0346 and 0.8013±0.0398, respectively; the expression of Oct-4 protein was 0.8728±0.0177, 0.7861±0.0139, 0.4794±0.0932 and 0.4216±0.1043, respectively; the expression of ABCG2 protein was 0.7810±0.1370, 0.4957±0.1126, 0.6102±0.1358 and 0.4670±0.1274, respectively,in resistant pancreatic cancer cells of SW1990, BxPC3, pc3, jf305 cell line. The corresponding values in the control group were 0.4723±0.018,0.2954±0.0103, 0.3587±0.0201 and 0.2718±0.0136; 0.4717±0.0274, 0.3587±0.0113, 0.3891±0.0147 and 0.3326±0.0124; 0.6053±0.0142, 0.4236±0.0086, 0.2385±0.0671 and 0.1985±0.0582; 0.3156±0.0582, 0.2360±0.0423, 0.2813±0.0512 and 0.1808±0.a0370. The expression of all the four proteins significantly increased after chemoradiotherapy (Plt;0.05).ConclusionsPancreatic cancer cells resistant to chemoradiotherapy may contain cancer stem cells.
Pancreatic neoplasms; Stem cells; Tumor cell line; Drug resistance, neoplasm; Marker
10.3760/cma.j.issn.1674-1935.2009.05.011
国家自然科学基金(30471693)
430030 武汉,华中科技大学同济医学院附属同济医院胆胰外科(杜志勇、田锐、江建新、王敏、秦仁义);湖北省荆门市第一人民医院内分泌科(魏翠凤);上海交通大学医学院附属瑞金医院普外科(杜志勇)
秦仁义,Email:ryqin@tjh.tjmu.edu.cn

