RGA法标记植物抗病基因的研究进展
张 荣 陈 欧 王振英
摘要:简述了植物抗病基因的结构特点,介绍了利用RGA法克隆的抗病基因同源序列及其应用,对RGA法的应用前景进行了展望。
关键词:RGA;抗病基因;结构域
中图分类号:Q78文献标识码: A 文章编号:1006-6500(2009)01-0010-03
Research Advance on Disease-resistant Gene of Plant by RGA Labeling
ZHANG Rong,CHEN Ou,WANG Zhen-ying
(Tianjin Key Lab of Cyto-genetical and Molecular Regulation,College of Chemistry and Life Science,Tianjin Normal University,Tianjin 300387,China)
Abstract:The structure characteristics about plant disease-resistant gene was summarized, the same sequences of cloned disease-resistant genes by RGA and its applications were introduced. At last, the application prospect of RGA was expected.
Key words: RGA;resistance gene;construction domain
植物在长期的发展进化过程中,不可避免的会遭到各种病害的侵袭,在不断地抵抗其危害的过程中,植物本身形成了一套比较完整的抗病基因序列,然而在不同的植物品系之间,这类抗病基因之间存在着很大的同源性,这类基因被通称为植物抗病基因(Resistance gene,R基因),并在1992年被首次克隆成功[1]。针对作物、园艺等不同方面的需求,人们对大量植物种类进行了广泛的实验验证,均证明植物的抗病基因同源性确实存在且相对稳定,这逐渐成为实验研究的一种重要引证和新的实验方法的源泉。
1 植物抗病基因的结构特点
R基因是在植物抗病过程中抵抗病菌浸染及扩展的有关基因,也就是Flor经典遗传学的基因对基因(gene-for-gene)假说中所指的与病原菌无毒基因相对应的基因,存在于植物的特定品种中,在植物生长的整个周期或其中某个阶段表达的植物抗病品种所特有的一类基因。研究表明,这些抗病基因的氨基酸序列之间具有较高的同源性。
1.1 NBS-LRR结构域的特点
富含亮氨酸重复序列(Leucine Rich Repeats, LRR),与蛋白质之间的互作及信号的转导存在密切的联系,包括两种:一种存于细胞外,一种存在于细胞内。核苷酸结合位点(Nucleotide Binding Site, NBS)—真核生物中具有结合ATP和GTP活性的蛋白,含有三个保守的特征结构域,一是激酶la,即磷酸结合环(P-loop),二是激酶2,三是激酶3a,这两类保守的区域多同时存在,形成抗病基因的保守结构域,大多数已克隆得到的R基因都有NBS-LRR区域。2004年孙学辉等人利用HMM(Hidden Markov Model)对源于日本晴的粳稻基因组和9311的籼稻基因组的蛋白数据库进行了搜索,分别获得了325个和344个富含NBS-LRR类抗病基因的蛋白序列,并得到了与它们相对应的cDNA序列。它们的共同特点是:在它们编码蛋白的近N端存在NBS,而在它们的近C端则存在LRR[2]。
1.2 TIR、STK及LZ结构域的特点
与果蝇Tol1蛋白及哺乳动物白细胞介素-1受体的细胞外相似的区域(TIR),在植物内部免疫反应过程的信号转导中起作用。它们能够与相应的免疫反应的启动子相结合,从而使相关的基因表达,以达到对病原物的抗性作用[3]。此外,还包括丝氨酸/苏氨酸蛋白质激酶(Serine/ Threonine Kinase, STK)和亮氨酸拉链结构(Leucine Zipper, LZ)等结构域,其中STK包含两个特征结构域,即DaKXXN和GTaGYXAP(N/E)[4],在抗病过程的信号转导途径中,此种激酶借助磷酸化其它的信号分子而达到传递其抗性信息的目的。而LZ则是存在于蛋白质一侧的亮氨酸残基结构,每7个氨基酸形成一个重复,而在最后一位上则是亮氨酸或异亮氨酸,在形成二级结构的α-螺旋时,借助疏水作用两两相连而形成类似于拉链的结构[5]。针对这样的特点,RGA方法应运而生,通过R基因的保守结构域扩增分离RGA,目的是为了找到更接近于R基因的分子标记并得到更新的植物抗病基因。作为一种简便易行的分子标记方法,RGA逐渐被大家认可并广泛地应用于抗病基因的寻找过程中。
2 利用RGA法克隆的抗病基因同源序列及其应用
2.1 RGA技术原理及其特点
RGA分析主要是针对抗病基因的表达产物存在保守区域的特性,人工合成相应的简并引物,进而以植物的总体DNA或cDNA为模板进行PCR扩增,分离出与其他植物或本种类植物与抗病基因类似的序列,再以PCR扩增所得的产物作为探针,运用RFLP等其他的分子标记方法进行分析,将该克隆产物进行定位,通过在抗病的近等基因系文库内进行筛选,获得试验预期的抗病基因的克隆产物,或进一步明确这些新获得的基因与已知的抗病基因间的连锁关系,从而为接下来的克隆或转化该基因奠定了一定的基础。
RGA既可以是一种DNA 的分子标记,也可以是个体本身所携带的特异抗病基因,在植物中是普遍存在的,多以成簇的方式随机分布于植物基因组中。它与R基因间可能存在3种关系:第一,分离的RGA可能本身就是一种新的R基因;第二,分离的RGA可能是已经得到的某种R基因的紧密连锁;第三,还有一种可能就是分离的RGA与R基因根本没有关系,只是在某些非主导型序列上存在相似性而已,因此分离后期的连锁性鉴定就显得尤其重要了。早期的RGA主要是从基因组DNA 中得到的,不可避免地会受到DNA中大量存在的非表达区域和重复区域的干扰,进而影响克隆的效果而得到错误的结果。近些年来,研究者逐渐改为从cDNA中克隆得到RGA,再利用特异引物返回到基因组DNA 中获得基因全长。
虽然在之前的工作中采用RGA法已经在抗病基因克隆方面取得了较好的成绩,但是此种方法还存在自身的缺陷:(1)NBS、LRR和STK等保守序列并非只存在于抗性基因中,导致分离得到的RGA并不是都与R基因有关,使得克隆R基因的过程变得复杂;(2)克隆所需的引物在设计时要考虑到抗病基因中的较高同源性,引物设计的好坏严重影响PCR产物的实用效果;(3)因R基因在植物中多以成簇的方式存在,因此所得到的与其连锁的RGA,还要在基因簇中进行筛选,而不是全部接受整个基因簇的基因。
2.2 RGA方法的应用
RGA标记与一般的分子标记如RAPD或RFLP相比,存在其自身的优越性,不仅用于揭示品种的遗传差异,而且还可以反映品种的功能,有助于选择品种组合和控制病害。它的应用主要包括:首先,可以作为分子标记用于抗病基因的标记;其次,构建连锁的遗传图谱和辅助植物的抗病育种;再次,RGA也可作为探针用于基因组文库的筛选或抗病基因的克隆;此外也有直接应用RGA 的简并引物分析种质资源间的遗传关系的。
目前,RGA分子标记的方法已经在多种植物中广泛应用,分离得到的RGA在GeneBank上记录的已达到200多种。涉及的植物种类广泛,主要集中在水稻、麦类等粮食作物中。随着分子生物学技术的飞速发展,植物的抗病性逐渐被大量地应用于育种实践中,进而避免化学药物防治对环境和人类造成的破坏和危害。
首先,水稻作为我国的首要粮食类作物,针对其易感染的叶枯病[6]、稻瘟病[7]等主要病害而进行的抗病基因同源序列分析,目前已经成为许多研究者的实验重点,旨在获得更接近于R基因的抗病基因序列,从根本上提高其抗病性,进而提高水稻的产量和质量。
其次,小麦作为仅次于水稻的第二类主要作物,研究其抵抗病害的基因作用原理也具有深远意义。麦类作物普遍感染的叶锈病、白粉病[8],已经成为困扰广大科学家和全国粮农的首要病害,寄希望于找到更好的抗病基因从而较为彻底的解决此类问题。在麦类植物中应用抗病基因同源序列法,也已经在一定程度上取得了骄人的成绩。胡楠等人[9]针对抗白粉病基因Pm4b进行的RGA分析,获得了稳定的长度为1 321 bp的RGA序列的多态性条带。
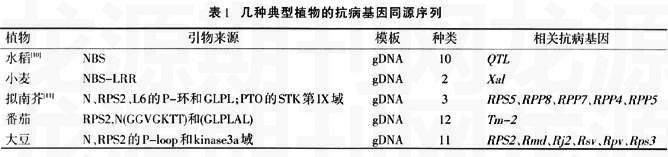
另外,利用抗病基因同源序列法在拟南芥、番茄、大豆等的R基因中都成功地建立了特异的分子标记。几种典型植物的抗病基因同源序列见表1。
3 RGA研究展望
RGA法作为近些年发展起来的新型分子标记方法,凭借其简便的技术以及与抗病基因的较高相关性,已得到诸多科学工作者的认可和支持,获得了不同植物的大量RGA,为进一步的实用价值的创造提供基础。通过分离RGA的方法克隆R基因或得到与R基因紧密连锁的分子标记,特别是针对复杂的基因组来说,是相对简便的一种标记方法。在接下来的研究中应当努力克服其各方面的缺陷,结合其他更加先进的分子生物学技术,从植物体内获得更多的RGA,进而获得更加有效的植物抗病基因,为植物育种做出更进一步的探索。
参考文献:
[1] Johal G S, Briggs S P. Reductase activity encoded by the HM1 disease resistance gene in maize[J].Science,1992,258:985-987.
[2] 孙学辉,路铁刚,贾士荣,等.水稻富含亮氨酸的重复序列和核苷酸结合位点(LRR-NBS)基因家族的生物信息学分析[J].中国农业科学,2004,37(1):1-7.
[3] 唐军.Tol1样受体—一个新发现的介导天然免疫的古老家族(下)[J].国外医学:免疫学分册,2001,24(2):59-61.
[4] 王海燕,刘大群,杨文香.植物抗病基因类似序列研究进展及展望[J].河北农业大学学报,2002,25(S1):164-168.
[5] Bostjan K, Johann D. The leucine-rich repeats: a versatile binding motif[J].TIBS, 1996 (8):1757-1771.
[6] 姬广海,张世光,魏兰芳,等.云南抗白叶枯病稻种的RGA初析[J].作物学报,2004,30(10):969-974.
[7] 李晔,范静华,何月秋,等.水稻品种RGA分析与抗瘟性鉴定[J].江西农业大学学报,2007,29(1):11-15.
[8] 王春梅,别同德,陈全战,等.簇毛麦6V染色体短臂特异分子标记的开发和应用[J].作物学报,2007,33(10):1595 -1600.
[9] 胡楠,伊艳杰,刘红彦,等.小麦抗白粉病基因Pm4b的RGA分析[J].安徽农业科学,2007,35(21):6379-6380,6430.
[10] Tada Y. PCR-amplified resistance gene analogs link to resistance loci in rice [J]. Breeding Science,1999,49(4):267-273.
[11] Aarts M G, te Lintel H B, Holub E B, et al. Identification of R-gene homologous DNA fragments genetically linked to disease resistance loci in Arabidopsis thaliana [J].Mol Plant Microbe Interact, 1998(11):251-258.

