正确理解热力学第三定律
苏许辉
(宁波中学 浙江 宁波 315100)
高中人教版《物理·3-3》主要包括热学的相关内容.热力学的三大定律是热学的基础,课本对热力学第一定律和第二定律已经有了比较详细的介绍,而对第三定律只有简单的一个表述:任何系统都不能通过有限的步骤使自身温度降低到绝对零度,即绝对零度不可达到.
在教学的过程中,每次讲到这里,都有不少同学对此充满好奇,问:为什么绝对零度不能达到呢?由于受到高中物理知识广度和深度方面的限制,许多老师和学生习惯于从分子动理论出发,对热力学第三定律——绝对零度不能达到的原因进行了较片面地理解,不少老师也都是按下面的方法进行解释的.
1 依据分子动理论对“绝对零度不能达到”进行解释
根据经典热力学,温度是物体分子热运动平均动能的标志,它们之间的关系可以表达为
(1)
式中,k为玻尔兹曼常量;i为分子各种运动自由度数,包括分子的平动自由度、转动自由度、振动自由度.
从(1)式可见,由于物体内分子无规则运动的平均能量与温度成正比,因此如果绝对零度能够达到,则分子的平均动能为零,分子将处于完全静止的状态,而这与分子动理论对分子的热运动的描述:“物体是由大量分子组成的,分子永不停息地做无规则运动”相矛盾.
上面依据分子动理论的知识,从经典热力学做出的解释好像能够说明绝对零度为什么不能达到.但是随着实践的进展,经典热学理论已显示出它的局限性:如果在绝对零度下粒子是静止不动的,那么它的速度为零,这时它的位置就是确定的.这样的话,位置和速度两者的值我们都知道了,这不符合海森伯的不确定原理——它只允许知道一个.所以,近代物理的量子理论对经典热力学作了修正,指出:即使温度能够达到绝对零度,分子也不会完全静止,因为分子还具有“零点能”.并且,零点能的存在已经从实验中得到了证实.
可以看出,依据分子动理论的相关内容,从经典热力学出发,认为分子在绝对零度会静止不动的观点是站不住脚的,以此来解释绝对零度不能达到就有一定的局限性.
2 热力学零度不能达到的原因
现从能斯特定理出发,来证明绝对零度为什么不可达到[1].
首先考虑降温的手段,即考查经历何种过程降温最有效.显然,放热降温当然有效,但又必须有更低温度的热源,这是不实际的.因此,只有绝热降温是可取的方式.这又有两种选择:可逆或不可逆.我们来分析这两种方式.假定以(T,y)为独立参数,y可能是实验可控的体积、压强等.
对于可逆过程,随着温度的增加系统的熵亦增加.在S-T图(图1)上,假定物体系由y1线上的一点A经历绝热可逆过程(熵不变,沿水平线)到达y2线的B点.两状态的温度分别记为TA和TB.
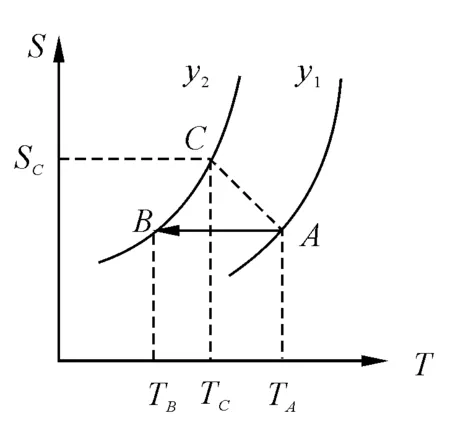
图1 物体系熵随温度T和y的变化趋势
如果由A经历不可逆绝热过程(熵增加)到达y2线,则应到达熵更大的一点C,显然有
TC>TB
可见,可逆过程降温更为有效,即绝热可逆过程降温是最有效的途径,故而我们只讨论绝热可逆过程.
熵的计算公式
(2)
量子理论与实验都给出,在极低温度下,非金属定容摩尔热容CV∝T3,金属CV∝T,所以
上述(2)式在T→0时收敛.并且,当物体系由A(TA,yA)经绝热可逆过程(熵不变)至B(TB,yB)时,有
SA=SB
由能斯特定理
S(0,yA) =S(0,yB)
因而
(3)
如果
TA>0
则有
亦必有
TB>0
即绝热可逆过程不能将温度降至绝对零度.
因此,任何有限步骤都不能将体系的温度降至绝对零度.
3 展望
热力学第三定律虽明确指出,绝对零度不可能达到,但这并没有阻止人们向这个最冷的极地逼近.早在1926年,德拜和吉奥克用磁冷却法达到了10-3K.后来又有人攻破了10-6K.1995年,科罗拉多大学和美国国家标准研究所的两位物理学家爱里克·科内尔和卡尔威曼成功地使一些铷原子达到了令人难以置信的温度,即2×10-8K.2003年,科学家更获得5×10-10K.当然,我们相信科学家一定还可以达到更低的温度.然而,人们发现,温度越低,进一步逼近绝对零度就更加困难.这所有的努力都说明热力学第三定律的正确,即绝对零度是低温的极限,是不可能达到的.
参考文献
1 王竹溪. 热力学. 北京:高等教育出版社,1955.355~365

