采用非浸润模板制作纳米颗粒基因药物
高欣,Dorian A.Canelas,田少敏
(美国北卡罗来纳大学教堂山分校,教堂山市 27599)
1 RNA干扰的机理及应用
1.1 RNA干扰的机理
作为合成蛋白质的遗传物质,mRNA(messengerRNA,信使RNA)承载着生物体中至关重要的遗传信息。可以抑制 mRNA物质主要有 RNA酶、ASOs(Antisense Oligonucleotides,反义寡核苷酸)和siRNA(smallinterferingRNA,小型干扰RNA)。其中,发现于1998年的siRNA因其较高的基因沉默率而广受关注。siRNA为短小的双链RNA,每条链包含21到23个核苷酸,通常3'端有2到3个未配对的核苷酸,并在5'端基核苷酸上有一个单磷酸盐基团[1,2]。
siRNA靶向降解相应mRNA的过程称为RNA干扰(RNA interference,RNAi)。在RNA干扰中,siRNA首先与多蛋白复合体—RISC(RNA-induced silencingcomplex,RNA引导的沉默复合体)结合。而后 siRNA发生解旋,只由一条单链引导 mRNA的降解[3]。siRNA的定向识别和定向降解过程如图1所示。
1.2 RNAi基因治疗
发现RNA干扰现象的科学家AndrewFire于1998年被授予诺贝尔生物医学奖[4]。这主要是由于 RNA干扰在癌症、病毒感染治疗方面的巨大潜力。传统的癌症药物靶向定位的只是蛋白质。而RNA干扰药物直接定向并降解致病基因,理论上可以设计降解任意突变基因的siRNA,并有望解决传统药物副作用高的缺点。
目前,RNA干扰基因治疗的难点在于 siRNA的传输。这主要因为siRNA双链骨架上的磷酸盐基团荷负电,而生物体细胞膜也荷负电,两者彼此排斥。假设没有传输载体的帮助,siRNA是不可能自动越过细胞膜的。最早应用于siRNA传输的是病毒载体,但是它具有引发生物体免疫反应的危险,甚至导致癌症[5]。
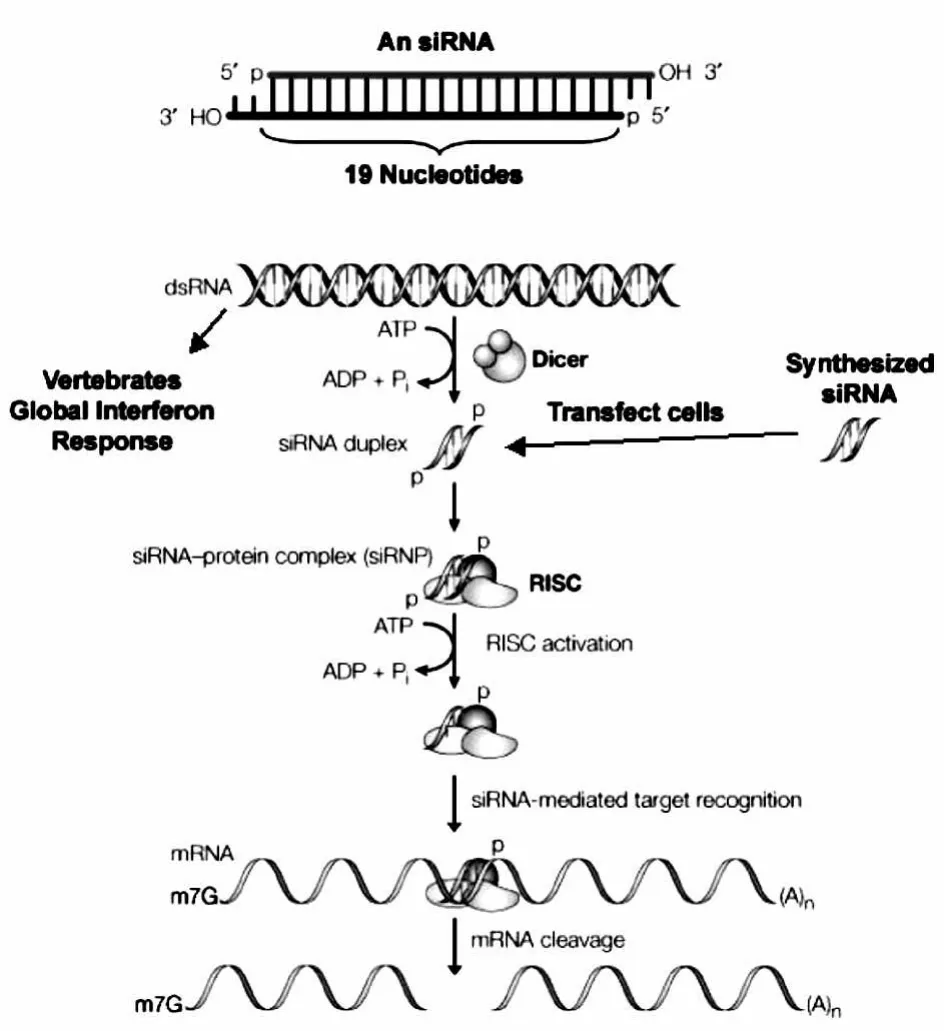
图1 核糖核酸干扰(RNAi)过程[6]Fig.1 The process of RNA interference
近年来非病毒载体得到了广泛的研究,最有成效的包括以下几类:一,化学修饰可以提高 siRNA的稳定性并提高siRNA的药理性质。特别是胆固醇修饰的siRNA在细胞实验和动物体内实验中都表现了很好的药物理化性质[7]。二,脂质体能够提高siRNA在血清中的稳定性,降低药物肾排泄并提高细胞对药物的吸收。但其缺点是大小难以控制(50-1000nm),而且带有正电荷的脂质体毒性较大[8,9]。三,细胞穿透多肽可以和siRNA形成复合体并将其直接传输到细胞质中。其缺点是在体内循环中的寿命较短[10]。四,高分子类载体品种繁多,近年来得到深入的研究。相对于其它载体,高分子类载体的优势主要是:不易引发免疫反应;可盛载数量较多的基因药物;有多种多样的化学结构可供选择;提高了基因药物的储存稳定性和循环稳定性。高分子类载体的应用机理是:首先,高分子载体材料通过静电吸引、包覆或是吸附的方式与基因药物结合形成复合体。例如,线状的或支链状的聚乙烯亚胺(Polyethyleneimine,PEI)在中性pH条件下是带正电的高分子,通过调节PEI和基因药物的比值可以获得大小合适的运载复合体,从而实现基因传输[11]。其次,在靶向细胞内部,高分子运载复合体可通过自身的结构特征引发复合体的降解,释放基因药物。比如,许多高分子载体中包含双硫键,大多数哺乳动物细胞内都含有的谷光甘肽可将双硫键还原成两个巯基,从而破坏了高分子交联体系,释放出基因药物[12]。本文中介绍的PRINT纳米颗粒即可归为此类载体。
2 高分子PRINT纳米颗粒
2.1 PRINT技术的来源和基本流程
PRINT技术的灵感源自于新兴的微电子制造技术。借助于光蚀作用,这种技术可以连续、价廉地在硅圆片上刻画纳米级的复杂花纹。北卡大学 De-Simone实验室开发的PRINT技术可以通过光蚀后的硅圆片制作出多种多样的纳米颗粒[13]。
与传统的软版模制技术不同,PRINT技术能够制作出彼此完全分离的纳米颗粒。PRINT所用的模具是光蚀刻画后的硅圆片,其上均匀排列着重复一致的纳米花纹。PFPE DMA(perfluoropolyether dimethacrylate,全氟聚乙烯二甲基丙烯酸酯)和光引发剂的混合溶液被滴加到硅圆片表面。待粘稠的混合溶液将硅圆片完全覆盖后,用紫外灯照射整个体系而引发光聚合。在三到五分钟的时间内,聚合基本完成,原本粘稠的混合溶液通过交联而成为便于后续操作的PFPE弹性膜。将弹性膜从硅圆片上撕下后,它与模具接触的一面上复印了全部的纳米花纹。本实验中将不同的单体溶液滴加到PFPE弹性膜上,光引发聚合后制作出了各种各样的高分子颗粒。这主要是由于含氟量高的PFPE膜不能浸润有机单体溶液所致。具体的PRINT步骤如图2所示。
2.2 PRINT纳米颗粒的优势
PRINT技术的独特之处在于可以保证所制作的颗粒(如图3所示)大小形状均一,并且具有一致的化学组成和表面特征。这一点对于研究颗粒在生物体内各器官的分布十分重要,同时还有可能制作出与病毒或蛋白质形状类似的颗粒[14]。与脂质体等其他载体相比,大小形状均一分布的PRINT颗粒能更容易地开展剂量及细胞穿透研究。同时,PRINT技术使得人们可以更方便、更精确地调节纳米颗粒的各种性质,其中包括:颗粒的交联密度、电荷量、化学组成和表面修饰情况等[15]。
3 实验内容和数据结果
3.1 使用薄的模具制作PVP PRINT纳米颗粒
RNA药物传输实验需要同时制作许多不同组分的纳米颗粒(例如组分中含有不同百分含量的交联剂或正电荷试剂)来优化药物传输系统。如果此时还是频繁的制作传统的厚模具(每张厚度约为1毫米,需消耗10-15mL的全氟预聚物)就显得很不经济了。为了解决这一问题,在实验中选用了薄的模具(由美国北卡州三角科技园区的Liquidia公司提供),每张厚度为微米级,仅消耗1mL左右的全氟预聚物。同时使用可双向运动的层合机制作纳米颗粒。
本实验中制作200纳米*200纳米圆柱形颗粒的流程如图 2所示。首先,将包含乙烯吡咯烷酮单体、siRNA药物和其他组分的单体混合液滴加到薄模具表面(模具表面上刻有许多200纳米*200纳米的圆柱形凹坑);而后,将一张PET膜压到薄膜具表面从而使单体混合液展开,并填满模具中的纳米凹坑;然后把PET膜揭掉,由于PFPE薄模具表面势能低于PET膜,未进入纳米凹坑中的残余单体混合液会被PET膜带走;在揭走PET膜的同时,双向层合机将另一张新的PET膜覆盖到PFPE模具的表面。这是为了防止乙烯吡咯烷酮蒸发损失;最终,使用紫外灯引发单体混合液的光聚合,由于PET膜和PFPE模具紧密贴合,排除了单体周围的空气,聚合过程中无需通氮气除氧。PRINT过程之后,将PET膜和PFPE模具分离,大部分的PRINT纳米颗粒被表面势能较高的PET膜带走(如图4所示),通过细胞收集扫可将纳米颗粒收入纯水中(如图3所示)。颗粒的收集过程都通过扫描电子显微镜(SEM,ScanningElectronMicroscope)照片得到证实(图3、图4)。
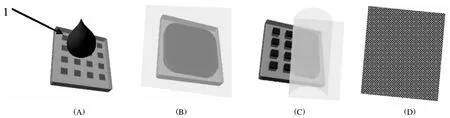
图2 在非浸润模板中制作纳米颗粒的技术流程图(带有孔洞的模板为全氟聚乙烯二甲基丙烯酸酯膜,液体1为单体混合物)Fig.2 The procedures of fabricating PRINT nanoparticles

图3 实现沉默核苷核酸(siRNA)传输的非浸润模板(PRINT)中制作的纳米级颗粒Fig.3 PRINT nanoparticles for siRNA delivery

图4 聚对苯二甲酸乙二醇酯膜上的纳米颗粒Fig4 Nanoparticles on the surface of PFPE mold
3.2 实现siRNA传输的颗粒化学组成
通过上面对PRINT技术流程的了解,不难发现只要单体混合物各组分能够互溶即可运用PRINT模制高分子颗粒,这意味着PRINT技术在材料选择上具有相当的多样性。为了保护并定向传输易分解的siRNA,本实验选用了PVP制作颗粒。因此,单体混合液的主体是 VP(N-vinyl Pyrrolidone,乙烯吡咯烷酮单体)。VP分子中含有一个碳碳双键,可以参与光聚合反应。而其聚合产物PVP是易溶于水的无毒高分子,在医疗材料中有广泛应用。
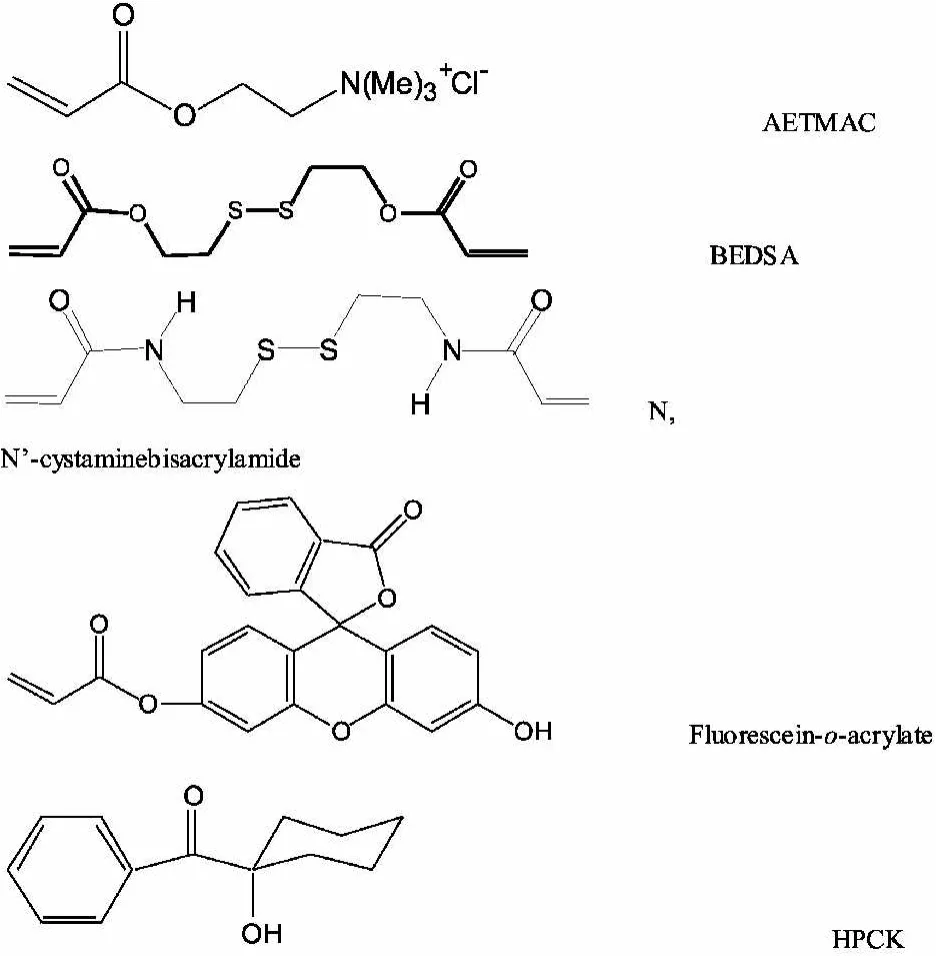
除VP以外,单体混合液中还含有许多功能成分。正电荷试剂AETMAC(2-acryloxyethyltrimethylammonium)就是其中之一。AETMAC上带有正电荷,可以有效的吸引带负电荷的siRNA从而达到包装基因药物的目的,并使整个传输颗粒荷正电。这样,颗粒与带负电的细胞膜相互吸引,可以轻易地将siRNA传输到细胞内部。另一个重要的功能单体分子是交联剂。在实验中试用了 bis(ethyldisulfide)acrylate(BEDSA)交联剂和N,N'-cystaminebisacrylamide交联剂。其中BEDSA显示出最好的siRNA传输效果。BEDSA分子中含有的双硫键在细胞内部环境作用下可被还原成两个巯基,从而降解了PRINT颗粒的网状结构,有助于释放出siRNA药物。其它成分有荧光标记物Fluorescein-o-acrylate和光聚合引发剂1-hydroxycyclohexyl phenyl ketone(HCPK)。以上所述的各成分的化学结构如下所示:
3.3 PVP PRINT纳米颗粒的细胞吸收实验
用PVP PRINT纳米颗粒包裹敏感的siRNA分子实现药物传输,首先要保证颗粒可被细胞吸收。由于颗粒成分中包含荧光标记 Fluorescein-o-acrylate,可以通过液式细胞计检查的方法检测颗粒的细胞吸收情况。
图5显示的就是含有不同量AETMAC正电荷试剂 PVP PRINT颗粒的细胞吸收率随颗粒浓度变化的情况。
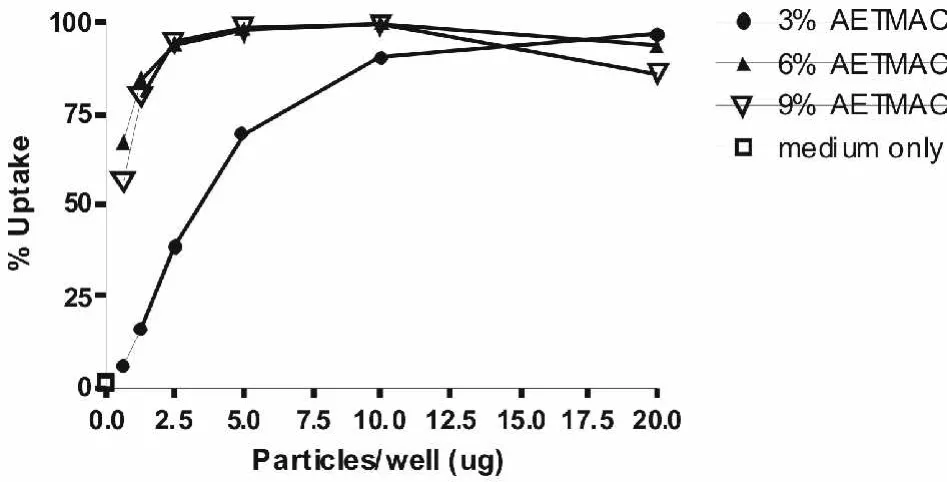
图5 PVP PRINT颗粒吸收率随颗粒浓度变化的曲线Fig5 The percentage of particles with particles vs.particle concentration
值得注意的是,图5中纵坐标代表的是吸收了PVPPRINT颗粒的细胞占全部细胞的百分比。实验所用细胞为稳定转染了萤火虫荧光素基因的 HeLa癌症细胞。当颗粒中所含正电荷试剂量大于9%时,颗粒细胞吸收率可达90%以上。最终选定的正电荷试剂含量为10%。颗粒各组分含量如表1所示。

表1 用于基因传输的纳米颗粒组成成分Tab.1 The chemical composition of the nanoparticles for siRNA delivery
3.4 PVP PRINT颗粒的荧光素酶量降低实验
为了评价 PVP PRINT颗粒的药物传输效果,对经过颗粒处理的HeLa癌症细胞(稳定转染萤火虫荧光素酶)进行了两项细胞检验:一是荧光素酶量降低检验,二是细胞存活率检验。在荧光素酶量降低检验中,将被颗粒处理后细胞的荧光素酶含量与只被营养基质处理后细胞的荧光素酶含量进行了比较。同时,还要检测细胞的存活率以保证荧光素酶量的降低并非来源于细胞大量死亡。因此,荧光素酶的降低效率是通过比较荧光素酶量降低和细胞存活率得到的,为了验证实验中所使用siRNA的有效性,用一种已知有效的脂质体传输siRNA,作为PVP PRINT纳米颗粒的比照组。
首个成功的PVP纳米颗粒表现出约40%的荧光素酶基因抑制量(如图6)。所用纳米颗粒的剂量为20-40g/mL。HeLa细胞接触颗粒的时间为4h。其间,细胞培养皿被放置在37°C的保温槽中。具体的实验步骤是:在96孔细胞盘的每个孔中放入约20000个HeLa细胞。第二天,将不同剂量的含siRNA PVP PRINT颗粒加入不同的孔中,然后在37°C下培养细胞。4h后,将还未被细胞吸收的颗粒移走,加入新鲜的培养液。此时即可进行荧光素酶表达量和细胞存活率的测量。
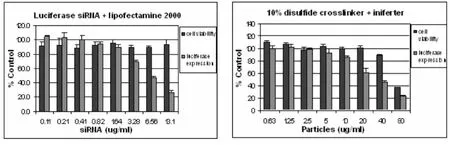
图6 荧光素酶表达量和细胞存活率图:实验组为吸收聚乙烯吡咯烷酮纳米颗粒的HeLa细胞,比照组为吸收脂质体Lipofectamine 2000(已知有效的传输系统)的HeLa细胞Fig.6 The graphs of Luciferase expression and cell viability:use HeLa cells taking up PVP PRINT nanoparticles as the experiment group and use HeLa cells taking up Lipofectamine 2000 as the control group
3.5 PVP PRINT颗粒化学成分的优化
图7中所示的PVP颗粒中含有10%的交联剂,所达到的荧光素酶降低量为40%。为了提高PVP纳米颗粒的siRNA传输效率,实验中尝试提高交联剂的含量。图7展示了含有10%,20%和30%交联剂的PVP纳米颗粒的荧光素酶降低率。其中含有30%交联剂的纳米颗粒表现出最高的基因抑制效率,荧光素酶表达量降低了约65%。
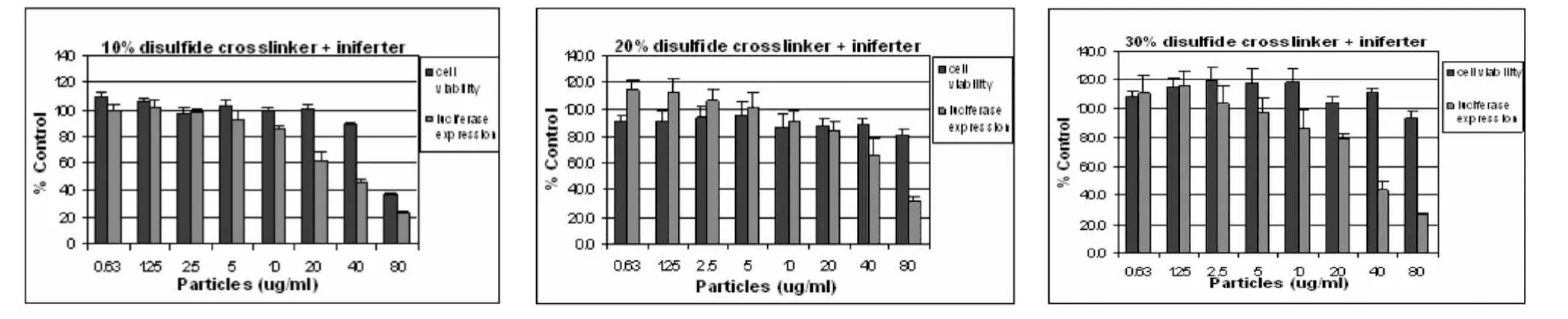
图7 荧光素酶表达量及细胞存活率:传输系统为200*200纳米聚乙烯吡咯烷酮纳米颗粒,三组颗粒中含有交联剂的质量分数分别为10%,20%,30%Fig.7 The graphs of Luciferase expression and cell viability:use 200*200nm PVP PRINT nanoparticles as the delivery system,the percentages of crosslinker are 10%,20%,30%
4 结论
主要探讨了PRINT纳米颗粒这一新型非病毒传输系统在siRNA药物传输方面的一些尝试。从中可见,PRINT技术用于siRNA药物传输有着巨大的潜力:首先,SEM电镜照片证实了我们确实可以制作出大小、形状、化学成分一致的单分散颗粒;其次,荧光素酶表达量和细胞存活率两项检验证明了PVPPRINT纳米颗粒经过成分优化可达到65%的基因抑制效率。本项目未来的工作将致力于设计出针对于真实致病基因的PRINT颗粒传输系统,并实现在动物体内的基因抑制。
[1]Elbashir SM,Harborth J,Lendeckel W,et al.Duplexes of 21-nucleotide RNAs mediate RNAinterferenceincultured mammalian cells[J].Nature,2001,411:494-98.
[2]Bernstein E,Caudy A A,Hammond SM,et al.Role for a bidentate ribonuclease in the initiation step of RNA interference[J].Nature,2001,409:363-66.
[3]Elbashir SM,Lendeckel W,Tuschl T.RNA interference is mediatedby21-and 22-nucleotideRNAs[J].GenesDev,2001,15:188-200.
[4]Fire A,Xu S,Montgomery M K,et al.Potent and specific genetic interference by doube-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391:806-811.
[5]Herard A S,Besret L,Dubois A,et al.siRNA targeted against amyloid precursorprotein impairs synapticactivity in vivo[J].Neurobiol Aging,2005,27:1740-50.
[6]Wall N R,Shi Y.A general introduction to RNAi[J].Lancet,2003,362.
[7]Allen T M,Newman MS,Woodle MC,et al.Pharmacokinetics and anti-tumor activity of vincristine encapsulated in sterically stabilized liposomes[J].Int F Cancer,1995,62:199-204.
[8]Lasic DD,Martin F.Stealth Liposomes.Boca Raton,FL:CRC Press.1995:289.
[9]Torchilin V P,Narula J,Halpern E,et al.Poly(ethylene glycol)-coated anti-cardiac myosin immunoliposomes:factors influencing targeted accumulation in the infracted myocardium.Biochim[J].Biophys Acta,1996,1279:75-83.
[10]Marshall E.BIOMEDICINE:gene therapy on trial[J].Science,2000,288:951-7.
[11]Tang M X,Szoka F C.The influence of polymer structure on the interactions of cationic polymers with DNA and morphology of the resulting complexes[J].Gene Ther,1997,4:823-32.
[12]Saito G,Swanson J A,Lee K D.Drug delivery strategy utilizing conjugation via reversible disulfide linkages:role and site of cellular reducing activities[J].Adv Drug Deliv Rev,2003,55:199-215.
[13]Jason P,Rolland,Benjamin W,et al.Direct Fabrication and Harvesting of Monodisperse,Shape-specific Nanobiomaterials[J].J Am Chem Soc,2005,127:10096-100.
[14]Maynor B W,LaRue I,Hu Z,et al.Supramolecular Nanomimetics:Replication of Micelles,Viruses,and Other Naturally Occurring Nanoscale Objects[J].Small,2007,3:845-849.
[15]David A Olson,Stephanie E A,Gratton,et al.Amorphous Linear Aliphatic Polyesters for the Facile Preparation of Tunable Rapidly Degrading Elastomeric Devices and Delivery Vectors[J].J Am Chem Soc,2006,128:13625-633.

