沉水植物苦草对上覆水各形态磷浓度的影响
陈秋敏,王国祥,葛绪广,王立志
(1.南京师范大学地理科学学院,江苏南京 210046;2.江苏省环境演变与生态建设重点实验室,江苏南京 210046)
磷是影响湖泊富营养化的关键性限制因素之一[1-2],同时也是植物生长发育的必需元素。水体中各种磷形态之间的转化,尤其是其他形态磷化合物向正磷酸盐转化速率是决定湖泊营养状态和上覆水生产力的重要因素[3-4]。
沉水植物是湖泊生态系统的一个重要组成部分和主要的初级生产者之一,对湖泊生态系统中物质和能量的循环起着重要作用,沉水植物占据了湖泊中水和沉积物的主要界面,是水体两大营养库间的有机结合,对湖泊生产力及湖泊生态系统过程具有重要的影响[5],沉水植物在生长发育、衰亡及季相交替过程中,通过光合、呼吸、残体分解等作用,可以对上覆水的DO、pH、氧化还原电位(Eh)以及水动力等产生复杂的影响,并通过这些影响因子的变化进而影响到磷素的迁移转化[6-9]。黑藻等根系退化较为严重、顶冠蓬散的沉水植物主要是从上覆水中吸收营养物质,而苦草等根系较为发达的沉水植物则可同时从上覆水和沉积物中吸收营养物质。目前,沉水植物对于上覆水磷浓度影响主要是从水质净化的角度进行了一些研究工作,王圣瑞等[10]采用蓬冠状、根系退化的沉水植物黑藻,从沉积物-水-沉水植物系统的角度研究了沉水植物对上覆水中各形态磷浓度的影响。而对根系发达即深根系的沉水植物苦草研究报道较少。笔者在室内模拟条件下,研究根系发达的苦草在生长过程中对上覆水中各形态磷的变化的影响,以期为湖泊内源磷的控制或治理提供依据。
1 材料与方法
1.1 试验设计
试验在南京师范大学水环境生态修复中试平台中进行,试验日期为2008年8月中旬至11月下旬。苦草取自南京市固城湖,在室内驯化培养15 d。沉积物取自南京市玄武湖,试验沉积物营养盐质量比w(TN)为 3.832g/kg,w(TP)为 1.078g/kg,w(TOC)为39.580g/kg。试验上覆水均是通过自来水充入。将沉积物分别过100目筛去除其中的植物残体、石块等杂质后,平铺入试验桶(底直径×口直径×高=45cm×55cm×80cm),厚度为10cm。然后选取每株有4~5叶、叶长40 cm、生长状况基本一致、长势良好的驯化后苦草,进行移栽,每桶30株苦草(鲜质量75g)。植物组和对照组各设3个平行。
1.2 监测指标与分析方法
试验开始后即监测各项理化指标。DO、pH值、温度等物理指标采用YSI水质在线监测仪监测;间隙水样收集利用专门的渗滤装置,原位渗滤后通过一次性采样针管吸取。
TP浓度的测定:采用过硫酸钾氧化消煮;DTP浓度的测定:将水样预先过0.45μ m孔径的醋酸纤维滤膜,而后用过硫酸钾氧化消煮;SRP浓度的测定:将水样预先过0.45μ m孔径的醋酸纤维滤膜。经过以上预处理后TP、DTP、SRP均采用荷兰SKALAR流动水质分析仪测定。PP浓度为TP浓度与DTP浓度之差,DOP浓度为DTP浓度与SRP浓度之差。
随机测定本试验已经驯化培养的苦草30株,构建植株体鲜质量与叶长、叶宽、叶片数的函数如下:
W=(0.023033x1+0.202922x2-0.25757)N
式中:W为植株鲜质量,g;x1为叶长,cm;x2为叶宽,cm;N为叶片数。
2 试验结果
2.1 苦草的生长状况
在本研究系统中,苦草均能正常生长。如图1所示,种植的苦草经过约1周的适应,开始逐渐生长,且生长速度逐渐增加,并于试验进行到约80d时,生物量达到峰值,此后,随温度的降低,苦草趋向于衰亡,生物量开始下降。
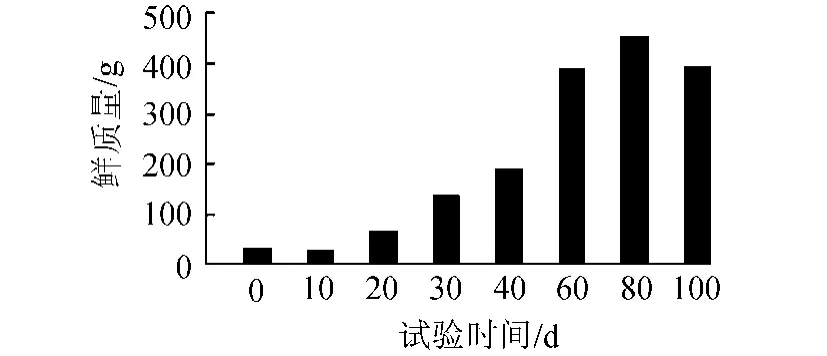
图1 试验期间苦草生物量(鲜质量)变化
2.2 上覆水中TP的变化
如图2所示,苦草组与对照组中的TP均呈现先上升、后下降的趋势。苦草组中的TP明显低于对照组。上覆水中的 ρ(TP)在培养期间的变化范围为0.01~0.19mg/L,平均值为0.094mg/L,其中苦草组上覆水的TP磷浓度为对照组TP浓度的62.5%。上覆水中TP浓度的变化取决于磷的收入和支出。试验开始时,可能由于以自来水为水源使得底泥间隙水与上覆水磷存在较大的浓度差,以及植物对沉积物的扰动,上覆水中的TP表现为上升趋势,峰值出现在20d左右;而后可能随着间隙水与上覆水中磷的浓度差逐渐减小,且苦草开始迅速生长(图1),对磷的需求量增大,上覆水磷的收入开始小于支出,表现为上覆水中TP下降。
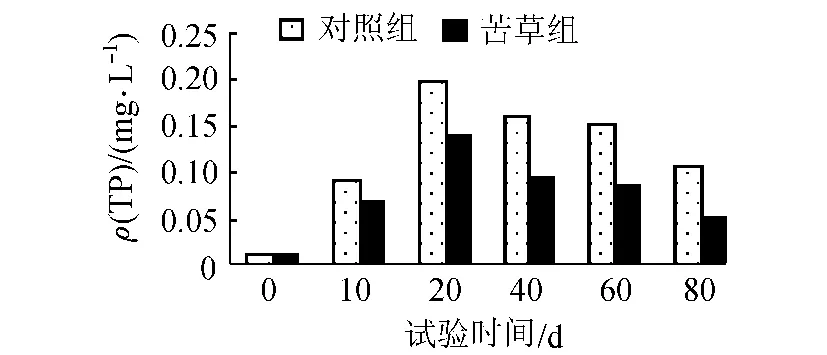
图2 上覆水中 ρ(TP)的变化
2.3 上覆水中不同赋存形态磷的变化
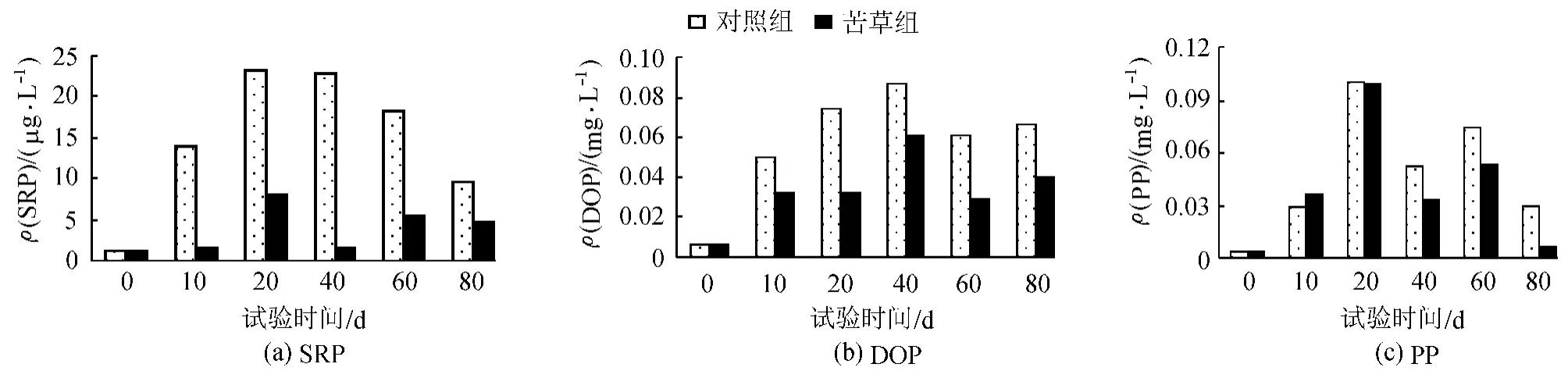
图3 上覆水中不同P形态的变化
如图3(a)所示,整个试验期间,苦草组与对照组中的SRP都呈明显的先上升后下降的趋势,其峰值出现在20 d左右。苦草组中SRP的浓度值仅为对照组的25.4%;不同处理组的 ρ(SRP)变化范围在1~23μ g/L,其中苦草组的 ρ(SRP)保持在 8μ g/L以下。不同处理组中的DOP基本上呈先上升后下降的变化趋势,中间有小波动,其峰值均出现在40d左右,苦草组中DOP的浓度值仅为对照组的58.0%,ρ(DOP)的变化范围在0.006~0.087mg/L。PP在对照组和苦草组也呈现了先上升后下降的趋势,其峰值都出现在20d,苦草组中PP的浓度值为对照组的80.5%,ρ(PP)的变化范围在 0.0035~0.1mg/L。在苦草种植初期,由于苦草还没有完全适应环境,植株长势较差,沉积物磷释放起了最主要的作用。沉积物早期过程主要以释放为主,上覆水中的各形态磷浓度上升到一定值后,然后下降。然而由于沉水植物苦草对不同形态磷影响的差异,导致各形态磷波动又有所不同。
由图4可知,在本试验条件下的沉积物上覆水系统中,TP中以有机磷为主,其所占比例的变化范围在76.42%~98.40%,其中PP在整个试验阶段平均约占42.24%,DOP平均约占48%,SRP平均约占9.76%。在不同的采样时间差异比较大。对于DOP和PP变化,苦草组大于对照组,而SRP的变化则是对照组大于苦草组。
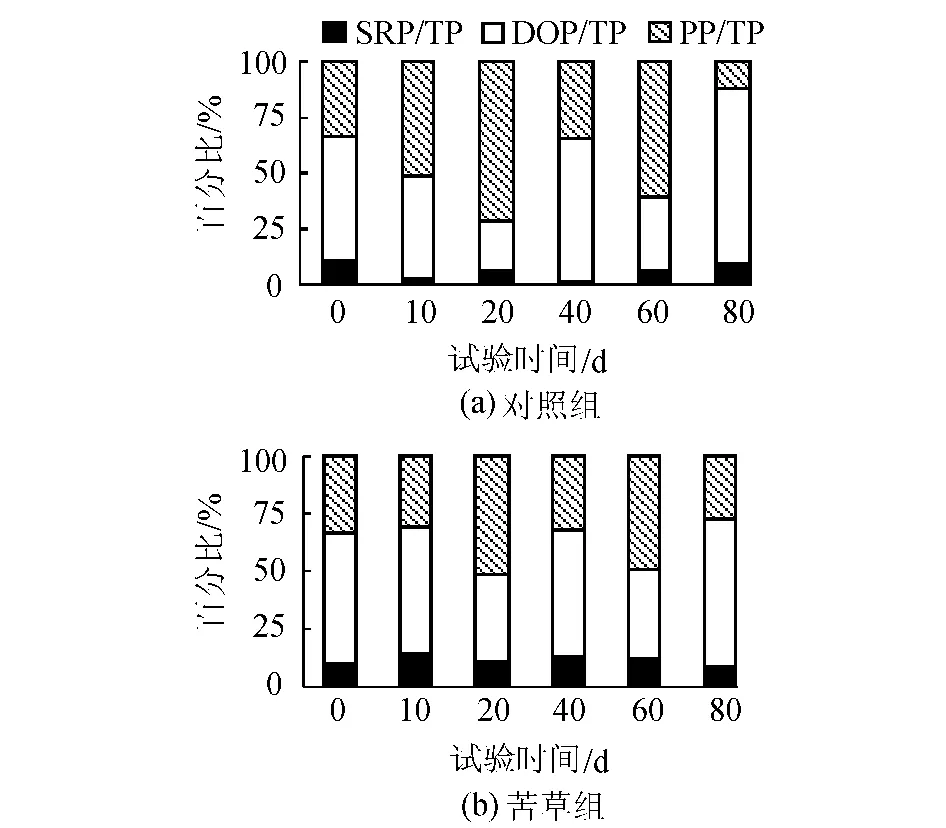
图4 各形态P在不同培养时间不同处理下占TP的比例
3 讨 论
3.1 苦草生长对沉积物磷释放速率的影响
沉水植物的生长状况以及生长特性会影响沉积物的释放与吸收,同时也直接影响到上覆水中各形态磷的变化。为此,本研究采用相对释放速率来定量描述各形态磷在其上升和下降阶段的不同释放速率。苦草处理中,将苦草和底质看作为一个统一的整体,来计算其向上覆水体释放总磷的相对速率;对照组中,计算底质(沉积物)向上覆水体释放总磷的相对速率[11]。计算公式如下:
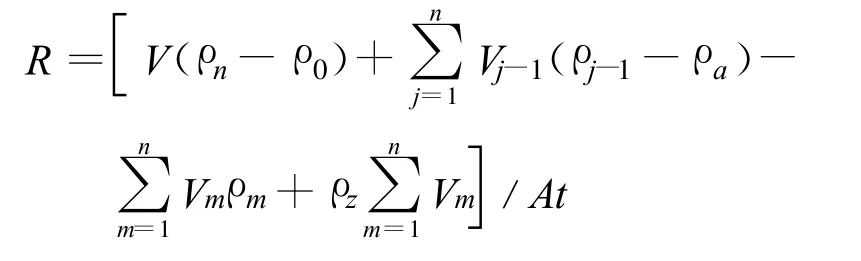
式中:R为磷释放速率,mg/(m2◦d);V为试验桶中上覆水体积,L;ρn为第n次采样时磷的质量浓度,mg/L;ρ0为磷初始值,mg/L;ρj-1为第j-1次采样时磷的质量浓度,mg/L;Vj-1为第j-1次采样体积,L;ρa为补偿采样量而添加自来水中磷的质量浓度,mg/L;Vm为第m次添加自来水体积,L;ρm为补偿蒸发量而添加的第m次自来水中磷的质量浓度,mg/L;ρz为蒸馏水中磷的质量浓度,mg/L;A为水-沉积物界面接触面积,m2;t为释放时间,d。
如表1所示,在植物种植初期,由于植物还没有完全适应环境,植物长势较差,沉积物磷释放起到最主要的作用,加上前期种植植物和加入上覆水对沉积物的扰动造成了沉积物磷的快速上升。对照组在早期过程主要以释放为主且释放相对速率高于苦草组,其中PP释放速度最高。上覆水的磷浓度上升到一定值后,然后下降。在下降阶段,不同处理组中各个形态磷的相对释放速率均呈现负释放,其中苦草组由于苦草生理代谢旺盛,对不同形态磷的吸收、吸附作用下导致其磷的负释放速率(吸收速率)高于对照组。对照组中TP的负释放主要由于颗粒态磷(PP)的沉降作用,SRP、DOP的负释放可能由于其上覆水中藻类的吸收所致。整个试验过程中苦草组上覆水的各形态磷浓度值均低于无沉水植物的对照组,这与通常认为沉水植物对水质具有净化作用的结果一样[12-13]。本试验结果与王圣瑞等[10]对黑藻影响上覆水磷形态研究结果有所差异,可能原因是黑藻与苦草不同的生长特性与吸收释放强度所致,同时也可能与所选取的沉积物不同有关。
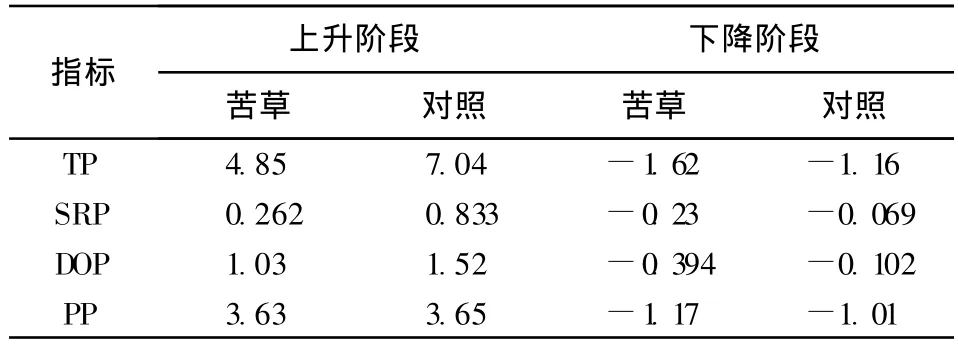
表1 各形态磷的相对释放速率 mg/(m2◦d)
一般来说,湖泊中的总磷绝大部分为有机磷(>90%),其中70%以上是悬浮态颗粒有机磷,剩下部分是溶解态及胶体态有机磷。而作为能被生物直接利用的无机态的溶解性正磷酸盐,其比例较小,不足湖水总磷的5%[14]。而本试验中PP(悬浮态颗粒磷)所占比例比自然水体要小,DOP为48%、SRP为9.76%,所占比例比自然水体高,这与本试验在室内进行、水体环境受外界干扰较小有关。
3.2 环境因子对上覆水磷浓度的影响
水体中的DO、pH值、温度等环境因子是影响沉积物磷释放的重要因素[15]。本试验中,苦草通过影响试验水体中的DO、pH值,进而间接影响到底泥磷的释放速率,最后可能导致上覆水各形态磷的差异。如图5(a)、(b),苦草组中的DO由于植物的光合作用释放氧气而明显高于对照组;同样的,由于植物吸收了CO2,苦草组的pH值小于对照组。水体中较高的溶解氧能提高水-沉积物界面的氧化还原电位(Eh),Eh的升高,导致Fe3+与磷酸盐结合成不溶的磷酸铁,可溶性磷也被氢氧化铁吸附而逐渐沉降,于是降低了底泥磷的释放速率[16]。pH值的升高,在弱碱条件下,沉积物轻微吸收磷,吸收量和吸收速率随pH值升高而升高[17],如图2、3所示,苦草组中上覆水中的TP、SRP、DOP的浓度均小于对照组,这与DO、pH值的影响不无关系。试验期间的环境温度如图5(c),前期温度一直持续在27~28℃左右,后期降至14~15℃,而较高温度会导致沉积物磷的释放,较低温下,水体中的磷向沉积物沉降[18]如图3,这与上覆水中各形态磷,尤其是与PP磷前期升高、后期下降的变化趋势是一致的。
3.3 间隙水对上覆水各形态磷浓度的影响
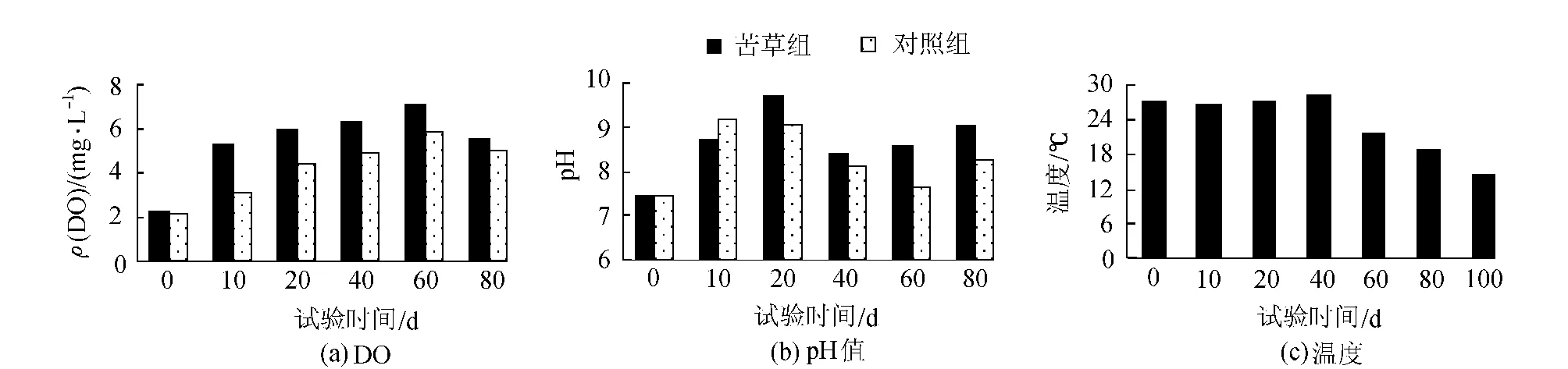
图5 上覆水中DO、pH值及温度的变化
如图5所示,间隙水中各形态磷浓度随培养时间的变化较为明显。比较图3与图6结果可见,总体上来讲,整个试验期间各处理间隙水中各形态磷浓度均高于上覆水,这表明了在整个试验期间各形态磷在上覆水与间隙水间存在较为明显的浓度梯度。苦草组间隙水中各形态磷浓度均低于对照处理组,这是由于苦草主要通过根部吸收间隙水中的可溶性磷[19],间隙水中DTP与SRP浓度与上覆水中DTP、SRP浓度的变化呈显著正相关(R2=0.75)。间隙水磷浓度的变化直接影响上覆水磷的浓度。在试验初期,苦草组间隙水中的DTP和SRP浓度为增加趋势并在40d左右达到峰值,而后为下降趋势。这可能与当时的环境温度较高(如图5(c)所示)、沉积物磷释放起了最主要的作用有关[20]。此后,TDP、SRP浓度降低,其原因可能为环境温度的降低,减弱了微生物解磷活性[21],导致沉积物中释放磷的减少进而使间隙水中磷浓度表现为下降趋势。
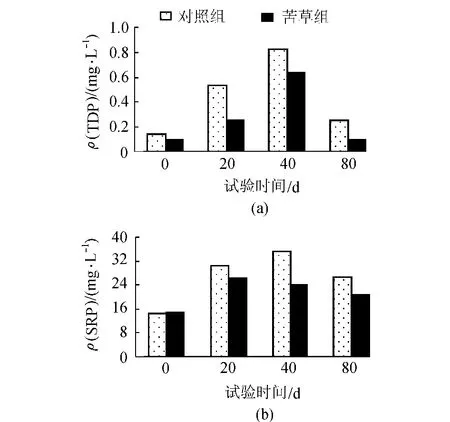
图6 间隙水中不同磷形态的变化
4 结 语
本试验条件下,沉水植物苦草对上覆水各形态磷影响明显。在苦草生长过程中因其对磷营养的需求和对环境因子DO、pH值的影响减缓了沉积物磷的释放速率,使得上覆水中TP、SRP 、DOP、PP均呈现不同程度的下降趋势,其浓度值小于无沉水植物的对照组。上覆水各形态磷以DOP为主,这与本试验在室内进行,受外界干扰效小有关。间隙水对上覆水各相态磷浓度的影响主要与环境温度的变化以及苦草根部直接吸收间隙水中的磷有关。
[1] ISEMANN K.Share of agriculture in nitrogen and phosphorous emissions into surface waters of Western Europe against the background of their eutrophication[J].Fertilizer Research,1990,26:253-269.
[2] DAVID L C.The role of phosphorus in the eutrophication of receiving water:a review[J].Journal of Environment Quality,1998,27:261-266.
[3] 吴重华,王晓蓉,孙昊.羊角月牙藻的生长与湖泊水中磷形态关系的建立[J].环境化学,1997,16(4):341-346.
[4] 周易勇,付永清.水体磷酸酶:来源、特征及生态学意义[J].湖泊科学,1999,11(3):274-282.
[5] 刘健康.高级水生生物学[M].北京:科学出版社,1999:224-240.
[6] PETTICREW E L,KALFF J.Water flow and clay retention in submergedmacrophyte beds[J].Can J Fish Aquat Sci,1992,49:2483-2489.
[7] STEPHEN D,MOSS B,GEOFF P.Do rooted macrophytes increase sediment phosphorus release?[J].Hydrobiologia,1997,342/343:27-34.
[8] HORPPILA J,NURMINEN L.Effects of different macrophyte growth forms on sediment and P resuspension in a shallow lake[J].Hydrobiologia,2005,545(1):167-175.
[9] 胡俊,丰民义,吴永红,等.沉水植物对沉积物中磷赋存形态影响的初步研究[J].环境化学,2006,25(1):28-31.
[10] 王圣瑞,金相灿,赵海超,等.沉水植物黑藻对上覆水中各形态磷浓度的影响[J].地球化学,2006,35(2):179-186.
[11] 范成新,张路,杨龙元,等.湖泊沉积物氮磷内源负荷模型[J].海洋与湖沼,2002,33(4):371-377.
[12] 吴振斌,邱东茹,贺峰,等.水生植物对富营养化水体水质净化作用研究[J].武汉植物学研究,2001,19(4):299-303.
[13] 高镜清,熊治延,张维昊,等.常见沉水植物对东湖重度富营养化水体磷的去除效果[J].长江流域资源与环境,2007,16(6):796-800.
[14] WETZEL R G.Limnology,2nd ed.[M].Philadelphia:Saunders Collage Publishing,1983.
[15] 黎颖治,夏北成.影响湖泊沉积物-水界面磷交换的重要环境因子分析[J].土壤通报,2007,38(1):162-166.
[16] 吴晓磊.人工湿地废水处理机制[J].环境科学,1995,16(3):83-86.
[17] 耿金菊,王强,牛晓君,等.环境因子对湖泊沉积物中吸附态磷化氢生成和释放的影响[J].环境科学学报,2005,25(5):681-685.
[18] JENSEN H S,ANDERSEN F O.Importance of temperature,nitrate and pH for phosphorus release from aerobic sediment of four shallow,eutrophic lake[J].Limnol Oceanogr,1992,37(3):577-589.
[19] WILHELM G,DORIS S.Influence of aquatic macrophytes on phosphorus cycling in lakes[J].Hydrobiologia,1988,170:245-266.
[20] SØNDERGAARD M,JENSEN J P,JEPPESEN E.Role of sediment and internal loading of phosphorus in shallow lakes[J].Hydrobiologia,2003,506-509,135-145.
[21] KIM Lee-Hyung,Choi E,STENSTROM M K.Sediment characteristics,phosphorus types and phosphorus release rate between river and lake sediments[J].Chemosphere,2003,50(1):53-61.
——以武汉紫阳湖为例

