环氧化酶-1在坐骨神经冷冻致神经病理性疼痛模型大鼠脊髓的表达
韩彬彬,冯艺
神经冷冻术(cryoanalgesia)是一种简便易行且有效的镇痛方法,目前仍被广泛用于临床治疗急性疼痛(如术后镇痛)和慢性疼痛。但有研究表明,神经冷冻会产生慢性神经病理性疼痛(neuropathic pain,NP),限制了它的推广[1-3]。我们的一项前瞻性随机对照研究表明,肋间神经冷冻镇痛增加术后痛觉过敏的程度,增加触诱发痛的发生率[4]。神经冷冻镇痛可能导致神经病理性疼痛这一现象已经引起临床医师们的关注,但发病机制目前尚不清楚。1994年Deleo等成功建立大鼠坐骨神经冷冻(sciatic cryoneurolysis,SCN)致神NP模型[5],为后来的试验研究提供了条件。环氧化酶(COX)是前列腺素合成的重要限速酶,它有两种主要存在形式:COX-1和COX-2,有研究发现在NP模型动物脊髓中环氧化酶表达上调,推测它对NP中枢敏化有重要作用。本研究旨在通过建立大鼠SCN致NP模型,动态观察大鼠疼痛行为学变化和脊髓水平的COX-1的表达,进一步探讨外周神经冷冻致NP的发病机制及环氧化酶在其中的作用,为完善冷冻镇痛技术,指导未来临床预防和治疗在神经冷冻治疗疼痛过程中引发的慢性疼痛提供理论依据。
1 材料与方法
1.1 模型制备[5]72只健康SD大鼠(北京维通利华实验动物技术有限公司提供),体重180~200 g,于北京大学人民医院实验动物中心(SPF级)预检3 d,动物饲养室有良好的通风和空气过滤系统,室温维持在23℃左右,湿度55%左右,自由摄食水。大鼠经水合氯醛(北京大学人民医院配制)按300 mg/kg腹腔注射麻醉后,在大鼠右侧下肢外侧局部皮肤备皮、消毒,在股骨大转子至膝关节沿线切皮约1.5 cm,从股二头肌间隙钝性分离出坐骨神经主干,使用丝线将距离分支前2 mm的坐骨神经主干略微提起但不超过皮面,用直径为1.8 mm的冷冻探头(北京库兰医疗设备有限公司,使用CO2作为低温气源,冷冻温度达-50℃)冷冻60 s。冷冻操作后,用0号丝线逐层缝合肌筋膜、浅筋膜和皮肤。整个过程持续约10 min。
1.2 实验分组 将大鼠随机分为3组:正常对照组(N组,n=6),假手术组(S组,n=33)和冷冻手术组(C组,n=33)。假手术组暴露坐骨神经后,仅用丝线将坐骨神经提起,使牵拉程度与冷冻手术组相同,持续60 s,不作冷冻操作,其余均同冷冻手术组。正常对照组未予任何处理。
1.3 疼痛行为学观察和评分 在制模前及制模后1、2和4周测量体重,测定机械痛阈,记录自噬评分,并观察大鼠下肢在安静和行走时是否正常。所有测定均在固定时间和安静的环境下进行。
机械痛阈的测定:将大鼠置于相互隔开的透明有机玻璃容器内,预适应15 min,采用8根不同质量(1 g 、2 g 、4 g 、6 g 、8 g 、15 g 、26 g 、60 g)的 Von Frey hairs纤维丝(Stoeling Co.,Wood Dale,IL,USA)垂直刺激后足底部,弯曲至90°,持续6~8 s,大鼠在刺激时或之后即刻出现抬后足,延迟放落,抖动,舔食该足等均认为阳性,最后应用Dixon报道的 up and down方法[6]推算出大鼠50%机械缩足阈。
如果痛阈较制模前下降≥2个级别(相邻2根纤维丝的质量范围为1个级别),认为出现了痛觉过敏。
采用Wall报道的方法进行自噬评分[7]:当后爪有血迹或皮肤破损记1分,另外任何一个脚趾的近段或远端被咬破时再记1分,最高为11分。
1.4 免疫组织化学染色 各时间点C组、S组各取6只大鼠腰膨大脊髓,采用免疫组化方法检测COX-1的表达。大鼠在麻醉后(同前),开胸经左心室插管进入主动脉根部,剪开右心耳,灌注4℃生理盐水200 ml冲尽血液,然后采用4%多聚甲醛200 ml灌注固定1 h。取腰膨大脊髓,浸入4%多聚甲醛后固定6 h,20%蔗糖脱水24 h,保存于4℃30%蔗糖中。取脊髓节段,在冷冻切片机中进行冠状面冰冻切片,片厚 10 μ m。3%H2O2孵育10 min;羊血清室温孵育 10 min;滴加按 1∶200稀释的兔抗 COX-1抗体(Cayman,MI,USA),4℃过夜;滴加羊抗兔二抗(北京中杉金桥生物技术有限公司)室温孵育20 min,DAB显色,苏木素复染。阴性对照以PBS代替一抗,余步骤相同。于光学显微镜(日本Olympus公司)下观察,以细胞核内出现棕黄色颗粒为COX-1免疫组化染色阳性。在脊髓背角浅层,于400×高倍镜下随机选取3个视野,应用Leica图像分析软件分析每个视野平均灰度值和阳性面积,以两者的乘积的平均值代表每只大鼠脊髓COX-1表达强弱。
1.5 统计学处理 所有数据采用SPSS 13.0统计软件包进行统计分析,计量数据以(±s)表示,组间比较采用单因素方差分析,组内比较采用配对t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 神经病理性疼痛模型的建立 大鼠SCN后患侧下肢运动障碍,表现为特异行为:苏醒后患肢足背着地屈指保护位,脚掌不能着地行走,轻微水肿,随后患肢较对侧萎缩变细,2周时逐渐恢复正常形态和运动功能,几乎接近正常。C组和S组大鼠体重增长与N组无显著性差异。见表1。
术后1周患侧机械性缩足阈明显升高,高于基础值和其他两组,2周时降至基础水平,4周时再下降,低于基础值和正常对照组;术后1周、2周和4周对侧下肢机械性缩足阈均低于基础值和正常对照组。S组双侧下肢机械性缩足阈术后1周、2周和4周均下降低于基础值,而且对侧低于正常对照组。见表2。
C组术后2周及4周痛觉过敏发生率为48%和38%,高于S组33%和19%,但差异无统计学意义,患侧和对侧痛觉过敏发生率无显著性差异。见表3。
自噬后足现象仅发生在C组,自噬评分高于S组。见表4。
术后1周发生率为40%,2周时新增3.8%,4周时新增5%。
2.2 脊髓COX-1蛋白表达 冷冻后2周和4周冷冻手术组脊髓背角浅层COX-1表达上调,高于S组,且双侧脊髓COX-1表达无差异。见表5。
形态上观察,表达COX-1的细胞主要为灰质内神经元细胞和少量散在分布于白质内的大个细胞,经免疫荧光共染证实分别为神经元和小胶质细胞。脊髓背角神经元胞体小,数量多,呈游鱼样分布,腹角内神经元胞体大,数量少,神经元细胞核表达为主,可见核内密集的阳性颗粒;而在白质胶质细胞胞浆内有明显的COX-1表达。
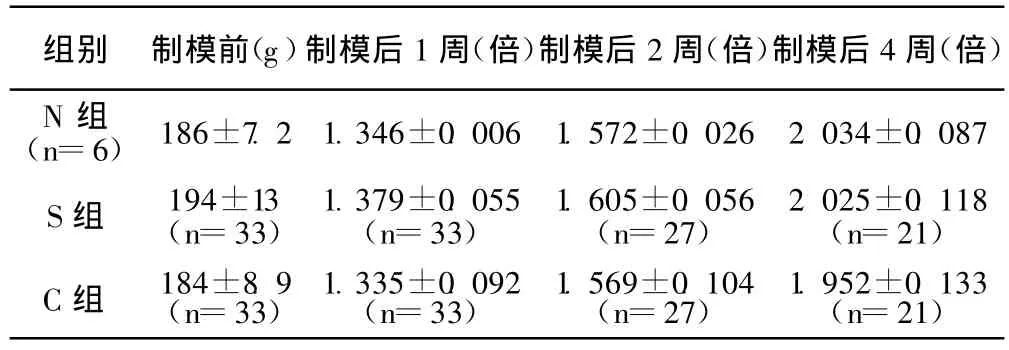
表1 正常对照组、S组和 C组大鼠体重较基础值增长的比较

表2 N组,S组和C组术后各时间点大鼠双侧下肢50%机械缩足阈(g)
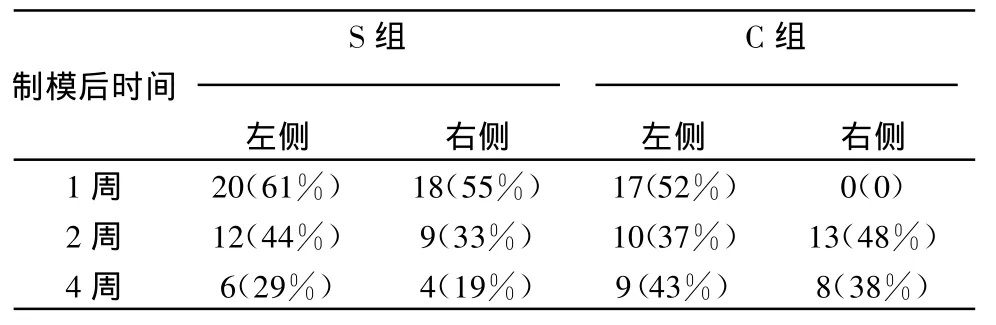
表3 S组和C组术后大鼠痛觉过敏发生率的比较[n(%)]

表4 S组和C组术后大鼠双侧后足自噬评分比较

表5 S组和C组术后腰段脊髓背角浅层COX-1表达强弱比较(n=6)
3 讨论
大鼠坐骨神经冷冻是研究人类外周神经冷冻镇痛致NP的良好动物模型。Deleo等 1994年的研究显示,大鼠SCN后双侧下肢在术后2至3周开始出现触诱发痛,持续到术后10周[8]。这与我们的研究结果一致。大鼠冷冻侧下肢先麻痹,2周时缩足阈和运动功能恢复到术前水平,4周出现痛觉过敏,而对侧1周时开始出现痛觉过敏直到实验结束,一侧SCN致双侧下肢发生触诱发痛这种镜像现象提示我们中枢神经系统敏化或去抑制可能参与NP的形成,另外痛觉过敏延迟发生也进一步证明外周神经局部损伤后,可能局部产生炎性介质或神经递质逆行转运至中枢,引起中枢敏化或去抑制这一过程,中枢重塑是触诱发痛延迟出现并持续数周的基础。Deleo等1999年的研究发现,大鼠脊神经冷冻后7 d,双侧脊髓胶质细胞激活,表明冷冻确实引起中枢重塑,进而中枢敏化,产生持久的触诱发痛[9]。
大鼠自噬后足的行为是NP的特点,外周神经切断和慢性压迫均产生自噬现象。Wall等认为完全性切断神经自噬率最高[7],Selter和Kim等的研究中脊神经结扎和坐骨神经部分结扎模型没有自噬行为发生[10-11]。本研究中自噬仅发生在冷冻侧后足,术后1周发生率高达 40%,低于 Deleo等的研究结果76%[1]。自噬的相关机制还不清楚。Deleo等1995年研究大鼠坐骨神经冷冻后局部神经的病理学表现,发现冷冻后1周,巨噬细胞浸润最多,神经纤维Wallerian变性最严重,小纤维开始再生,自噬发生与纤维再生和炎性细胞浸润相关[12]。可以推测外周神经损伤后,在修复过程中再生纤维异常放电或炎性介质逆传至中枢,兴奋中枢,引起患肢感觉异常而出现自噬现象。这可以解释自噬为什么不是在冷冻后很快发生,而往往在三四天后开始出现,术后一二周自噬最严重,这正是感觉和运动功能开始恢复的时间。
COX-2在炎性疼痛、癌性疼痛和神经病理性疼痛的发生和维持中起重要作用。很多研究已证明COX-1和COX-2在脊髓中均有基础表达,而且多种神经病理性疼痛模型中以及临床实践中给予COX-2抑制剂不能缓解疼痛。这可能是COX-1在脊髓表达上调从而发挥作用。通过对基因敲除小鼠的研究表明,在疼痛中发挥作用的环氧化酶是COX-1,而不是COX-2。在手术切口和外周神经损伤后,脊髓COX-1表达上调,给予COX-1抑制剂能剂量依赖性减轻触诱发痛[13-15]。本预试验表明,大鼠坐骨神经冷冻后脊髓COX-2表达无明显改变,而COX-1表达上调了。采用免疫组化的方法确定脊髓中COX-1的表达,冷冻后2周和4周双侧脊髓背角浅层COX-1表达上调。这与双侧触诱发痛的时间一致。因此,脊髓COX-1表达参与大鼠SCN后NP的维持。Zhang在大鼠炎性疼痛模型中发现,脊髓小胶质细胞增殖活化,表达COX-1增加[16];Deleo在坐骨神经冷冻模型中也发现胶质细胞增殖活化,以星形胶质细胞更明显[9]。本研究显示,从细胞形态学上看脊髓中的COX-1主要由灰质神经元和白质小形胶质细胞表达。这与Deleo的研究结果一致,即坐骨神经冷冻后脊髓小形胶质细胞增殖活化,表达COX-1增加。
综上所述,大鼠SCN模型成功地模拟了临床中外周神经冷冻先镇痛后致痛这一病理过程,为NP的发病机制和治疗的研究提供了理论基础。COX-1在冷冻致NP的维持中起重要作用,提示非选择性环氧化酶抑制剂或选择性COX-1抑制剂可能对缓解冷冻后NP有作用。
[1]Callesen T,Bech K,Thorup J,et al.Cryoanalgesia:effect on postherniorrhaphy pain[J].Anesth Analg,1998,87(4):896-899.
[2]Muller L C,Salzer G M,Ransmayr G,et al.Intraoperative cryoanalgesia for postthoracotomy pain relief[J].Ann Thorac Surg,1989,48(1):15-18.
[3]Conacher ID,Locke T,Hilton C.Neuralgia after cryoanalgesia for thoracotomy[J].Lancet,1986,1(8475):277.
[4]Ju H,Feng Y,Yang BX,et al.Comparison of epidural analgesia and intercostal nerve cryoanalgesia for post-thoracotomy pain control[J].Eur JPain,2008,12:378-384.
[5]Deleo JA,Coombs DW,Willenbring S,et al.Characterization of a neuropathic pain model:sciatic cryoneurolysis in the rat[J].Pain,1994,56:9-16.
[6]Chaplan SR,Bach FW,Pogrel JW,et al.Quantitative assessment of tactile allodynia in the rat paw[J].JNeurosci Methods,1994,53:55-63.
[7]Wall PD,Devor M,Inbal R,et al.Autotomy following peripheral nerve lesions:experimental anaesthesia dolorosa[J].Pain,1979,7(2):103-111.
[8]Willenbring S,Deleo AJ,Coombs DW,et al.Differental behavioral outcomes in the sciatic cryoneurolysis model of neuropathic pain in rats[J].Pain,1994,58:135-140.
[9]Colburn RW,Rickman AJ,DeLeo JA,et al.The effect of site and type of nerve injury on spinal glial activation and neuropathic pain behavior[J].Exp Neurol,1999,157:289-304.
[10]Kim SH,Chung JM.An experimental modal for peripheral neuropathy produced by segmental spinal nerve ligation in the rat[J].Pain,1992,50:355-363.
[11]Shelter Z,Dubner R,Shir Y,et al.A novel behavioral modal of neuropathic pain disorders produced in rats by partial sciatic nerve injur[J].Pain,1990,43:205-218.
[12]Wagner R,DeLeo JA,Heckman HM,et al.Peripheral nerve pathology following sciatic cryoneurolysis:relationship to neuropathic behaviors in the rat[J].Exp Neurol,1995,133:256-264.
[13]Zhu X,Conklin D,Eisenach JC,et al.Cyclooxygenase-1 in the spinal cord plays an important role in post-operative pain[J].Pain,2003,104:15-23.
[14]Kroin JS,Takatori M,Li J,et al.Upregulation of dorsal horn microglial cyclooxygenase-1 and neuronal cyclooxygenase-2 after thoracic deepmuscle incisions in the rat[J].Anesth Analg,2008,106(4):1288-1295.
[15]Zhu X,Eisenach JC.Cyclooxygenase-1 in the spinal cord is altered after peripheral nerve injury[J].Anesthesiology,2003,99:1175-1179.
[16]Zhang FY,Wan Y,Zhang ZK,et al.Peripheral formalin injection induces long-lasting increases in cyclooxygenase-1 expression by microglia in the spinal cord[J].JPain,2007,8(2):110-117.

