提高耦合系统A TP再生效率促进谷胱甘肽合成的研究
林军, 廖鲜艳*, 堵国成, 陈坚
(1.江南大学工业生物技术教育部重点实验室,江苏无锡 214122;2.江南大学生物工程学院,江苏无锡 214122)
提高耦合系统A TP再生效率促进谷胱甘肽合成的研究
林军1,2, 廖鲜艳*1,2, 堵国成1,2, 陈坚1,2
(1.江南大学工业生物技术教育部重点实验室,江苏无锡 214122;2.江南大学生物工程学院,江苏无锡 214122)
利用重组Escherichia coliΔadd/ade(pBV03)和S accharomyces cerevisiaeWSH2构建了一个生物合成谷胱甘肽(GSH)的种间耦合系统。在该耦合系统中,一方面,大肠杆菌腺苷脱氨酶和腺嘌呤脱氨酶的缺失完全切断了E.coliΔadd/ade(pBV03)中不可逆转化腺苷(Ado)生成次黄嘌呤(Hx)的途径;另一方面,利用脯氨酸限制性培养降低了酿酒酵母WSH2中ADE的活性,进一步降低了耦合系统中从Ado到Hx的不可逆转化。以上两方面大大降低了耦合系统中从Ado到Hx的不可逆转化,从而保证更多的底物Ado被S.cerevisiaeWSH2用于再生ATP,最终耦合系统中A TP再生的效率大大提高。反应6 h后,该耦合系统GSH的合成量达到13.68 mmol/L,为对照的5.14倍。
谷胱甘肽;生物合成;耦合系统;大肠杆菌;酿酒酵母
谷胱甘肽(GSH)是广泛存在于动、植物及微生物细胞内的一种小分子巯基化合物,具有保护细胞免受重金属侵害、维持胞内氧化还原平衡和辅助蛋白质复性等重要的生理功能[1-2]。近年来,GSH广泛应用于医药、食品和化妆品等工业,需求量日益增加,我国GSH工业化生产呈空白状态[3-4]。
谷胱甘肽在生物体内是由γ-谷氨酰半胱氨酸合成酶(EC 6.3.2.2,GSH I)和GSH合成酶(EC 6.3.2.3,GSH II)在ATP存在的条件下,催化L-谷氨酸、L-半胱氨酸和甘氨酸进行序贯反应而形成的[5]。因此,满足ATP的有效供给是实现酶法合成GSH的一个必需条件。由于ATP价格昂贵,直接添加A TP大大增加了酶法合成GSH的成本;同时,高浓度的ATP及其代谢产物ADP也抑制GSH合成酶的活性,由此导致GSH的酶法生产至今未能实现商业化。但是,这些问题可以通过在酶法合成GSH的过程中构建一个ATP再生的系统来解决[6]。ATP再生系统可定义为一个消耗A TP的酶催化体系和一个生物合成ATP的体系所构成的耦合系统[7]。
在前期的研究中,构建了一系列由重组大肠杆菌(Escherichia coli)和酿酒酵母(S accharomyces cerevisiae)组成的A TP再生系统用于生物合成GSH[8-10]。一方面,酿酒酵母中的糖酵解途径以腺苷(Ado)为底物合成ATP,Ado在腺苷激酶和腺苷酸激酶的催化下生成ADP,ADP进一步通过底物磷酸化转化为ATP,此过程需要消耗葡萄糖[11]。另一方面,消耗酿酒酵母合成的ATP,高效表达GSH合成酶系的重组大肠杆菌利用3种前体氨基酸合成GSH,此过程中ATP的代谢产物ADP和Ado可再次被酿酒酵母用来合成ATP。然而,对耦合系统中嘌呤核苷酸代谢分析结果表明,重组大肠杆菌中腺苷脱氨酶(EC 3.5.4.4,ADA)和腺嘌呤脱氨酶(EC 3.5.4.2,ADE)迅速将底物Ado不可逆转化为次黄嘌呤(Hx),导致酿酒酵母不能获得合成ATP的前体腺嘌呤核苷(酸),从而无法实现耦合系统的ATP再生,这是耦合系统ATP再生效率低下的根本原因[8-9]。此外,酿酒酵母中存在的ADE加剧了从Ado到Hx的不可逆转化,见图1。因此,如果能采取合适的手段消除大肠杆菌中的ADA和ADE以及酿酒酵母中的ADE,那么耦合系统中从Ado向Hx的不可逆转化途径将被切断,从而保证更多的底物Ado被酿酒酵母用来再生ATP,那么耦合系统的ATP再生效率将明显提高, GSH的合成量也将相应增加。

图1 用于GSH合成的重组大肠杆菌和酿酒酵母耦合ATP再生系统示意图Fig.1 Schematic diagram of GSH production and ATP regeneration by the coupled system
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 酿酒酵母S.cerevisiaeWSH2:作者所在研究室保存菌株;质粒pBV03(包含两拷贝的γ-谷氨酰半胱氨酸合成酶基因和单拷贝的GSH合成酶基因):由作者所在实验室廖鲜艳博士构建[12];大肠杆菌E.coliBW25113、E.coliJ W1615、E.coliJ W3640和质粒p KD46:购自美国耶鲁大学大肠杆菌保藏中心[13];重组大肠杆菌E. coliΔadd/ade(pBV03):作者构建。
1.1.2 试剂 三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、单磷酸腺苷(AMP)、腺苷(Ado)、腺嘌呤(Ade)、肌苷(Ino)、和次黄嘌呤(Hx):Sigma-Aldrich上海公司产品;GSH还原酶、NADPH和5,5′-二硫双-(2-硝基苯甲酸)(DTNB)等:Sigma-Aldrich上海公司产品;脯氨酸(Proline)、Taq DNA聚合酶、卡那霉素、氨苄青霉素、引物、胶回收试剂盒和质粒提取试剂盒:Sangon上海公司产品;酵母粉和胰蛋白胨:Oxoid公司产品。
1.2 方法
1.2.1 构建腺苷脱氨酶和腺嘌呤脱氨酶双基因突变株E.coliΔadd/ade(pBV03) 参照Datsenko和Wanner[14]的方法,敲除腺苷脱氨酶(ADA)突变株(E.coliJ W1615)中的腺嘌呤脱氨酶(ADE)基因以构建add/ade双基因缺失菌株(E.coliΔadd/ade)。首先将表达Red重组酶的质粒p KD46导入E.coliJ W1615,在含有100 mg/L氨苄青霉素的LB(酵母粉5 g/L,胰蛋白胨10 g/L, NaCl 10 g/L)固体平板上筛选转化子(培养温度为30℃)。然后制备用于电转化的感受态细胞,当菌体OD600达到0.2时,加入1 mmol/L L-阿拉伯糖诱导表达Red重组酶,诱导时间不少于1 h,OD600约为0.6时收获菌体,制备感受态细胞。利用电转化法将用于同源重组的片段导入感受态细胞内。用于同源重组的片段是以A1(5’-GA GGATTTGCGGGTTCACA-3’)和A2(5’-TGGCGATTCA GGGCTTTAC-3’)为引物,以大肠杆菌ADE突变株E.coliJ W3640的染色体基因为模板,获得含有卡那霉素抗性的PCR片段。然后,迅速向电转后的感受态细胞中加入1 mL LB(酵母粉5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,p H 7.0)培养基,30℃培养1 h后升温至42℃培养1 h。最后,取适量培养后的菌液涂布于含有25 mg/L卡那霉素的LB固体平板。次日,通过点种试验选择具有卡那霉素抗性但不具有氨苄青霉素抗性的转化子,以A1和A2为引物,通过PCR片段的大小验证腺嘌呤脱氨酶基因的缺失。最后,通过电转化将质粒pBV03导入重组大肠杆菌Δadd/ade中用于GSH的生物合成。
1.2.2 重组大肠杆菌的培养 从固体LB(酵母粉5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,琼脂2 g/dL,p H 7.0)培养基上挑取单菌落接种至装有20 mL种子培养基的250 mL三角瓶中,30℃、200 r/min下培养10~14 h。将培养好的种子液按体积分数1%的接种量接种至装有100 mL LB培养基的500 mL三角瓶中进行发酵培养,发酵温度30℃,摇床转速200 r/min,当菌体培养至对数生长中后期时,迅速转至42℃摇床,诱导培养3~5 h。发酵液经4800g离心后,再用冰冷的20 mmol/L磷酸钾缓冲液洗涤2次,得到的湿菌体在-80℃下保存,以用于后续生物合成GSH的研究。各培养基中根据需要添加100 mg/L氨苄青霉素。
1.2.3 酿酒酵母WSH2的培养 接种后的斜面(8°P麦汁,琼脂2 g/dL,p H 5.5)置于30℃恒温培养箱中培养2 d,冰箱冷藏室中保藏,每月至少转接一次。将斜面种子于30℃活化3~4 h,取一环菌体接种至装有50 mL种子培养基(葡萄糖20 g/L,蛋白胨20 g/L,酵母膏10 g/L,p H 5.5)的500 mL三角瓶中培养,摇床转速200 r/min,温度30℃,培养时间20 h。将培养好的种子培养液按照体积分数10%的接种量接种至装有50 mL发酵培养基(葡萄糖25 g/L,蛋白胨20 g/L,酵母膏10 g/ L,p H 5.5)的500 mL三角瓶中进行发酵培养,发酵18 h,发酵温度30℃,摇床转速200 r/min。发酵液经3 000g离心后再用20 mmol/L磷酸钾缓冲液洗涤2次,得到的湿酵母细胞在-80℃下保藏,备用。脯氨酸基本培养基参照文献[15],脯氨酸的添加量为2 g/L。
1.2.4 重组大肠杆菌对外加Ado和ATP的代谢实验 称取200 mg新鲜培养的大肠杆菌菌体,加入2 mL含有5 mmol/L Ado(或A TP)的磷酸钾缓冲液(p H 7.0),加入体积分数0.5%的甲苯进行通透性处理,37℃、150 r/min振荡反应20 min (ATP代谢实验时间为2 h)。反应完成后,将反应液置于沸水浴中加热10 min终止反应,10 000 r/min离心,得到的上清液稀释后用作腺嘌呤核苷酸类物质的分析检测。
1.2.5 酿酒酵母WSH2对外加Ado和Ade的代谢实验 称取400 mg新鲜培养的酿酒酵母菌体,加入2 mL含有10 mmol/L Ado(或Ade),400 mmol/L葡萄糖,10mmol/LAdo,1mmol/L AMP,0.1mmol/LNAD,30mmol/LMgCl2·6H2O的150 mmol/L磷酸钾缓冲液(p H 7.0),加入体积分数0.5%的甲苯进行通透性处理,37℃、150 r/min振荡反应2 h。反应完成后将反应液置于沸水浴中加热10 min终止反应,10 000 r/min离心,上清液经稀释后用作腺嘌呤核苷酸类物质的分析检测。
1.2.6 耦合系统合成GSH的反应体系 耦合系统基础反应液组成(mmol/L):葡萄糖400,Ado 10, AMP 1,NAD 0.1,MgCl2·6H2O 30,L-Glu 60,LCys 25,Gly 25,磷酸钾缓冲液(p H 7.0)150,用2 mol/L KOH溶液调节p H 7.0。称取解冻的重组大肠杆菌湿菌体(反应体系中湿菌体质量浓度为200 mg/mL)和解冻的酵母湿菌体(反应体系中湿菌体质量浓度为200 mg/mL),加入耦合系统基础反应液,加入体积分数0.5%的甲苯,37℃、150 r/min下振荡反应6 h,样品于沸水浴中加热终止反应,离心收集上清液,将上清液稀释一定的倍数,测定上清液中GSH和ATP及其相关物质。
1.2.7 谷胱甘肽测定 采用DTNB(5,5’-二硫双-(2-硝基苯甲酸))-GSH还原酶循环法[16]。在2 mL比色皿中顺序加入100μL、6 mmol/L DTNB,700μL、0.3 mmol/L NADPH和200μL适当浓度的样品,室温下加入100μL、50 U/mL谷胱甘肽还原酶用以启动测定反应,在412 nm下,测定反应体系的起始OD值以及90 s后的OD值,根据OD值的变化速率与GSH标样质量浓度关系计算出样品中的GSH质量浓度。
1.2.8 ATP及其相关物质测定 采用高效液相色谱测定(HPLC)[17]。色谱条件如下:柱子为Hypersil ODS,4.6 mm×200 mm;柱温35℃;检测器UV 254 nm;流动相A为0.1 mmol/L KH2PO4,2 mol/LKOH调p H 7.0。流动相B为100% CH3OH,梯度洗脱为:0~5 min,100%A,流速1 mL/min;5~25 min,90%A,10%B,流速1.5 mL/ min。
2 结果与讨论
2.1 构建重组大肠杆菌Δadd/ade(pBV03)
将用于同源重组的片段导入含有质粒p KD46的E.coliJ W1615感受态细胞中,在L-阿拉伯糖诱导产生的Red重组酶的作用下,E.coliJ W1615染色体中的ade基因与重组片段发生同源重组,从而被卡那霉素抗性基因替代。以A1和A2为引物对,以E.coliJ W1615(add-)、E.coliJ W3640(ade-)和E.coliΔadd/ade的染色体基因为模板进行PCR时,它们的PCR片段长度依次为2.6、2.2、2.2 kb。电泳结果表明,E.coliJ W1615染色体中的ade基因已成功被用于同源重组的卡那霉素抗性基因取代。同时,PCR产物经Sangon(上海)测序后表明,其序列与设计的一致,由此确证重组E.coliΔadd/ade构建成功,见图2。
2.2 重组大肠杆菌Δadd/ade(pBV03)对外加Ado和ATP的代谢

图2 大肠杆菌add/ade双突变株的PCR验证Fig.2 PCR verification ofE.coliΔadd/ade
作者前期的研究[9]表明,腺苷脱氨酶(ADA)的缺失可以切断大肠杆菌将腺苷(Ado)经肌苷(Ino)向次黄嘌呤(Hx)不可逆转化的途径,但是由于从Ado经腺嘌呤(Ade)向Hx转化途径的存在,导致Ado依然可以转化为Hx。腺苷脱氨酶和腺嘌呤脱氨酶(ADE)的同时缺失将有可能完全切断大肠杆菌中从Ado到Hx的转化途径。为此检测了E.coliΔadd/ade(pBV03)对5 mmol/L外加Ado的代谢产物。从图3可以看出,当以Ado为底物时,反应20 min后,仍有48.6%的Ado未被转化,Ado的主要转化产物为ADP和Ade,反应体系中未检测到肌苷(Ino)和Hx的生成。与之相比,大肠杆菌BW25113在20 min内可以将62.9%的Ado不可逆转化为Hx[9]。在用于生物合成GSH的种间耦合系统中,大肠杆菌的主要功能为消耗酿酒酵母合成的ATP,并利用其自身表达的GSH合成酶系催化3种前体氨基酸来生物合成GSH。因此,进一步检测了E.coliΔadd/ade(pBV03)对5 mmol/L外加A TP的代谢情况。从图3可以看出,反应2 h后,ATP的主要代谢产物为ADP、AMP、Ade和Ado,未生成Ino和Hx。以上结果表明,在E.coliΔadd/ade(pBV03)中,从Ado到Hx的不可逆转化完全被切断,大肠杆菌利用ATP后的代谢产物均为可被酿酒酵母用来再生ATP的底物。因此。以此菌株构建种间耦合系统,其ATP的再生效率将明显提高。

图3 重组大肠杆菌Δadd/ade(pBV03)对Ado和ATP的代谢Fig.3 Ado and ATP metabolisms byE.coliΔadd/ade (pBV03)
2.3 酿酒酵母WSH2对外加Ado和Ade的代谢
大肠杆菌ADA和ADE的缺失完全消除了其自身将Ado(或ATP)不可逆转化为Hx的能力,E.coliΔadd/ade(pBV03)利用ATP后的主要代谢产物为Ade和Ado。在此基础上,进一步研究了作为种间耦合系统组成之一的S.cerevisiaeWSH2对Ado和Ade的代谢情况。从图4可以看出,反应2 h后,约88%的底物Ado被S.cerevisiaeWSH利用并转化为AMP、ADP和ATP,反应体系中检测不到Ino和Hx的生成。由此可知,虽然有少量关于S.cerevisiaeWSH2中存在ADA的报道[18],但是本研究所构建的反应体系中ADA的活性极低,其对Ado的降解作用可以忽略,这一点与Deeley[19]的研究结果一致。此外,在反应过程中也未检测到Ade的生成,这说明S.cerevisiaeWSH2并不具备将底物Ado转化为Ade的代谢途径。然而,当以Ade为底物反应2 h后,反应体系中除了检测到ATP、ADP和AMP外,还检测到Hx(1.97 mmol/L)和Ino(0.67 mmol/L),约20%的Ade不可逆转化为Hx,由此确证了酿酒酵母中存在ADE。综上所述,与大肠杆菌类似,酿酒酵母中也存在ADE,其催化Ade不可逆转化为Hx,但是,酿酒酵母中ADA的活性极低,其对Ado的降解可以忽略。

图4 酿酒酵母WSH2对Ado和Ade的代谢Fig.4 Ado and Ade metabolisms byS.cerevisiaeWSH2
尽管S.cerevisiaeWSH2不具备将Ado转化为Ade的能力,但是重组E.coliΔadd/ade(pBV03)可以催化Ado生成Ade,此时,酿酒酵母中的ADE便可催化Ade不可逆转化为Hx,从而减少了可以用于再生ATP的底物Ado和Ade。因此,在重组E.coliΔadd/ade(pBV03)和S.cerevisiaeWSH2构建的生物合成GSH的耦合系统中,如果可以消除或抑制酿酒酵母中ADE对Ade的降解作用,那么将有更多的Ado和Ade可用来再生A TP,耦合系统的ATP再生效率将进一步提高,GSH的产量也会相应增加。Deeley[19]的研究表明,生长在脯氨酸为惟一氮源的基本培养基中的酿酒酵母,其ADA的活性比生长于完全培养基中的酿酒酵母降低了约7倍。据此,作者采用培养于脯氨酸基本培养基中的S.cerevisiaeWSH2和重组E.coliΔadd/ade(pBV03)构建新的耦合系统,并考察了该耦合系统中的ATP代谢情况。从图5可以看出,反应6 h后,其Hx的生成量比对照(生长于完全培养基中的S.cerevisiaeWSH2组成的耦合系统)低46.7%,而Ade的量要高162.1%。结果表明,抑制酿酒酵母中腺嘌呤脱氨酶活性可以明显降低耦合系统中从Ade到Hx的不可逆转化。
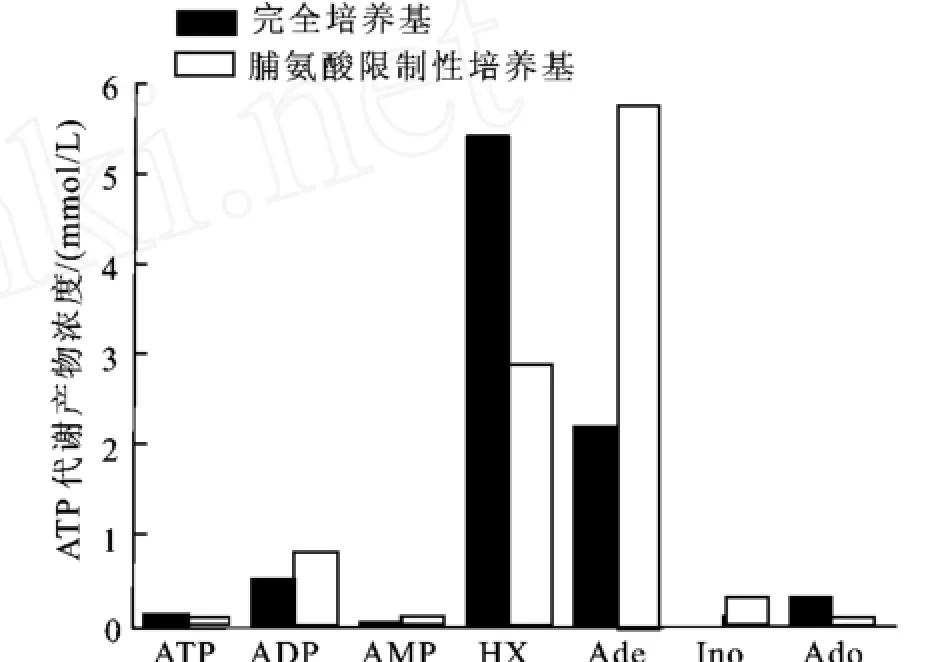
图5 生长于完全培养基和脯氨酸基本培养基的S.cerevisiaeWSH2中ATP代谢的比较Fig.5 Comparision of ATP metabolism ofS.cerevisiae WSH2 cultured in the complete medium and the proline minimal medium
2.4 耦合系统合成GSH能力的比较
从图6可以看出,反应6 h后,由E.coliΔadd/ ade(pBV03)和S.cerevisiaeWSH2组成的耦合系统合成GSH的量为10.95 mmol/L,与E.coliBW25113(pBV03)和S.cerevisiaeWSH2组成的耦合系统相比,提高了3.12倍。众所周知,每合成1 mol/L GSH需要消耗2 mol/L ATP,因此要合成10.95 mmol/L GSH至少需要消耗21.90 mmol/L ATP,这远高于起始添加的10 mmol/L Ado可合成的ATP。由此可知,在E.coliΔadd/ade(pBV03)和S.cerevisiaeWSH2组成的耦合系统中,ATP再生反应得以建立。该耦合系统中ATP再生效率和GSH产量的提高是由于大肠杆菌ADA和ADE的缺失切断了从Ado到Hx的不可逆转化途径,从而保证有更多的底物Ado和Ade用于再生A TP。在此基础上,利用脯氨酸限制性培养来降低S.cerevisiaeWSH2中腺嘌呤脱氨酶的活性,从而进一步降低了底物Ado经Ade到Hx的降解,进而增强了耦合系统中ATP再生的效率,由此低ADE活性的酿酒酵母和E.coliΔadd/ade(pBV03)组成的耦合系统在6 h内合成13.68 mmol/LGSH,相比于完全培养基培养的S.cerevisiaeWSH2构建的耦合系统提高了24.9%,为初始耦合系统的5.14倍。

图6 耦合系统合成GSH的能力比较Fig.6 Comparision of GSH production by the coupled system
3 结 语
A TP的有效供给是实现酶法合成GSH的必需条件之一。在由重组大肠杆菌和酿酒酵母组成的耦合系统中,底物Ado被不可逆转化为Hx,从而导致酿酒酵母缺乏可用来合成ATP的底物,这是耦合系统无法高效运行的根本原因。作者通过基因工程的手段敲除了大肠杆菌中腺苷脱氨酶和腺嘌呤脱氨酶的基因,并且利用脯氨酸限制性培养来降低酿酒酵母中的腺嘌呤脱氨酶活性,从而大大降低了耦合系统中从Ado到Hx的不可逆转化,进而促使更多的底物Ado被用于再生A TP,最终耦合系统中A TP再生的效率大大提高,GSH合成量也相应增加。
[1]Carmel-Harel O,Storz G.Roles of the glutathione-and thioredoxin-dependent reduction systems in theEscherichia coliandSaccharomyces cerevisiaeresponses to oxidative stress[J].Annual Review of Microbiology,2000,54:439-461.
[2]Pastore A,Federici G,Bertini E,et al.Analysis of glutathione:implication in redox and detoxification[J].Clinica Chimica Acta,2003,333(1):19-39.
[3]Li Y,Wei GY,Chen J.Glutathione:a review on biotechnological production[J].Applied Microbiology and Biotechnology,2004,66(3):233-242.
[4]陈坚,卫功元,李寅,等.微生物发酵法生产谷胱甘肽[J].食品与生物技术学报,2004,23(5):104-110.
CHEN Jian,WEI Gong-yuan,LI Yin,et al.Progress in glutathione production by microbial fermentation[J].Journal of Food Science and Biotechnology,2004,23(5):104-110.(in Chinese)
[5]Bloch K.The synthesis of glutathione in isolated liver[J].Journal of Biological Chemistry,1949,179(3):1245-1254. [6]Iwamoto S,Motomura K,Shinoda Y,et al.Use of anEscherichia colirecombinant producing thermostable polyphosphate kinase as an ATP regenerator to produce fructose 1,6-diphosphate[J].Applied and Environmental Microbiology, 2007,73(17):5676-5678.
[7]Murata K,Tani K,Kato J,et al.Glutathione production coupled with an ATP regeneration system[J].European Journal of Applied Microbiology and Biotechnology,1980,10(1-2):11-21.
[8]Liao X Y,Deng T N,Zhu Y,et al.Enhancement of glutathione production by altering adenosine metabolism ofEscherichia coliin a coupled ATP regeneration system with Saccharomyces cerevisiae[J].Journal of Applied Microbiology, 2008,104(2):345-352.
[9]Lin J,Liao X Y,Du G C,et al.Enhancement of glutathione production in a coupled system of adenosine deaminase-deficient recombinantEscherichia coliandSaccharomyces cerevisiae[J].Enzyme and Microbial Technology,2009,44(5): 269-273.
[10]李寅,李华钟,林金萍,等.生物合成谷胱甘肽种间耦合ATP再生系统的构建[J].微生物学报,2001,41(2):191-197. LI Yin,LI Hua-zhong,LIN Jin-ping,et al.Biosynthesis of glutathione:construction of ATP regeneration system betweenE.coliandS.cerevisiae[J].Acta Microbiologica Sinica,2001,41(2):191-197.(in Chinese)
[11]廖鲜艳,王芸,朱至,等.面包酵母生物合成ATP的影响因素及机理初探[J].食品与生物技术学报,2007,26(6):52 -57.
LIAO Xian-yan,WANG Yun,ZHU Zhi,et al.Factors and mechanism of ATP biosynthesis by the cells ofSaccharomyces cerevisiae[J].Journal of Food Science and Biotechnology,2007,26(6):52-57.(in Chinese)
[12]Liao X Y,Shen W,Chen J,et al.Improved glutathione production by gene expression inEscherichia coli[J].Letters in Applied Microbiology,2006,43(2):211-214.
[13]Baba T,Ara T,Hasegawa M,et al.Construction ofEscherichia coliK-12 in-frame,single-gene knockout mutants:the Keio collection[J].Molecular Systems Biology,2006,2:8-9.
[14]Datsenko K A,Wanner B L.One-step inactivation of chromosomal genes inEscherichia coliK-12 using PCR products [J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(12):6640-6645.
[15]Sherman F,Fink G R,Hicks J B.Methods in yeast genetics:laboratory manual[M].New York:Cold Spring Harbor, 1982.
[16]Tietze F.Enzymic method for quantitative determination of nanogram amounts of total and oxidized glutathione:application to mammalian blood and other tissues[J].Analytical Biochemistry,1969,27:502-522.
[17]Veciana-Nogues M T,Izquierdo-Pulido M,Vidal-Carou M C.Determination of ATP related compounds in fresh and canned tuna fish by HPLC[J].Food Chemistry,1997,59(3):467-472.
[18]Marmocchi F,Lupidi G,Venardi G,et al.Adenosine-deaminase fromSaccharomyces cerevisiaepurif icationand characterization[J].Biochemistry International,1987,14(3):569-580.
[19]Deeley M C.Adenine deaminase and adenine utilization inSaccharomyces cerevisiae[J].Journal of Bacteriology,1992, 174(10):3102-3110.
(责任编辑:李春丽)
Enhancement of Glutathione Synthesis by Improving ATP-Regenerating Efficiency in the Coupled System
LIN Jun1,2, LIAO Xian-yan*1,2, DU Guo-cheng1,2, CHEN Jian1,2
(1.Key Lab of Industrial Biotechnology,Ministry of Education,Wuxi 214122,China;2.School of Biotechnology, Jiangnan University,Wuxi 214122,China)
A coupled system used for the biosynthesis of glutathione(GSH)was constructed withEscherichia coliΔadd/ade(pBV03)andSaccharomyces cerevisiaeWSH2.On one hand,the irreversible transformation from adenosine(Ado)to hypoxathine(Hx)inE.coliΔadd/ade(pBV03)was completely blocked by the disruption of adenosine deaminase(ADA)and adenine deaminase(ADE).On the other hand,the activity of ADE inS.cerevisiaeWSH2 decreased greatly when it was cultured in proline minimal medium.Therefore,the transformation from Ado into Hx decreased significantly,and more Ado was used to regenerate ATP byS.cerevisiaeWSH2.At last,ATP-regenerating efficiency was improved,and GSH production reached 13.68mmol/L,which was 5.14 fold of the control.
glutathione,biosynthesis,coupledsystem,Escherichia coli,S accharomyces cerevisiae
Q 493.8
:A
1673-1689(2010)02-0258-07
2009-04-21
国家863计划项目(2006AA10Z313);国家自然科学基金项目(30800008);江苏省自然科学基金项目(BK2008096)。
林军(1979-),男,山东荣成人,发酵工程博士研究生。
*通信作者:廖鲜艳(1975-),女,湖南衡阳人,工学博士,副教授,主要从事发酵工程和生化工程方面的研究。Email:xyliao@jiangnan.edu.cn

