海洋微藻脲酶活性测定方法的实验研究
徐 宁,孙树刚,段舜山,李爱芬,张成武 (暨南大学水生生物研究中心,广东省教育厅水体富营养化与赤潮防治重点实验室,广东 广州 510632)
海洋微藻脲酶活性测定方法的实验研究
徐 宁*,孙树刚,段舜山,李爱芬,张成武 (暨南大学水生生物研究中心,广东省教育厅水体富营养化与赤潮防治重点实验室,广东 广州 510632)
为进一步了解海洋微藻对尿素的吸收和利用机制,揭示水体尿素浓度升高对近海浮游植物群落演替的潜在影响及对近海有害藻类水华(HABs)形成的促进作用,对海洋微藻脲酶活性的测定方法进行了研究.以典型赤潮藻东海原甲藻为实验材料,在Peers方法的基础上,探讨了失活处理时间、提取液pH值、酶促反应温度以及微藻生长阶段对脲酶活性的影响.结果表明,失活处理时间、提取液pH值、酶促反应温度以及微藻所处的生长阶段都对微藻的脲酶活性具有显著影响.海洋微藻脲酶活性的最佳测定条件为:100℃下失活处理时间 > 2min;提取液pH值7.9;反应温度应与微藻生长温度一致;指数生长初期的藻体具有较高的酶活,而平台期后酶活趋于稳定.
微藻;脲酶活性;尿素;浮游植物;赤潮
Abstract:Assay optimization of urease activity in marine microalgae was studied in laboratory for further understanding the uptake and utilization mechanism of marine microalgae for urea and revealing effect of the increase of urea concentration for community succession of phytoplankton and its potential contribution to the formation of HABs in coastal waters. Based on Peers’ method, effect of inactivation time, pH value of the extract, incubation temperature and growth phase of microalgae on urease activity in a representative HABs species Prorocentrum donghaiense isolated from East China Sea were discussed. The results showed that inactivation time, pH value of the extract, incubation temperature and growth phase of microalgae all significantly influenced urease activity in microalgae. The optimum conditions for detecting urease activity in microalgae were: inactivation time > 2min under 100℃, pH of extract 7.9, incubation temperature consistent with the growth temperature of the microalgae, urease activity in microalgae higher during early exponential phase and stabilized after stationary phase.
Key words:microalgae;urease activity;urea;phytoplankton;red tide
近年来,随着全球有机氮肥使用量的不断增加,大量尿素进入近岸水体,成为溶解有机氮(DON)库的重要组成成分.夏季尿素占DON的比例可达到40%~90%[1-2].研究显示,尿素可被浮游植物利用,而且在一定条件下,还可能成为浮游植物的主要氮源和优先利用氮源[2-6].尿素是河口和沿海水域浮游植物所利用的总氮的重要部分,占浮游植物利用总氮的50%以上[2-5,7-8].
越来越多的研究发现,尿素在浮游植物群落演替和有害藻类水华(HABs)发生中也起着重要作用.对浮游植物种群动态的研究表明,尿素含量的上升将首先导致蓝藻和涡鞭毛藻的产量增加[9-11].而当环境中的尿素成为常见氮素形态时,多种甲藻数量可能会激增[12].尿素很容易被浮游植物所吸收利用,且在HABs形成过程中发挥重要作用,近岸水体中尿素的浓度与有毒甲藻赤潮的发生密切相关[1,6].
浮游植物主要通过2种途径将尿素代谢生成铵NH4+和二氧化碳CO2:一种是脲酶途径,另一种是三磷酸腺苷脲酰胺酶途径[13].目前已证实后一途径只存在于Chlorophyceae的几个种类中[14-15].现在,尿素等有机氮源与浮游植物群落演替以及赤潮形成的潜在联系已成为国际上HABs研究中的热点问题.然而,关于有害藻类对尿素等有机氮源的选择性吸收、吸收利用速率、及其代谢途径尚不明确.因此,建立藻类脲酶活性测定方法将有利于推进相关研究,并进一步揭示有机氮源在有害赤潮形成中的潜在作用.
目前,关于浮游植物脲酶活性的测定,国外主要采用Peers[13]的测试方法,而国内尚无成熟的方法.有报道显示,不同种类的微藻,其脲酶活性大小具有显著差异[16].鉴于Peers[13]方法源于对2种硅藻脲酶活性的测定,而海洋微藻的脲酶活性显然具有种间差异;而且,Peers[13]方法并未明确指出脲酶测定过程中的具体条件.为了建立一套成熟的藻类脲酶活性测定方法,本研究以典型赤潮藻东海原甲藻为实验材料,在Peers[13]方法的基础上,探讨了失活处理时间、提取液pH值、酶促反应温度以及微藻生长阶段对脲酶活性的影响,并对原有的脲酶活性测定方法进行了优化.
1 材料与方法
1.1实验材料
实验藻种为典型赤潮藻东海原甲藻(Prorocentrum donghaiense),采自我国东海赤潮高发海区,经毛细管分离培养成单细胞株系,保存于暨南大学水生生物研究中心藻种库.
1.2培养条件
试验藻种于LRH-400-G室内光照培养箱中培养,温度(23±1),℃光照强度约100µmol/(m2·s),光暗比12L12D.∶选用 f/2培养基[17],氮源为尿素.基础介质为人工海水(盐度为30.5).接种密度约为2×108个/L.
1.3实验设计
1.3.1失活处理时间对东海原甲藻脲酶活性的影响 取指数增长期的藻液(密度:5×108个/L)24份,每份15mL,分别提取脲酶.
实验条件:对照组(t0)样品100℃水浴失活5min;实验组(tf)样品分别在100℃水浴中处理30,60,120,180,240,300s;t0和tf样品均23℃水浴反应30min;提取缓冲液(A)[13](50mmol/L磺酸, 150mmol/L磷酸盐缓冲液,0.3%聚乙烯吡咯烷酮,0.1%Triton X-100,5mmol/L EDTA)和提取缓冲液(B)[13](50mmol/L磺酸,150mmol/L磷酸盐缓冲液) pH值均为7.90.
1.3.2提取缓冲液pH值对东海原甲藻脲酶活性的影响 取指数增长期的藻液(密度:5×108个/L)40份,每份15mL,分别提取脲酶.
实验条件:t0和tf样品均100℃水浴失活5min;23℃水浴反应30min;提取缓冲液(A)和(B)[13]的pH值均分别为7.40、7.50、7.60、7.70、7.80、7.90、8.00、8.10、8.20、8.30.
1.3.3水浴温度对东海原甲藻脲酶活性的影响 取指数增长期的藻液(密度:6.5×108个/L)40份,每份15mL,分别提取脲酶.
实验条件: t0和tf样品均100℃水浴失活5min;样品分别置于15,20,25,30,40,50,60,70,80, 90℃水浴下,缓冲液(A)和(B)[13]pH值均为7.90.
1.3.4不同生长阶段东海原甲藻脲酶活性的动态变化 将处于指数生长期的东海原甲藻接种于含有f/2培养基(氮源为尿素)的人工海水中培养(培养条件同上),每48h取一定量的藻液(根据细胞密度),计数并提取脲酶.
实验条件: t0和tf样品100℃水浴失活5min;样品23℃水浴反应30min;缓冲液(A)和(B)[13]pH值均为7.90.
1.4数据处理
Peers[13]方法以单个细胞单位时间内所产生氨的量来表示脲酶活性.
使用SPSS 13.0软件进行数据统计分析.
2 结果与分析
2.1失活处理时间对东海原甲藻脲酶活性的影响
在试验所设的失活处理时间范围内,随着时间的延长,脲酶活性逐渐下降.在处理的前2min内,随着时间的延长,脲酶活性快速降低;2min以后,随着时间的延长,脲酶活性基本不再变化,活性接近于0(图1).方差分析结果表明,脲酶失活处理时间>2min时,脲酶活性显著低于脲酶失活处理时间< 2min时(P <0.001).
2.2提取液pH值对东海原甲藻脲酶活性的影响
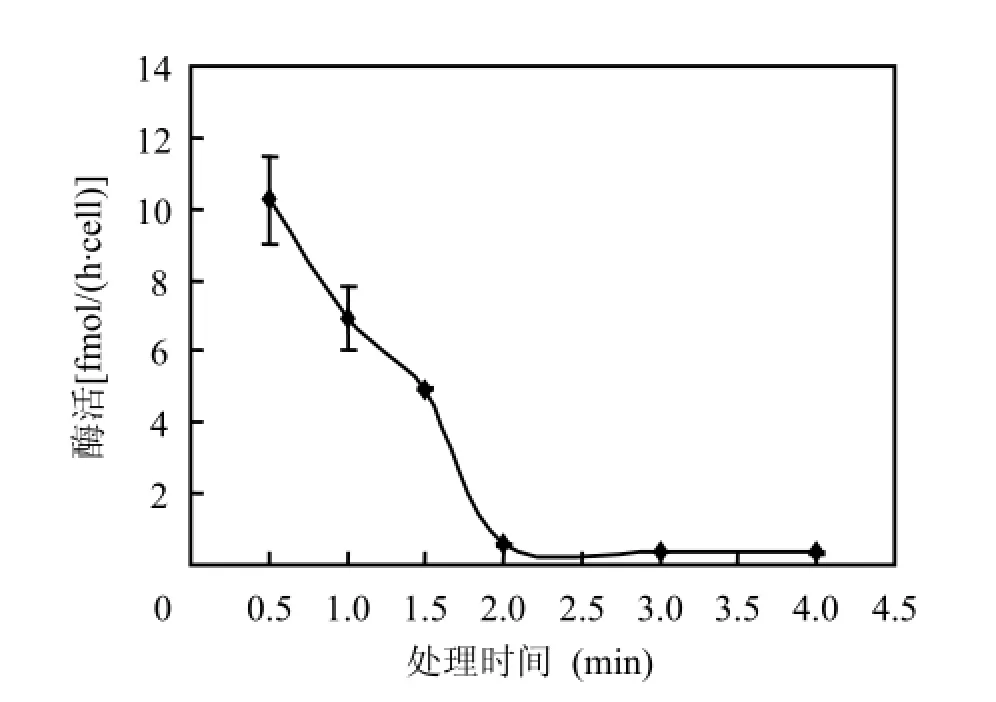
图1 100℃下处理时间对东海原甲藻脲酶活性的影响Fig.1 Effect of processing time on urease activity for Prorocentrum donghaiense
在试验所设的pH值范围内,脲酶都有活性.当脲酶粗提液pH值在7.5~7.9之间时,随着pH值的增大,脲酶活性呈上升趋势; pH值超过7.9以后,随着pH值的增大,脲酶活性呈下降趋势;pH值为7.5时,脲酶活性有最小值,分别为4.27fmol/(h·cell);在pH值为7.9时,脲酶活性最大,为9.52fmol/(h·cell)(图2).方差分析结果表明,提取液pH值为7.9时,东海原甲藻脲酶活性显著高于其他pH值处理(P <0.01).
2.3水浴温度对东海原甲藻脲酶活性的影响
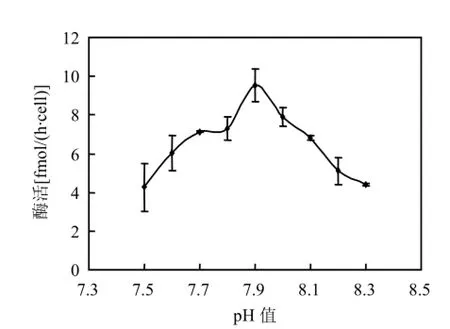
图2 提取液pH值对东海原甲藻脲酶活性的影响Fig.2 Effect of pH on urease activity for Prorocentrum donghaiense
在试验所设的温度范围内,脲酶都有活性.在15~70℃之间,随着温度的升高,脲酶活性呈上升趋势;当温度为70℃时,脲酶有最大活性,为59.84fmol/(h·cell);在70~100℃之间,随着温度的升高,脲酶活性急剧下降;当温度达到100℃时,脲酶活性最小,为0.41fmol/(h·cell)(图3).方差分析结果表明,当温度为70℃时,东海原甲藻脲酶活性显著高于其他温度处理(P <0.001).
2.4不同生长阶段的东海原甲藻脲酶活性的大小
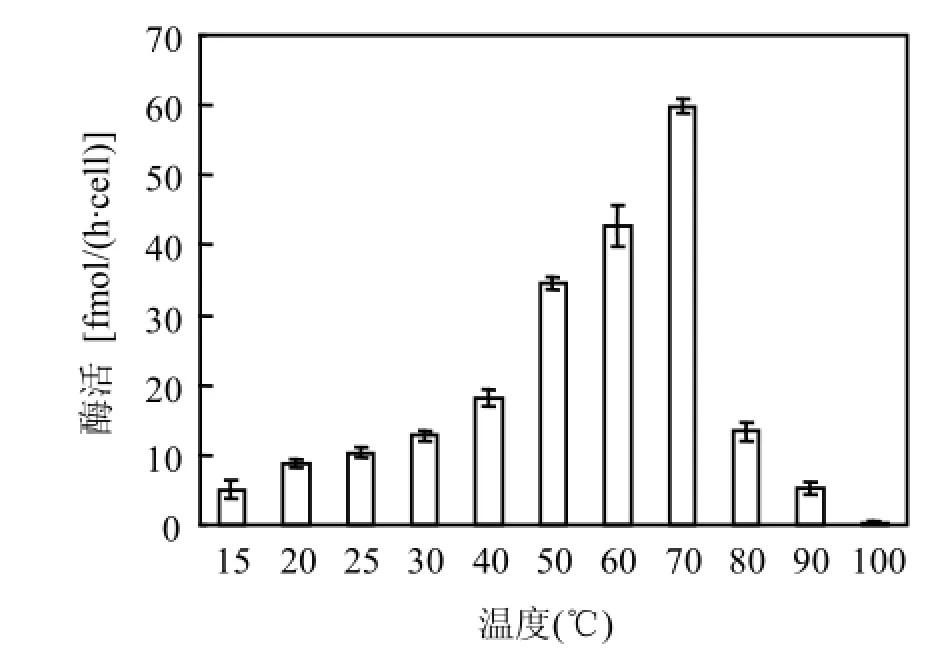
图3 水浴温度对东海原甲藻脲酶活性的影响Fig.3 Incubation temperature on urease activity for Prorocentrum donghaiense
随着取样时间的推迟,东海原甲藻细胞密度不断增加.第1~9d,随着时间的推迟,细胞密度迅速增大;第9~11d,细胞密度增长速率不断降低;第11 d以后,细胞密度基本不再变化(图4).
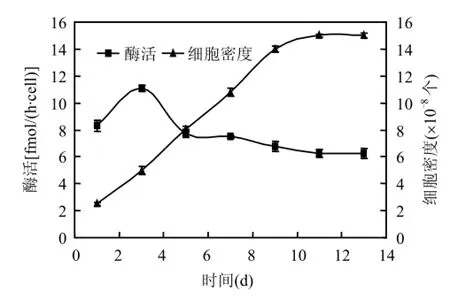
图4 东海原甲藻脲酶活性的动态变化Fig.4 Dynamic changes of urease activity of Prorocentrum donghaiense
在试验所设的取样时间内,东海原甲藻脲酶均能检测出活性.在接种第1d,脲酶活性较低,为8.31fmol/(h·cell);接种第3d,脲酶活性达到最大值,为11.09 fmol/(h·cell);第3~11d,脲酶活性呈下降趋势;第11d以后,脲酶活性基本不再变化,趋于稳定.脲酶在接种第13d时,有最小活性,为6.24fmol/(h·cell)(图 4).方差分析结果表明,接种第 3d,东海原甲藻脲酶活性显著高于其他时间(P <0.001).
不同生长阶段的东海原甲藻的脲酶活性不同.本试验中,东海原甲藻在接种后生长迅速,第1~11d为其指数生长期;第11d以后进入稳定期.脲酶活性在第3d出现最大,而第3d后酶活逐渐减低,第11d后稳定.即指数生长初期,脲酶活性最大;指数生长中后期,脲酶活性逐渐降低;进入稳定期以后,脲酶活性没有较大变化,趋于稳定.
2.5海洋微藻脲酶活性测定方法的优化
根据实验结果,对Peers[13]原有海洋微藻脲酶活性测定方法进行了优化.首先,为避免引入NH4+而对实验造成污染,本研究未使用牛血清白蛋白(BSA).其次,为避免细胞研磨过程中粗酶提取液的损失,本研究利用超声波破碎细胞,离心后得到上清液约600µL.第三,本研究显示,100℃水浴60s脲酶并未完全失活,为稳妥起见,改用100℃水浴5min.第四,采用靛酚蓝比色法检测铵[16],进一步提高实验的准确度.
3 讨论
3.1微藻的脲酶活性受到环境条件和生长阶段的影响
Dyhrman等[18]研究发现, 氮饥饿培养和尿素培养的Alexandrium fundyens和Alexandrium catenella具有较高的脲酶活性;而磷酸盐饥饿培养株中未能检测到酶活性;以氨作为唯一充足氮源时细胞的脲酶活性也很低.Solomon等[12]的研究也证实,相比于NH4+,生长在尿素和NO3–中的Prorocentrum minimum和Karlodinium veneficum的脲酶活性更高,并认为微藻体内脲酶活性受NH4+的抑制调节,或者受尿素或NO3–的诱导作用.本研究中,东海原甲藻在刚刚加入大量尿素后(指数生长期初期)有最大活性,可能是尿素的诱导作用的结果.
3.2试验条件的选择是决定微藻脲酶活性测定的关键因素
脲酶测定过程中的100℃水浴失活时间、提取液pH值以及水浴反应温度,是影响脲酶活性的重要因素.试验中,如果脲酶100℃水浴处理时间过短(<2min),则脲酶并不能完全失活,必定使得测定结果偏低;只有当处理时间超过2min时,脲酶才基本失活.Dyhrman等[18]在对有毒亚历山大藻脲酶活性的测定中亦采用100℃处理2min.
另外,脲酶对于提取液pH值的变化很敏感,较小的pH值变化就可对脲酶活性产生较大的影响.当提取液pH=7.9时,酶促反应速率最快,脲酶活性最高.Peers等[13]在对Thalassiosira weissflogii体外脲酶测定的研究中也发现,pH为7.9时其脲酶活性最大.
Solomon等[6]和Fan等[10]都认为,脲酶活性在一定温度范围内,与温度呈正相关.本研究结果也证明了这个推断(图3).Fan等[6]还进行了3种藻的脲酶体外试验,研究发现在3种藻类(Aureococcus anophagefferens,Prorocentrum minimu,和Thalassiosira weissflogii)中,脲酶活性都随着测试温度的升高而增强,但最适温度明显不同.在体外试验中,Aureococcus anophagefferens的脲酶活性在0~30℃之间随温度的升高而增强,在30~50℃之间保持稳定;微小原甲藻(Prorocentrum minimum)的脲酶的体外活性在0~20℃之间随温度的上升而增强,却在20~50℃之间基本保持活性不变;而Thalassiosira weissflogii的脲酶活性从0~20℃之间随温度的升高而增强,但超过20℃以后其活性随温度升高而减弱[6].本研究进行的脲酶体外试验结果表明,东海原甲藻的脲酶活性在15~70℃之间,随着温度的升高而增强.当温度达到80℃以后,脲酶活性急剧降低.脲酶在60~80℃之间某一温度范围时有最大活性,但由于试验中温度取点间隔较大,具体温度范围无法得出.
本方法是将微藻体内脲酶提取后,在体外进行模拟实验,测定脲酶活性,所以温度条件应尽量与微藻培养时的实际温度保持一致.
4 结语
海洋微藻的脲酶活性除了取决于藻体本身特性,还受到温度、pH值等环境条件的影响.海洋微藻脲酶活性的最佳测定条件为:100℃下失活处理时间>2min;提取液pH值为7.9;酶促反应温度应与微藻生长温度一致.
[1] Glibert P M, Harrison J , Heil C A, et al. Escalating worldwide use of urea – a global change contributing to coastal eutrophication [J]. Biogeochemistry, 2006,77:441-463.
[2] Glibert P M, Garside C, Fuhrman J, et al. Time- and size-dependent coupling of organic and inorganic nitrogen uptake and NH4+regeneration in the plume of the Chesapeake Bay, and its regulation by large heterotrophs [J]. Limnol. Oceanogr., 1991, 36:895-909.
[3] Kudela R M , Cochlan W P. Nitrogen and carbon uptake kinetics and the influence of irradiance for a red tide bloom off southern California [J]. Aq. Microb. Ecol., 2000,21:31-47.
[4] 周名江,颜 天,邹景忠.长江口邻近海域赤潮发生区基本特征初探 [J]. 应用生态学报, 2003,7:1031-1038.
[5] Xu N, Duan S, Li A, et al. Effects of temperature, salinity and irradiance on the growth of the harmful dinoflagellate Prorocentrum donghaiense Lu [J]. Harmful Algae, 2010,9(1):13-17.
[6] Fan C, Glibert P M, Alexander J, et al. Characterization of urease activity in three marine phytoplankton species, Aureococcus anophagefferens, Prorocentrum minimum, and Thalassiosira weissflogii [J]. Marine Biology, 2003,142:949-958.
[7] Kristiansen S. Urea as a nitrogen source for phytoplankton in the Oslofjord [J]. Mar. Biol., 1983,74:17-24.
[8] Furnas M J. Nitrogen dynamics in lower Narragansett Bay, Rhode Island. I. Uptake by size-fractionated phytoplankton populations [J]. J. Plank. Res., 1983,5:657-676.
[9] Berg G M, Glibert P M, Jorgensen N O G, et al. Variability in inorganic and organic nitrogen uptake associated with riverine nutrient input in the Gulf of Riga, Baltic Sea [J]. Estuaries, 2001,24:176-186.
[10] Solomon C M. Regulation of estuarine phytoplankton and bacterial urea uptake and urease activity by environmental factors [M]. Maryland: University of Maryland, 2006,252.
[11] Heil C A, Revilla M, Glibert P M, et al. Nutrient quality drives phytoplankton community composition on the southwest Florida shelf [J]. Limnology and Oceanography, 2007,52:1067-1078.
[12] Solomon C M, Glibert P M. Urease activity in five phytoplankton species [J]. Aquatic Microbial Ecology, 2008,52:149-157.
[13] Peers S G, Milligan A J, Harrison P J. Assay optimization and regulation of urease activity in two marine diatoms [J]. J. Phycol., 2000,36:523-528.
[14] Leftley J W, Syrett P J. Urease and ATP: Urea amidolyase activity in unicellular algae [J]. J. Gen. Microbiol., 1973,77:109–115.
[15] Bekheet I A, Syrett P J. Urea degrading enzymes in algae [J]. Br. Phycol. J., 1977,12:137-143.
[16] Lucia Solorzano. Determination of ammonia in natural waters by the phenolhypochlorite [J]. Limnology and Oceanography, 1996,14(5):799-801.
[17] Guillard R R L. Culture of phytoplankton for feeding marine invertebrates [M]//Culture of marine invertebrate animals. New York, USA: Plenum Press, 1975:29-60.
[18] Dyhrman S T, Anderson D M. Urease activity in cultures and field populations of the toxic Dinoflagellate Alexandrium [J]. Limnology and Oceanography, 2003,48(2):647-655.
Experimental study of urease activity in marine microalgae
. XU Ning*, SUN Shu-gang, DUAN Shun-shan, LI Ai-fen, ZHANG Cheng-wu (Key Laboratory of Water Eutrophication and Red-tide Control, Department of Education of Guangdong Province, Research Centre of Hydrobiology, Jinan University, Guangzhou 510632, China). China Environmental Science, 2010,30(5):689~693
X83
A
1000-6923(2010)05-0689-05
徐 宁(1971-),女,湖北孝感人,副研究员,博士,主要从事藻类生理生态学研究.发表论文40余篇.
2009-11-13
国家自然科学基金资助项目(40776078,40876074)
* 责任作者, 副研究员, txuning@163.com

