糖苷酶与糖基转移酶工程的研究进展
刘 婧,陈启和,章海锋,傅明亮,何国庆
(浙江大学食品科学与营养系,浙江杭州310029)
糖苷酶与糖基转移酶工程的研究进展
刘 婧,陈启和*,章海锋,傅明亮,何国庆
(浙江大学食品科学与营养系,浙江杭州310029)
近年来糖苷酶与糖基转移酶工程在应用于合成和降解多糖结构领域取得了显著进展,其重要发展有通过完全饱和突变改进木聚糖酶耐热性,从一种倒置糖苷酶中首次衍生化获得糖苷合成酶,以及出现一类新的经过改良的能够有效连接硫代糖苷用以合成多糖的糖苷酶;特别是通过随机突变和定向改造方法改进糖苷酶活性的应用增加。虽然糖基转移酶工程研究还处于起始阶段,但是目前基于在结构基础上改变酶底物特异性和在整个细胞内控制糖基转移酶的构象以影响体内糖生物学复杂变化的研究很可能预示着该领域将出现重大的改革浪潮。本文主要综述和展望了糖苷酶和糖基转移酶的最新研究进展。
糖苷酶,糖基转移酶,底物特异性,糖工程,分子工程
Abstract:In recent years,substantial advances have been made in the engineering of glycosidases and glycosyltransferases forthe synthesis and degradation ofglycan structures.Key developments include improvement of the thermostability of xylanase through comprehensive saturation mutagenesis,creation of the first glycosynthase derived from an inverting glycosidase and the emergence of a new class of modified glycosidases capable of efficiently synthesizing thioglycosidic linkages.Of particular note is the increased use of random mutagenesis and directed evolution tactics for tailoring glycosidase activity.Although the engineering of glycosyltransferases is still in its early stages,recent work on the structure-based alteration of substrate specificity and the manipulation of glycosyltransferase profiles in whole cells to effect complex changes in vivo glycobiology probably foreshadows a wave of considerable innovation in this area.
Key words:glycosidases;glycosyltransferases(GTs);substratespecificity;glucoseengineering(GT);molecular engineering
在生物学体系中,糖基转移酶(GTs)和糖苷酶负责合成和降解碳水化合物,糖苷酶以保持或倒转构型的形式水解糖苷键,其机理已被广泛研究和总结。倒置型糖苷酶经过酸碱催化引导取代反应进行(图1a),而保持型糖苷酶则通过一个双取代机制,即一个活泼位亲核试剂进攻反面中心生成一个共价的糖基-酶中间产物,然后通过酸碱催化方式进行水解(图1b)。倒置型GTs遵循类似于倒置型糖苷酶的反应机制(图1a),而保持型GTs尚缺乏严格的双取代机制证据,因此提出了类似 SNⅰ的反应机制[1]。按排列顺序相似性分类,糖苷酶大约有100种,相应的GTs约为80种。糖苷酶已被发现采用超结构折叠,与之形成鲜明对比的是,大部分GTs只有两个结构折叠,即折叠A和折叠B。
糖苷酶和GTs对体外碳水化合物的分解十分有用,但由于它们的排列顺序、折叠结构和底物特异性存在较大的差异,一些与特异性催化剂相对应的糖苷连接还不清楚。本文主要阐述目前糖苷酶和糖基转移酶工程的研究进展。
1 糖苷酶研究进展
由于环境友好、绿色环保及通过发酵生产容易获得高产量,酶在工业生产中的使用越来越广泛[2]。糖苷酶就是当前研究的一个热门领域,主要研究包括利用纤维素酶和木聚糖酶将由纤维素、半纤维素和木质素(一种由大量酚残基缩合而成的聚合物)组成的纤维素质转化成合适的生物燃料,已有相关研究报道该领域内最新进展情况[3]。
随机突变和定向进化方法已用于培养突变的工业应用酶。一种通过随机突变彻底地进化酶的方法已经应用于增强木聚糖酶的耐热性[4],这种被称为基因位点饱和突变(GSSM)的方法能支配蛋白质中189个氨基酸残基中的任何一个氨基酸残基发生饱和突变,从而产生一个改进的突变酶库,其中每种酶只有一个单一部位发生改变,然后以耐热性为指标筛选这一变异酶,结果证明改变9种单氨基酸有助于提高耐热性,再将这9种简单替代物组合产生512种可能的变异体。
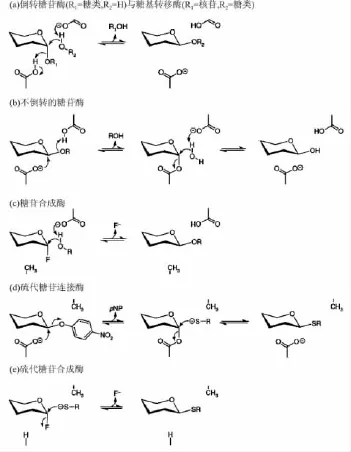
图1 改进后用于糖苷合成的糖苷酶类型
1.1 糖苷转移酶
糖苷酶作为一种通过转糖基反应合成糖苷的有用工具,在制备各种各样的多糖结构中有大量成功的应用。糖苷酶在合成方面的效用也同样可与各种工程学方法相得益彰。最近有报道称通过改变嗜高温古细菌(Sulfolobus solfataricus)β-糖苷酶中两个与识别底物有关的关键残基,并对其进行合理地修饰,该修饰酶在转糖基反应中可作用于更广范围的底物[5]。定向进化技术能够更有效地增强转糖苷酶的活性。通过随机突变和体外再结合实验,Dion等[6]能够减小嗜热栖热菌(Thermus thermophilus)β-糖苷酶水解活性,同时充分增大转糖苷酶活性,从而使β-1,3糖苷键连接的产物产量大大高于传统通过糖苷酶催化的转糖苷反应的产物产量。
1.2 糖苷合成酶
虽然糖苷酶被证实在糖苷合成中具有极其重要作用,但这些酶的使用受两个关键因素的制约,即热力学逆方向上反应动力学问题和反应产物对酶的抑制作用。在上世纪90年代末,引进了一类新的可以只催化合成而不水解糖苷键的糖苷酶变异体,因此可以在合成方向上驱使反应的进行。这些学名为“糖苷合成酶”的糖苷酶变异体,能够与另一种具有同样效果的酶一起取代亲核基团而抑制水解。当在自然底物中加入构型相反的糖基氟化物底物时,该酶通常能将这种活性糖基供体转移给合适的受体,其原理如图1c所示。
以此为基础,一系列其他的糖苷合成酶迅速被研制出来。一个显著的例子就是最近从嗜热β-糖苷酶衍化得到一种糖苷合成酶,它能在一些抗原和植物信号分子中高效地连接 β-1,3糖苷键[7]。另外从海栖热袍菌(Thermotoga maritima)β-葡萄糖酸苷酶衍化得到的能够连接β-键葡萄糖醛酸和半乳糖醛酸的糖苷合成酶也受到关注[8],这些β-键葡萄糖醛酸和半乳糖醛酸存在于植物、细菌细胞壁以及包含有肝素钠,硫酸乙酰肝素,硫酸软骨素,透明质酸的哺乳动物的糖胺聚糖等大量重要的生物分子中。
一直以来,所有的这些酶都是从β-保持型糖苷酶衍化得到的。直到Honda和Kitaoka[9]首次成功从倒置型酶衍化得到了糖苷合成酶,这种倒置型酶由嗜碱耐高温枯草杆菌(Bacillus halodurans)的还原端木糖释放外低聚木糖酶。天冬酰氨残基作为酶触反应的接触部位,对其进行单位点饱和突变,结果产生9种氨基酸替代产物,它们赋予糖苷合成酶以活性。在这些修饰后的能够催化糖苷合成反应的酶中,用半胱氨酸替代后一类酶催化得到的转糖基化产物产量最高。
目前的工作还旨在通过对糖苷合成酶的化学修饰来提高糖苷的产量,如鞘糖脂,一类有治疗效果但极难用化学或酶法大规模获得的复合物。对大规模获得的需求促成了从红球菌(Rhodococcus sp.)内的糖神经酰胺酶Ⅱ,一种从β-内糖苷酶衍化得到能够切断多糖以及鞘糖脂中脂质部分糖苷键的糖苷合成酶的设想[10]。在这种酶的非酶催化部位取代以亲核基团替代物,这样改变后的酶能够与一系列低聚糖氟化物一起浓缩鞘脂类物质,产生一些溶原性鞘糖脂,包括 GM1和 GM3神经节苷脂,其产率达95%[11]。
定向进化方法在改进与改变糖苷合成酶的酶触活性方面取得显著成效。使用体内板式筛选关联随机突变能改进酶触活性以及扩大Agrobacterium糖苷合成酶的底物范围[12]。通过连续两次亲核基团饱和突变,使酶的催化活性分别提高50%和27%,从而使糖苷合成酶合成多糖的动力学参数与天然酶水解多糖的动力学参数相接近。这种改进后的糖苷合成酶还能有效地将α-木糖氟化物作为糖基供体。进一步对木糖基部分转移能力的探究发现,当含芳香基的木糖苷作为受体,木糖氟化物作为供体时,转移后形成芳香基糖是以3-位而不是4-位的形式存在的[13]。而用芳香基木糖二苷作为受体时,转移发生在4-羟基上,这说明单糖和二糖限制了糖苷合成酶不同方位上的活性位点。
关于糖苷合成酶活性定向进化方法的选择,Cornish[14]已进行报道。他们运用“化学互补”法,在酵母体内进行三代杂交实验,选择能提高活性的特异腐质霉(Humicola insolens)Cel7B糖苷合成酶。这种方法涉及糖基氟化物供体和糖基受体的化学结合,且分别有氨甲叶酸和地塞米松参与。在缺乏亮氨酸环境下,某个基因(这里指LEU2,需要足够的亮氨酸)受启动子控制,需要转录酶(包括活性部位和DNA结合部位)。活性部位和DNA结合部位分别与糖皮质激素受体和二氢叶酸还原酶发生结合。在活化的糖苷合成酶存在下,糖基供体和受体结合,从而使氨甲叶酸和地塞米松通过糖苷键实现化学连接。糖皮质激素受体和二氢叶酸还原酶与上述配体相互作用影响转录酶的重构,使Leu2基因得以表达。通过这个方法,Cel7B糖苷合成酶活性可以提高到原来的5倍。
1.3 硫代糖苷连接酶与硫代糖苷合成酶
最近报道一类可以有效催化连接硫代糖苷键的新的糖苷酶变异体。这些硫代糖苷酶由无催化活性残基的顺式糖苷酶与酸性催化残基置换得到。当激活的芳香糖苷作为糖基供体时,糖基酶中间体仍旧形成,不需要底物催化的硫醇受体与这个中间体有效作用产生硫代糖(图1d)。此外,硫代糖苷连接的抗糖苷酶断裂能力防止了修改后的糖苷酶由于存在剩余的水解活性而减少产物的得率。在酸性底物环境下,Abg饱和位点突变显示:以谷氨酸代替天然谷氨酸盐残基,增强了硫代糖苷连接酶的活性,相对于原始丙氨酸突变体,整体催化能力是其5倍[15]。其他的一些硫代糖苷连接酶源自各种不同的酶,如上文讨论的海栖热袍菌(T.maritima)β-葡萄糖苷酸酶和粪碱纤维单胞菌(C.fimi)β-甘露糖苷酶。硫代糖苷合成酶与双突变酶的出现,使这一技术得到进一步拓展。这些改进后的酶能够催化激活的糖基氟化物供体糖与亲核的硫糖使这两种活化糖浓缩,本质上是在高效进攻性复合体中形成一个适应于被作用官能团的构架(图1e)。
2 糖基转移酶
作为用来连接糖苷键的天然酶GTs,并由此而来的具有扩展的或必需的底物特异性工程GTs,以合成非天然连接或合并非天然单糖的方式,在合成新型非天然存在以及生物学相关的糖结构方面有着极大的潜力。通过合理设计与定向进化产生的异激酶或核苷酸转移酶能够处理不同种类D-或L-己糖及经过一定程度修饰的糖,克服了合成必要的非天然核糖苷的困难。在这一领域,存在两种方法用来实现GTs合成糖类,第一种,杂交GTs可以催化需要的非天然糖转移;第二种用蛋白质工程途径修改GT前体的底物特异性以适应非天然底物的要求。
至今,GTfA工程主要集中于供体特性研究,而受体结合位点的形成只取决于供体结合,其可能结果是使假定突变位点的验晶分析变得复杂。应用蛋白质数据库中100多种GTfA的X射线晶体结构,基于结构的合理重新设计变得可行。将UDP-Glc计算模拟成人体β-1,3-葡萄糖醛酸基转移酶Ⅰ的晶体结构,结果显示序列中一个单残基对葡萄糖醛酸(Glca)的识别至关重要。突变这个残基(H308R),产生了一种底物特异性较低的酶,它能够以相对原始种 UDP-GlcA活性的13%~42%利用 UDP-Glc、UDP-甘露糖及 UDP-GlcNAc 等供体糖元[16]。底物特异性工程也指导梭菌细胞毒素合成[17]。
很早以前就已发现,负责合成人体血型抗原A和B的GTs(α-1,3-N-乙酰氨基葡萄糖基转移酶和α-1,3-半乳糖基转移酶)只有四个氨基酸是不同的(R/G176,G/S235,L/M226 和 G/A268),因此取代以上两种酶的这四个残基,可转变它们的GT活性[18]。随后,这些残基对酶特异性的影响被应用于突变形成一种复杂的化合物,以及用于动力学和结晶分析。最近,突变稀有顺式-AB等位基因形成的α-1,3-半乳糖基转移酶变异体(P234S)被证实能同时产生血型抗原A和B。实验显示,P234S突变重组体具有从UDP-Gal到UDP-GalNAc完全相反的供体特异性,虽然四种“关键”氨基酸与B-抗原特异性的结合机理还未清楚[19]。X-射线验晶分析显示,P324S突变体导致M266构造发生改变,为GalNAc 2-N-乙酰基团留出更多空间。这些血型抗原合成GTs的工程学例子说明相似的酶特异性可以通过许多诱变改变残基来获得,这一突破具有革命性的意义,同时也推动蛋白质工程的发展。
GTs工程不仅仅限制在点位突变。通过对不同幽门螺杆菌菌株的功能区转换,尝试对α-1,3/4-岩藻糖基转移酶区位选择性有更深入的了解。12种岩藻糖基转移酶嵌合体已合成,其中347-353残基被证实为消除或赋予 α-1,4活性的关键区域[20]。
活性敲出技术(Activity knock-out)是另一种工程手段,已用于从巴斯德杆菌(Pasteurella multocida)得到透明质酸合成酶、在固相上合成的粘多糖。透明质酸合成酶是一种天然的双功能酶,拥有β-1,3-N-乙酰氨基葡萄糖基转移酶和 β-1,4-葡萄糖醛酸转移酶活性的两个催化结合部位。通过核苷连接突变,使其中一个部位失去活性而形成单功能GTs,它可被固定化,用于交替生产单分散结构的粘多糖。应用一种从脑膜炎奈瑟菌(Neisseria meningitidis)得到的α-半乳糖基转移酶参与的工程手段,尝试捕获一种反应中间体,并以此解释非倒转转移酶的一般作用机制[21]。突变Gln189,一个晶体图显示能在底物反面中心受亲核试剂攻击下迅速平衡的残基,形成更加亲核的谷氨酸残基,确实能捕获一类共价的糖基酶类。这类共价体被翻转,其kcat值与变异体相似。与GTfA相比,GTfB在工程中应用例子很少,这是由于GTfB的晶体分析更少,因此合理的工程尝试主要还是基于同源序列。然而,GTfBs可作为GT工程的原型,因为它们化学上具有让各种非糖受体糖基化的自然倾向。一个典型的GTfB工程例子,即参与乌达霉素生物合成的GTs经过底物特异性突变,产生可在乌达霉素G与D-橄榄糖的C4-羟基基团之间生成新型 β-1,4键连接的酶[22]。最近,通过相似序列证明,GTfB的一个单独残基(对应于GlcT中的Q382,GalT中的 H374)在 GlcTs和 GalTs之间能赋予受体不同特异性。从当归中得到UDP-半乳糖:花青素3-O-半乳糖基转移酶的H374Q突变体,能使UDP-Glc连接效率提高40倍,但几乎不改变Vmax,同时保留了自身的GalT活性;然而,从黄芩中得到的UDP-Glc:类黄酮7-O-葡萄糖基转移酶的Q382H突变体没有引入GalT活性,并且削弱了TlcT活性[23]。
以上讨论的单氨基酸突变GTs已被有效地用于改变供体的底物特异性。即使到目前为止,在酶工程领域人们还没有足够的认识能完全预测此类影响,通过定向进化实验,采用类似于转氨酶定向进化中防止混杂的方法可选择、利用或防止酶的混杂。由于GT结构的刚性,已有人提出对GTs的操纵可能要比先前想象的要简单[24]。至今,GT定向进化还没有任何应用实例,但很有可能会在不远的将来得以实现。
本文主要报道改变序列的糖苷酶与GTs工程的进展,在引入糖处理酶的细胞工程领域还存在一些有趣的例子,这些例子同时也展示了糖酶挑战大规模合成寡糖结构所具备的优越的生物合成能力。这些糖基化反应作用于整个细胞,过度表达能编译合适糖苷酶、GTs以及核糖核苷的基因。工程大肠杆菌已用于神经节苷脂GM3、GM2[25]、GD3[26]和GM1
[27]的寡糖部分,Lewis x抗原决定部位以及血型H-抗原的合成[28]。在尝试将甲醇毕赤酵母(Pichia pastoris)糖基化途径变化人性化的研究中,这一工作获得更大进展[29]。为了采用同源复合糖基化方法获得糖蛋白,将各种GT催化结合部位与头序列熔合得到新的GTs,根据活性与在酵母细胞中的正确定位进行筛选,并推出内源酵母高甘露糖型N-多糖的糖基化途径。从猪体内得到α-1,3-半乳糖基转移酶进行点位突变,这种突变体是合成 Galα-1,3-Gal抗原决定部位所缺乏的,普遍被认为是造成猪到灵长类动物异种移植超急性排斥反应的原因[30]。
3 结论
对糖苷有效合成途径的探索促进了糖苷酶与GTs工程的研究出现重大进展。糖苷酶工程通过改变它们的底物特异性及物理特性,或使用已有的结构信息资源进行合理设计,或结合先进的新型筛选手段,使用定向进化策略,从而设计出具有新型作用性能的糖酶。虽然合理的GT工程尝试还相当简单,但是通过引入GT和糖苷酶基因来重构哺乳动物、真核及原核细胞已获得极大成功,形成有效的“糖基化工厂”。为更深入地了解糖苷酶发酵机制而投入的大量研究资金已获得回报并具备了工程化改造该酶的能力,而这一课题期望同样能用于GTs。
[1]Persson K,Ly HD,Dieckelmann M,et al.Crystal structure of the retaining galactosyltransferase LgtC from Neisseria meningitidis in complex with donor and acceptorsugar analogues[J].Nat Struct Biol,2001,8(1):166-175.
[2]Panke S,Wubbolts M.Advances in biocatalytic synthesis of pharmaceutical intermediates[J].Curr Opin Chem Biol,2005,9(2):188-194.
[3]Lynd LR,Van Zyl WH,McBride JE,et al.Consolidated bioprocessing of cellulosidic biomass:an update[J].Curr Opin Biotechnol,2005,16(5):577-583.
[4]Palackal N,Brennan Y,Callen WN,et al.An evolutionary route to xylanase process fitness[J].Protein Sci,2004,13(2):494-503.
[5]Hancock SM,Corbett K,Fordham - Skelton AP,et al.Developing promiscuous glycosidases for glycoside synthesis:residues W433 and E432 in Sulfolobus solfataricus β-glycosidase are important glucoside and galactoside specificity determinants[J].Chem Bio Chem,2005,6(5):866-875.
[6]Feng HY,Drone J,Hoffmann L,et al.Converting a β -glycosidase into a β-transglycosidase by directed evolution[J].J Biol Chem,2005,280(44):37088-37097.
[7]Drone J,Feng HY,Tellier C,et al.Thermus thermophilus glycosynthases for the efficient synthesis of galactosyl and glucosyl β-1,3-glycosides[J].Eur J Org Chem,2005(10):1977-1983.
[8]Whitelock JM,Iozzo RV.Heparan sulfate:a complex polymer charged with biological activity[J].Chem Rev,2005,105(7):2745-2764.
[9]Honda Y,Kitaoka M.The first glycosynthase derived from an inverting glycoside hydrolase[J].J Biol Chem,2006,281(3):1426-1431.
[10]Ito M,Yamagata T.A novel glycosphingolipid-degrading enzyme cleaves the linkage between the oligosaccharide and ceramide in neutral and acidic glycosphingolipids[J].J Biol Chem,1986,261(30):14278-14282.
[11]Vaughan MD,Johnson K,DeFrees S,et al.Glycosynthasemediated synthesis of glycosphingolipids[J].J Am Chem Soc,2006,128(19):6300-6301.
[12]Kim YW,Lee SS,Warren RA,et al.Directed evolution of a glycosynthase from Agrobacterium sp.increases its catalytic activity dramatically and expands its substrate repertoire[J].J Biol Chem,2004,279(41):42787-42793.
[13]Kim YW,Chen H,Withers SG.Enzymatic transglycosylation of xylose using a glycosynthase[J].Carbohydr Res,2005,340(18):2735-2741.
[14]Lin H,Tao H,Cornish VW.Directed evolution of a glycosynthase via chemical complementation[J].J Am Chem Soc,2004,126(46):15051-15059.
[15]Mullegger J,Jahn M,Chen HM,et al.Engineering of a thioglycoligase:randomized mutagenesis of the acid-base residue leads to the identification of improved catalysts[J].Protein Eng Des Sel,2005,18(1):33-40.
[16]Ouzzine M,Gulberti S,Levoin N,et al.The donor substrate specificity of the human β-1,3-glucuronosyltransferase I toward UDP-glucuronic acid is determined by two crucial histidine and arginine residues[J].J Biol Chem,2002,277(28):25439-25445.
[17]Jank T,Reinert DJ,Giesemann T,et al.Change of the donor substrate specificity of Clostridium difficile toxin B by sitedirected mutagenesis[J].J Biol Chem,2005,280(45):37833-37838.
[18]Yamamoto F,Clausen H,White T,et al.Molecular genetic-basis of the histo-blood group ABO system[J].Nature,1990,345(6272):229-233.
[19]Marcus SL,Polakowski R,Seto NOL,et al.A single point mutation reverses the donor specificity of human blood group B-synthesizing galactosyltransferase[J].J Biol Chem,2003,278(14):12403-12405.
[20]Ma B,Lau LH,Palcic MM,et al.A single aromatic amino acid at the carboxyl terminusof Helicobacter pylori a-1,3/4-fucosyltransferase determines substrate specificity[J].J Biol Chem,2005,280(44):36848-36856.
[21]Lairson LL,Chiu CPC,Ly HD,et al.Intermediate trapping on a mutant retaining a-galactosyltransferase identifies an unexpected aspartate residue[J].J Biol Chem,2004,279(27):28339-28344.
[22]Hoffmeister D,Wilkinson B,Foster G,et al.Engineered urdamycin glycosyltransferases are broadened and altered in substrate specificity[J].Chem Biol,2002,9(3):287-295.
[23]Kubo A,Arai Y,Nagashima S,et al.Alteration of sugar donor specificities of plant glycosyltransferases by a single point mutation[J].Arch Biochem Biophys,2004,429(2):198-203.
[24]Hu Y,Walker S.Remarkable structural similarities between diverse glycosyltransferases[J].Chem Biol,2002,9(12):1287-1296.
[25]Love KR,Swoboda JG,Noren CJ,etal.Enabling glycosyltransferase evolution:a facile substrate-attachment strategy for phage-display enzyme evolution[J].Chem Bio Chem,2006,7(5):753-756.
[26]Antoine T,Heyraud A,Bosso C,et al.Highly efficient biosynthesis of the oligosaccharide moiety of the GD3 ganglioside by using metabolically engineered Escherichia coli[J].Angew Chem Int Ed Engl,2005,117(9):1374-1376.
[27]Antoine T,Priem B,Heyraud A,et al.Large-scale in vivo synthesis of the carbohydrate moieties of gangliosides GM1and GM2by metabolically engineered Escherichia coli[J].Chem Bio Chem,2003,4(5):406-412.
[28]Dumon C,Bosso C,Utille JP,et al.Production of Lewis x tetrasaccharides by metabolically engineered Escherichia coli[J].Chem Bio Chem,2006,7(5):359-365.
[29]Bobrowicz P,Davidson RC,Li H,et al.Engineering of an artificial glycosylation pathway blocked in core oligosaccharide assembly in the yeast Pichia pastoris:production of complex humanized glycoproteins with terminal galactose[J].Glycobiology,2004,14(9):757-766.
[30]Phelps CJ,Koike C,Vaught TD,et al.Production of a-1,3-galactosyltransferase-deficient pigs[J].Science,2003,299(5605):411-414.
Reseach on the engineering of glycosidases and glycosyltransferases
LIU Jing,CHEN Qi-he*,ZHANG Hai-feng,FU Ming-liang,HE Guo-qing
(Department of Food Science and Nutrition,Zhejiang University,Hangzhou 310029,China)
Q814
A
1002-0306(2010)08-0386-05
2009-06-03 *通讯联系人
刘婧(1986-),女,硕士研究生,研究方向:食品微生物。
国家自然科学基金青年基金项目(20806069);浙江省科技计划面上项目(2009C32098)。

