中华鳖蛋白质组分的分步提取及其抗氧化活性
刘 彦,刘承初,*,杨靖亚,刘其根,李应森,李家乐,3
(1.上海海洋大学食品学院,上海 201306;2.上海海洋大学 省部共建水产种质资源发掘与利用教育部重点实验室,上海201306;3.上海市高校水产养殖学E-研究院,上海 201306)
中华鳖蛋白质组分的分步提取及其抗氧化活性
刘 彦1,刘承初1,*,杨靖亚1,刘其根2,李应森2,李家乐2,3
(1.上海海洋大学食品学院,上海 201306;2.上海海洋大学 省部共建水产种质资源发掘与利用教育部重点实验室,上海201306;3.上海市高校水产养殖学E-研究院,上海 201306)
以野生中华鳖全鳖粉为原料,采用分步提取法对中华鳖的蛋白类成分进行分离,并利用等电点沉淀、醇沉、超过滤等方法分离纯化出各蛋白质组分,并对其各组分的抗氧化性进行研究,并对抗氧化活性高的组分进行分子质量测定分析;还原力的测定以还原剂BHT为对照,清除DPPH自由基能力的测定则进行直线回归分析并计算 IC50值。结果表明:糖蛋白组分及水溶性蛋白组分抗氧化活性较高,IC50值为0.21mg/mL和1.94mg/mL。因此,中华鳖各蛋白组分有较高的抗氧化能力且呈显著的剂量效应关系,其在抗氧化方面和保健食品方面具有巨大的开发潜力。
中华鳖;分步提取;纯化;氨基酸;抗氧化活性
Abstract:Protein fractions were separated and purifies from wild Chinese soft-shelled turtles using sequential extraction procedures and their antioxidant activities were investigated by DPPH free radical scavenging and reducing power assays. It was found that the glycoprotein and water-soluble protein fractions had higher antioxidant effect in a positive concentrationdependent fashion, with half maximal inhibitory concentrations (IC50) of 0.21 mg/mL and 1.94 mg/mL, respectively. These results suggest that the protein fractions from Chinese soft-shelled turtle possess strong antioxidant activities and have a great potential to be developed as a healthcare food or a nutriceutical.
Key words:Chinese soft-shelled turtle (Pelodiscus sinensis);sequential extraction;purification;amino acids;antioxidant capability
中华鳖(Pelodiscus sinensis)学名鳖,又称水鱼、团鱼、鼋鱼、元鱼、老鳖、王八,自古就是我国传统食疗滋补佳品。其具有丰富的蛋白质,不但含有极高的胶原蛋白,而且富含18种氨基酸[1-2]。中华鳖具有许多生理功能,如抗氧化、提高机体免疫、促进伤口愈合、滋阴、滋补、提高血浆蛋白含量、促进造血功能、增强体力、清热等,而这些活性均与抗氧化性质有关[3-4]。中华鳖自2005年以来每年产量在14万t以上,产值在50亿元以上,其资源非常丰富,但目前关于中华鳖的研究报道很少,对其活性成分的研究还是空白。
本实验采用分步提取法对中华鳖的蛋白类成分进行提取和纯化,并对所获各组分的蛋白质含量及其抗氧化活性进行研究,包括DPPH自由基的清除能力和还原能力,并对抗氧化性最佳的组分进行氨基酸组成分析,以期为中华鳖活性成分的研究与药物的开发提供参考。
1 材料与方法
1.1 材料与试剂
中华鳖 杭州天福生物科技有限公司;标准蛋白升正生物技术有限公司;除测氨基酸用的试剂为优级纯外,其他试剂均为市售分析纯。
1.2 仪器与设备
JD-600型9200超声波细胞破碎机、UV-2000紫外可见分光光度计 尤尼柯(上海)仪器有限公司;IB-81型隔水恒温培养箱 日本岛津公司;FOSS Kjeltec 2300凯氏定氮仪 瑞典丹麦福斯集团;DDY-2C型电泳仪 北京六一仪器厂; FR-200A电泳凝胶成像系统 美国UVP Geldot公司;蛋白质纯化系统 瑞典AKTAprime公司;FD-5型真空冷冻干燥机、CR 21G型台式冷冻离心机、L-8800氨基酸全自动分析仪 日本日立株式会社;81-2型恒温磁力搅拌器 上海司乐仪器有限公司;HH-2数显恒温水浴锅 国华电器有限公司;精密电子天平 北京赛多利斯仪器系统有限公司。
1.3 方法
1.3.1 活性物质的分离提取
活性物质的提取流程如图1所示。

图1 中华鳖蛋白组分分步提取流程图Fig.1 Procedures for sequential extraction of protein fractions from Chinese soft-shelled turtle(Pelodiscus sinensis)
1.3.2 分离组分的纯化
将鳖粉提取出来的各组分样品分别进行纯化,纯化采用葡聚糖凝胶SephadexG-100柱层析法,将葡聚糖凝胶SephadexG-100充分溶胀抽气后装柱,柱型 1.6cm×50cm。用蛋白质纯化系统(瑞典AKTAprime System)进行纯化,缓冲液为去离子水,流速为 1mL/min,管速2min/管,以去离子水为洗脱剂,根据洗脱峰,分部收集,合并活性峰。洗脱后样品经透析袋(粒径:14000μm)透析,自动检测并收集目的物,得纯化后的各组分样品。
1.3.3 分离组分蛋白质含量的测定
参照GB/T 5009.5—2003《食品中蛋白质的测定》方法[5]。
1.3.4 分离组分抗氧化活性研究
1.3.4.1 分离组分蛋白还原力的测定
在10mL试管中分别加入不同质量浓度样品各1mL,0.2mol/L、pH6.6的磷酸盐缓冲溶液2.5mL和1%铁氰化钾5mL,置于50℃水浴中20min后急速冷却,加入10%的三氯乙酸5mL,于3000r/min离心10min,取上清液5mL,加入5mL蒸馏水和1mL 0.1%的三氯化铁溶液,混匀后室温下反应10min,于700nm波长处测定吸光度,反应物的吸光度越高表明还原力越强[6-7]。
1.3.4.2 分离组分蛋白DPPH自由基清除率的测定
吸取不同质量浓度的6组样品各1mL,加0.025mg/mL的DPPH自由基甲醇溶液4mL。室温下避光静置1h后于波长517nm[8-9]处测定吸光度。每份样品平行操作3次,DPPH自由基的清除率通过下式计算。
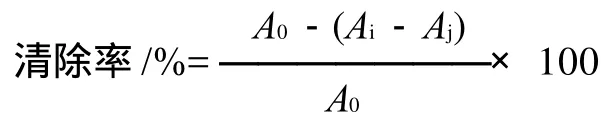
式中:A0为DPPH自由基与溶剂混合液的吸光度;Ai为样品与DPPH自由基反应后的吸光度;Aj为样品与溶剂混合液的吸光度。
实验重复3次,求得清除率的平均值。绘制清除率对质量浓度曲线,计算出清除率为50%时的质量浓度值,即为IC50值[10-11]。
1.3.5 分离组分蛋白的分子质量测定
电泳:采用不连续聚丙烯S D S-酰胺凝胶电泳(PAGE)垂直板电泳法检测甲鱼分离蛋白的分子质量[12-13]。电极缓冲液为25mmol/L Tris-192甘氨酸-0.1% SDS缓冲系统(pH8.3)。10%分离胶,5%浓缩胶,凝胶厚度为1.0mm。在8mA电流下电泳约2h,进入分离胶后调电流至12.5mA,待溴酚蓝染料前沿达分离胶底部时电泳结束。
显色和脱色:染色液(0.1%考马斯亮蓝R-250,45%甲醇,10%冰醋酸)染色0.5h,再取出凝胶浸入脱色液(45%甲醇+9%醋酸)中脱色,直至凝胶本底色带清晰。
扫描:用凝胶成像系统扫描凝胶。
标准曲线的绘制:用卡尺测量溴酚蓝和各种标准蛋白谱带的迁移距离,溴酚蓝染料迁移距离为5.9cm,Rm=标准蛋白(样品)迁移距离(cm)/溴酚蓝迁移距离(cm)。以标准蛋白质的迁移率为横坐标,以其对应的分子质量的对数为纵坐标绘图,绘出已知分子质量即标准蛋白的标准曲线。然后根据未知样品的迁移率,在曲线上查出其对应的分子质量的对数,取其反对数即为分子质量。蛋白质分子质量对数(y)与迁移率(x)的回归方程为:y=5.1271-1.0283x(R2=0.9855)。
2 结果与分析
2.1 分离组分的蛋白质含量
各分离组分的蛋白质含量分别为:组分1为2.203mg/mL,组分2为50.413mg/mL,组分3为20.009mg/mL,组分4为20.524mg/mL,组分5为40.435mg/mL,组分6为非蛋白组分。
2.2 抗氧化活性分析
2.2.1 还原力的测定结果
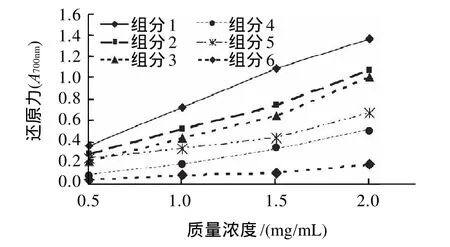
图2 中华鳖提取物各组分还原力比较Fig.2 Concentration dependence of reducing power of various protein fractions from Chinese soft-shelled turtle
由图2可知,随着各组分样品质量浓度的增大各组分的还原能力也依次增强,但各组分的还原力存在一定差异。6个组分还原力的大小顺序依次为1>2>3>5>4>6。经直线回归分析,回归方程分别为:y1=0.3374x+0.0413(R2=0.9962);y2=0.2536x+0.0185(R2=0.9907);y3=0.2561x- 0.0655(R2=0.9789);y4=0.1361x+0.0805(R2=0.9345);y5=0.1395x- 0.07(R2=0.9925);y6=0.0441x- 0.002(R2=0.9449)。
2.2.2 DPPH自由基清除率的测定结果

图3 中华鳖提取液各组分清除DPPH自由基的量效关系Fig.3 Concentration dependence of DPPH free radial scavenging capacity of various protein fractions from Chinese soft-shelled turtle
由图3可知,各组分对 DPPH自由基均有不同程度的清除作用,且清除率随样品质量浓度的增加而增强。经直线回归分析(回归方程分别为:y1=11.303x+47.584(R2=0.9979);y2=8.9186x+32.761(R2=0.9997);y3=5.3231x+8.334(R2=0.9611);y4=10.798x+6.1495(R2=0.9721);y5=8.4111x+10.084(R2=0.9919);y6=4.6474x-0.213(R2=0.9894),其清除率均与其质量浓度成明显的直线关系。经计算各组分的IC50值分别为:0.21、1.94、3.56、4.06、4.76、10.80mg/mL。IC50值越低,其对应的参试样品抗氧化活性越强。样品的IC50值排序为1<2<3<4<5<6。
2.3 分离蛋白的SDS-PAGE电泳
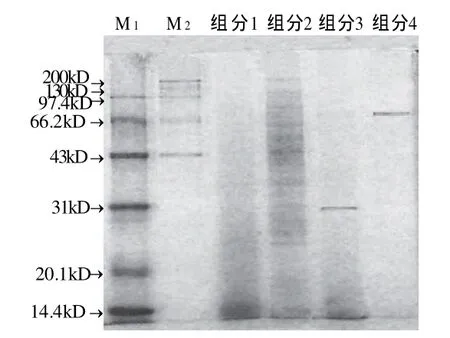
图4 中华鳖各组分的SDS-PAGE电泳图谱Fig.4 SDS-PAGE of various protein fractions from Chinese softshelled turtle

图5 相对电泳迁移率与lgMW之间的关系Fig.5 Relationship between relative electrophoretic mobility and lgMW
由图4、5可知,组分1主要为糖蛋白成分,没有明显的蛋白条带。组分2为水溶性蛋白组分,分子链的分子质量为200、39.4、32.2、28、25.9、23.4kD和15.3kD,并且在分子质量100kD与40kD之间,有少量蛋白溶出,由于样品处理过程中添加了巯基乙醇,因此推断组分2的蛋白中可能含有二硫键,被巯基乙醇破坏后解离成分子质量更小的几条链。组分3为碱溶性蛋白,有分子质量为38.6kD的一个条带。组分4为酸溶性蛋白,有分子质量为66.2kD的一个条带。综合以上数据,可以得到,各组分含有几种不同分子质量的蛋白,且差异较大,但是分子质量基本在10~200kD。
3 讨 论
本实验通过对抗氧化能力的测定发现,糖蛋白及水溶性蛋白具有较强的还原力及DPPH自由基清除活性,同时得出其抗氧化性和质量浓度呈明显的线性相关,在一定范围内,质量浓度越高,抗氧化性越强,说明其具有良好的抗氧化活性,由此,可将其添加至功能性抗氧化食品中,不仅增加食品营养,更具有多种保健功能,另外,同样可用于食品保藏等其他领域。中华鳖抗氧化作用显著,同时也是使用者良好的蛋白来源,其在食品、医药等工业中有广阔的应用前景,但关于中华鳖活性组分多肽的进一步分离、纯化、鉴定还有待于进一步研究。
[1] 刘彦, 刘承初. 甲鱼的营养价值与保健功效研究进展[J]. 上海农业学报, 2010, 26(2):93-96.
[2] 汪禄祥, 刘家富. 药用龟板的氨基酸和矿质元素分析[J]. 云南农业科技, 2006(1):36-37.
[3] 江苏新医学院. 中药大辞典(下册)[M]. 上海:上海科学技术出版社,1986:2722-2727.
[4] HOHLFELD J, ROESSINGH A B, HIRT-BURRI N, et al. Tissue engineered fetal skin constructs for paediatric burns[J]. The Lancet,2005, 366(9488):840-842.
[5] GB/T 5009. 5—2003食品中蛋白质的测定[S].
[6] YEN G C, DUH P D. Antioxidative properties ofmethanolic extacts from peanut hulls[J]. Journal of American Oil Chemists Society, 1993, 70:383-386.
[7] VINEET K, ANITA R, AMIT K D, et al. A comparative assessment of total phenolic content, ferric reducing-anti-oxidative power, free radicalscavenging activity, vitamin C and isoflavones content in soybean with varying seed coat colour[J]. Food Research International, 2010, 43(1):323-328.
[8] 冯翠萍, 王晓闻, 程旭东, 等. 灵芝孢子粉多糖的提取及其生物活性研究[J]. 中国食品学报, 2009, 9(3):58-62.
[9] PINTHUS E J, SAGUY I S. Initial interfacial tension and oil up take by deep- fat fried foods[J]. Food Sci, 1994, 59:804-807.
[10] 崔凤杰, 闫桂强, 黄达明, 等. 酶法降解小麦面筋蛋白制备抗氧化产物的研究[J]. 食品研究与开发, 2007(11):81-84.
[11] DAWIDOWICZ A L, WIANOWSKA D, BARANIAK B. The antioxidant properties of alcoholic extracts fromSambucus nigraL. (antioxidant properties of extracts)[J]. LWT - Food Science and Technology, 2006,39(3):308-315.
[12] 汪家政, 范明. 蛋白质技术手册[M]. 北京:科学出版社, 2000:77-108.
[13] 张龙翔, 张庭芳, 李令媛. 生化实验方法和技术 [M]. 北京:高等教育出版社,1981:112-118.
Sequential Extraction of Protein Fractions from Chinese Soft-shelled Turtle (Pelodiscus sinensis) and Their Antioxidant Activities
LIU Yan1,LIU Cheng-chu1,*,YANG Jing-ya1,LIU Qi-gen2,LI Ying-sen2,LI Jia-le2,3
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University,Shanghai 201306, China;3. Aquaculture Division, E-Institute of Shanghai Universities, Shanghai 201306, China)
TQ93
A
1002-6630(2010)21-0081-04
2010-06-28
上海海洋大学骆肇荛大学生科技创新基金项目(A-2900-08-001519);农业部公益性行业(农业)科研专项(200903028);上海高校创新团队建设项目;上海市教育委员会重点学科建设项目(J50704)
刘彦(1985—),女,硕士研究生,研究方向为海洋资源开发与利用。E-mail:79030199@163.com
*通信作者:刘承初(1965—),女,教授,博士,研究方向为海洋生物资源利用、营养与食品安全。E-mail:ccliu@shou.edu.cn

