夏氏疟原虫感染早期易感和抵抗小鼠树突状细胞细胞因子的分泌特点*
武静静,刘 军,郑 伟,潘艳艳,李 莹,刘力源,姜懿凌,曹雅明,郑 丽
2.沈阳军区总医院检验科,沈阳 110016;
3.沈阳军区总医院检验科,沈阳 110016
疟疾感染早期,保护性免疫应答的建立有赖于CD4+T细胞的有效活化〔1〕,不同亚群 CD4+T细胞的活化和抗原提呈细胞分泌的细胞因子密切相关。树突状细胞(Dendritic cells,DCs)产生IL-12诱导以IFN-γ分泌增加为主的Th1细胞免疫应答,对夏氏疟原虫(Plasmodium chabaudi chabaudiAS,P.c.chabaudiAS)感染的控制和清除至关重要〔2〕。然而,过强的CD4+T细胞应答,尤其是IFN-γ参与的炎症应答,与免疫病变的发生密切相关〔3〕。同时,有研究显示,DCs分泌的IL-10和TGF-β明显抑制肝阶段 T细胞介导的保护性免疫应答〔4〕。因此,DCs在疟疾感染早期可能通过分泌不同种类的细胞因子参与易感和抵抗小鼠Th1细胞免疫应答的诱导和调控。
本研究利用成功建立的P.c.chabaudiAS感染的DBA/2和BALB/c小鼠模型,采用磁珠纯化的方法分离DCs并进行体外培养,ELISA方法检测DCs培养上清中细胞因子IL-12p40、IL-10和TGF-β1的分泌水平,以期探讨疟疾感染早期DCs前炎性和免疫调节性细胞因子的分泌特点,旨在明确DCs对Th1细胞免疫应答调节的相关机制。
1 材料与方法
1.1 疟原虫及实验动物感染 6-8w龄、雌性DBA/2和BALB/c小鼠(中国医学科学院实验动物研究所提供,许可证编号:SCXK京200420001)经腹腔感染1×106P.c.chabaudiAS(日本爱媛大学分子寄生虫学教研室惠赠)寄生的红细胞(Parasitized Red Blood Cell,pRBC),感染不同时间的小鼠经尾静脉采血,制备薄血膜,Giemsa染色,镜检计数红细胞感染率。
1.2 脾DCs的纯化和培养 无菌取出感染前和感染后3d、5d、8d小鼠脾脏,常规方法制备脾细胞悬液,用0.17mol/L NH4Cl裂解红细胞。以含10%胎牛血清(FCS)的RPMI1640调整脾细胞终浓度为1×107/mL。按文献〔5〕方法,从小鼠脾细胞中纯化DCs,培养48h后收集上清,-80℃保存,待细胞因子IL-12p40 、IL-10 和 TGF-β1检测 。
1.3 细胞因子的检测 用双抗体夹心ELISA试剂盒分别检测 DCs培养上清中 IL-12p40、IL-10和TGF-β1的分泌水平。酶标仪测定450nm处OD值。结果以试剂盒提供的标准品绘制标准曲线,应用SoftMax Pro 4.3.1Ls软件分析,计算细胞因子含量(pg/m1)。
1.4 统计学处理 应用SPSS11.5统计学分析软件,单因素方差分析比较各组均值的显著性差异,P<0.05为差异显著(结果为3次结果的均值)。
2 结 果
2.1 两种小鼠感染后不同时间的虫体血症水平及生存率 感染后4d,两种小鼠外周血中均出现疟原虫感染的红细胞,且感染后前9d,原虫血症水平呈相同的上升趋势。BALB/c小鼠原虫血症水平至感染后9d达峰值后迅速下降,并于感染后21d左右自愈,其生存率100%;相比而言,DBA/2小鼠的红细胞感染率至感染后9d达峰值后也迅速下降,70%~80%的小鼠死亡,幸存小鼠不能清除感染,有低水平的虫体血症,见图1。
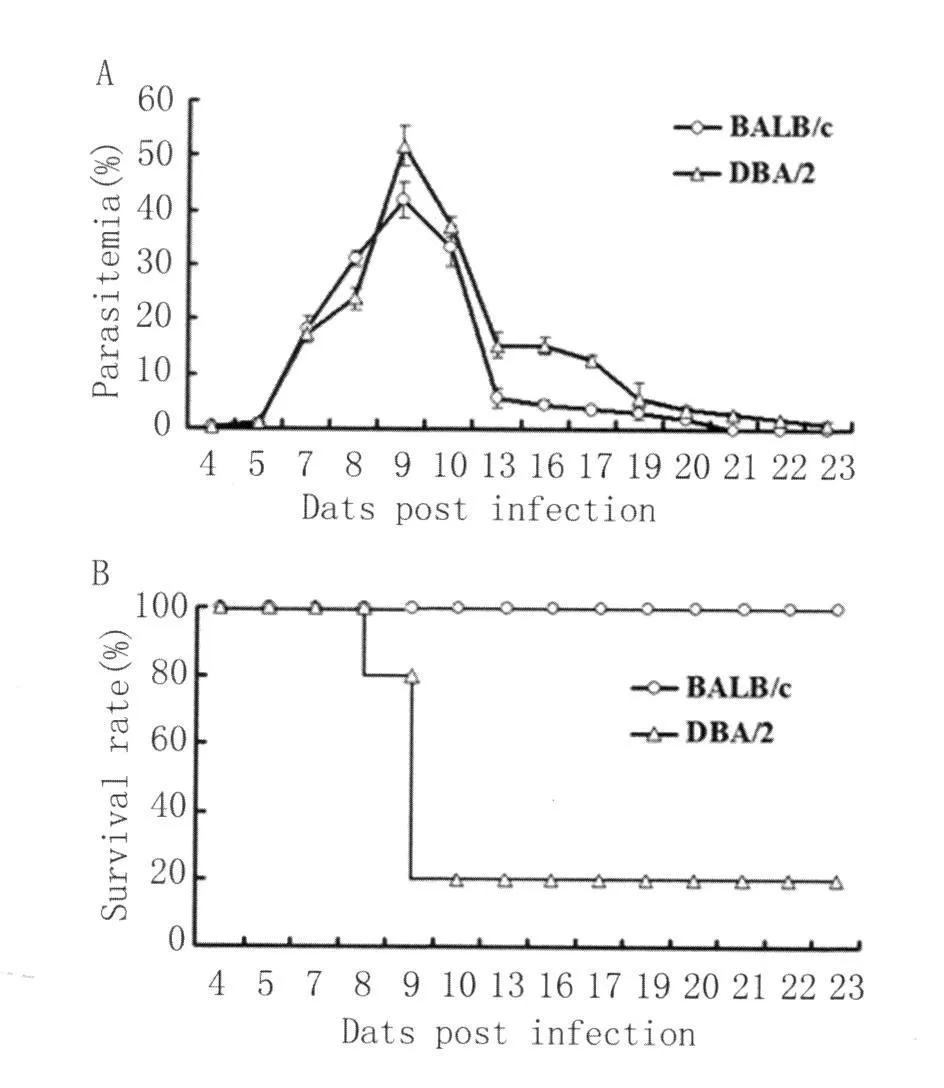
图1 DBA/2与BALB/c小鼠感染后不同时间虫体血症水平及生存率Fig.1 The parasitemia and survival rate of DBA/2 and BALB/c mice at different time points after infection
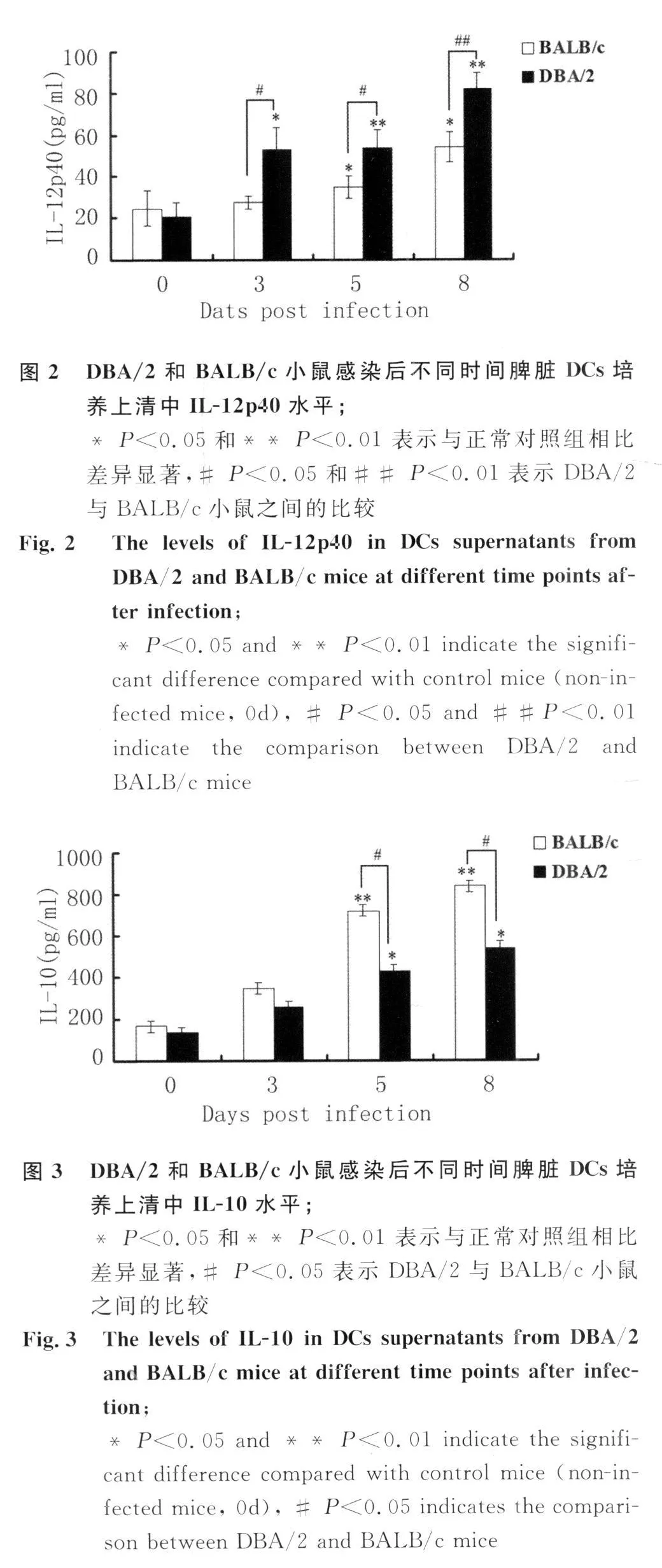
2.2 两种小鼠感染后不同时间DCs培养上清中IL-12p40的水平 感染后3d-5d,DBA/2小鼠DCs培养上清中IL-12p40的水平出现显著升高(P<0.05或P<0.01),感染后第 8d达峰值(P<0.01)。相比,BALB/c小鼠DCs培养上清中IL-12p40的水平从感染后5d出现有意义的升高,8d达峰值(P<0.05),但在感染后3d-8d其水平均明显低于DBA/2小鼠(P<0.05或P<0.01),见图2。
2.3 两种小鼠感染后不同时间DCs培养上清中IL-10的水平 感染后第5d,两种小鼠DCs培养上清中IL-10的分泌水平明显升高(P<0.05或P<0.01),并于感染后第8d达到最高水平(P<0.05或P<0.01);在感染后第5d和第 8d,DBA/2小鼠DCs培养上清中IL-10的分泌水平均明显低于BALB/c小鼠(P<0.05),见图3。
2.4 两种小鼠感染后不同时间DCs培养上清中TGF-β1的水平 感染后第5d,两种小鼠DCs培养上清中TGF-β1的分泌水平明显升高(P<0.01),并于感染后第8d达到最高水平(P<0.01);在感染后第 5d和第 8d,DBA/2小鼠 DCs培养上清中TGF-β1的分泌水平均明显低于BALB/c小鼠(P<0.05),见图4。
3 讨 论
疟疾感染早期有效的 Th1细胞免疫应答的建立和维持对于控制疟原虫的爆发性增殖和宿主的存活至关重要〔6-7〕,然而过度的 Th1应答也会对小鼠造成一定的病理损伤如引发肝损伤〔8〕。DCs在诱导固有和适应性免疫应答方面发挥着举足轻重的作用,活化的DCs通过分泌不同种类的细胞因子来参与调控Th1/Th2免疫应答〔9〕。疟疾感染过程中,DCs分泌的IL-12是启动Thl细胞免疫应答的重要细胞因子〔2〕。本实验结果显示,感染后第3-8d,DBA/2小鼠与BALB/c小鼠DCs分泌的IL-12水平均呈逐渐增高趋势,但DBA/2小鼠DCs分泌的IL-12水平显著高于BALB/c小鼠。以上结果充分提示,P.c.chabaudiAS感染易感型DBA/2和抵抗型BALB/c小鼠之后,两种小鼠均成功建立了Th1细胞免疫应答,并且这种初步建立的Th1免疫应答差异明显依赖于IL-12分泌的数量。
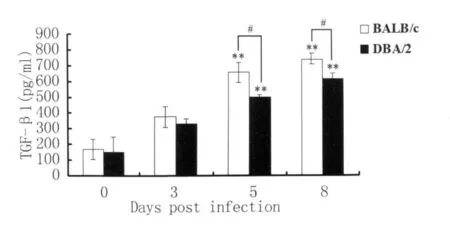
图4 DBA/2和BALB/c小鼠感染后不同时间脾脏DCs培养上清中TGF-β 1水平;**P<0.01表示与正常对照组相比差异显著,#P<0.05表示DBA/2与BALB/c小鼠之间的比较Fig.4 The levels of TGF-β1 in DCs supernatants from DBA/2 and BALB/c mice at different time points after infection;**:P<0.01 indicates the significant difference compared with control mice(non-infected mice,0d),#P<0.05 indicates the comparison between DBA/2 and BALB/c mice
免疫调节性细胞因子IL-10和 TGF-β在多种细胞内病原体(包括疟原虫)感染过程中,主要通过免疫抑制作用参与免疫应答的调控。本实验结果显示,感染后3~8d,两种小鼠DCs分泌的 IL-10和TGF-β1的水平均呈逐渐升高趋势,感染后5-8d出现有意义升高,并且BALB/c小鼠DCs分泌的IL-10与TGF-β1水平明显高于DBA/2小鼠。由此提示,BALB/c小鼠正是由于分泌IL-10和TGF-β1的DCs的适度活化,使其Th1细胞免疫应答能够维持在适宜水平。DBA/2小鼠DCs不能分泌足够的抑制性细胞因子IL-10和TGF-β1,使其Th1细胞免疫应答过强,从而导致免疫病理损伤。因此,分泌免疫调节性细胞因子IL-10和TGF-β1的DCs的活化强度和时相明显影响着Th1细胞免疫应答的水平和效应强度。
综上所述,BALB/c小鼠和DBA/2小鼠在DCs细胞因子的分泌模式上存在显著差异。而这种差异性也进一步提示,DCs分泌的前炎性细胞因子IL-12和免疫调节性细胞因子IL-10和TGF-β1之间处于动态平衡模式中,而这一平衡模式明显决定着Th1细胞免疫应答的启动和调控。
〔1〕Yazdani SS,Mukherjee P,Chauhan VS,et a1.Immune responses to asexual blood-stages of malaria parasites〔J〕.Curr M ol Med,2006,6(2):187-203.
〔2〕Ing R,Stevenson MM.Dendritic cell and NK cell reciprocal cross talk promotes gamma interferon-dependent immunity to bloodstagePlasmodium chabaudiAS infection in mice〔J〕.Infect Immun,2009,77(2):770-782.
〔3〕Voisine C,Mastelic B,Sponaas AM,et al.Classical CD11c+dendritic cells,not plasmacytoid dendritic cells,induce T cell responses toPlasmodium chabaudimalaria 〔J〕.Int J Parasitol,2010,40(6):711-719.
〔4〕Ocana-M orgner C,Wong KA,Legal F,et al.Role of TGF-β and PGE2in T cell responses duringPlasmodium yoeliiinfection〔J〕.Eur J Immunol,2007,37(6):1562-1574.
〔5〕D'Keeffe M,Hochrein H,Vremec D,et al.Mouse plasmacytoid cells:long-lived cells heterogeneous in surface phenotype and function,that differentiate into CD8+dendritic cells only after microbial stimulus〔J〕.J Exp Med,2002,196(10):1307-1319.
〔6〕U rban BC,Ing R,Stevenson MM.Early interactions between blood-stagePlasmodiumparasites and the immune system 〔J〕.Curr Top Microbiol Immunol,2005,297:25-70.
〔7〕Wu Y,Wang QH,Zheng L,et al.Plasmodium yoelii:distinct CCDregulatory T cell responses during the early stages of infection in susceptible and resistant mice〔J〕.Exp Parasitol,2007,115(3):301-304.
〔8〕Seixas E,Oliveira P,Moura Nunes JF,et al.An experimental model for fatal malaria due to T NF-alpha-dependent hepatic damage〔J〕.Parasitology,2008,135(6):683-690.
〔9〕Sher A,Pearce E,Kaye P.Shaping the immune response to parasites:role of dendritic cells〔J〕.Curr Opin Immunol,2003,15(4):421-429.
——“零疟疾从我开始”

