RT-LAMP技术检测菜豆荚斑驳病毒的研究
闻伟刚, 杨翠云, 崔俊霞, 张 颖
(1.宁波出入境检验检疫局,宁波 315012; 2.上海出入境检验检疫局,上海 200135)
菜豆荚斑驳病毒(Bean pod mottle virus,BPMV)是我国对外公布的检疫性有害生物,该病毒可通过种子传播,引起大豆产量的下降并降低大豆品质[1]。因此,加强对该病毒的检测具有重要的意义。
目前,针对 BPMV的检测方法主要有 DASELISA和RT-PCR技术[2-4]。相比传统的电镜观察和生物学鉴定,这2种方法在检测周期方面具有明显的优势,操作也更为简单。随着实时荧光 RTPCR技术的发展[5-7],因其具有高特异和高灵敏的优点,针对BPMV的实时荧光RT-PCR检测也有了详细的研究[8]。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)作为一种新颖的核酸扩增方法,同样具有检测速度快、操作简单和灵敏度高等优点。该技术依赖于能够识别靶序列上6个特异区域的引物和一种具解旋功能且呈瀑布式扩增的Bst DNA聚合酶,在等温条件下可高效、快速和特异地扩增靶序列[9]。由于LAMP呈瀑布式扩增,因此其扩增效率非常高;同时,LAMP识别靶序列上的6~8个特异性位点,其特异性也很强;LAMP只在60~65℃进行恒温扩增,只要水浴锅即可,无需特殊的仪器,操作非常简单;而且 LAMP的整个检测反应只需1.5~2.5 h,检测周期非常短。基于LAMP技术所具有的优点,本文针对菜豆荚斑驳病毒的RT-LAMP检测方法的建立进行了研究。
1 材料与方法
1.1 供试材料
菜豆荚斑驳病毒的阳性标准物质购自美国Agdia公司,样品状态为新鲜叶片经液氮处理,磨成粉末状,冷藏于4℃冰箱保存。含有BPMV的阳性样品为从美国进口的大豆种子,经普通 RT-PCR与DAS-ELISA检测确证含有BPMV[4]。南方菜豆花叶病毒(Southern bean mosaic virus,SBMV)、南芥菜花叶病毒(Arabis mosaic virus,ArMV)、大豆花叶病毒(Soybean mosaic virus,SMV)、烟草环斑病毒(Tobacco ringspot virus,TRSV)以及番茄环斑病毒(Tomato ringspot virus,ToRSV)等阳性标准物质也都购自美国Agdia公司。
RT-LAMP引物由上海英骏生物技术公司合成。核酸提取试剂Trizol购自上海生物工程公司。RT-ULAMP扩增试剂盒购自北京美莱博医学科技有限公司。One-step RNA PCR kit与 DL-2000 Marker购自大连TaKaRa公司。
1.2 引物设计
引物序列见表1。根据GenBank(http:∥www.ncbi.nlm.nih.gov)中已登录的菜豆荚斑驳病毒的外壳蛋白基因序列(M62738),采用Blast程序进行同源性比较,在序列的保守区,使用Primer Express 3.0软件 ,设计得到 F3 、B3、FIP(F1c+TTTT+F2)、BIP(B1c+TTTT+B2)、Loop1和 Loop2共 6条引物,分别识别外壳蛋白编码基因的8个位点。
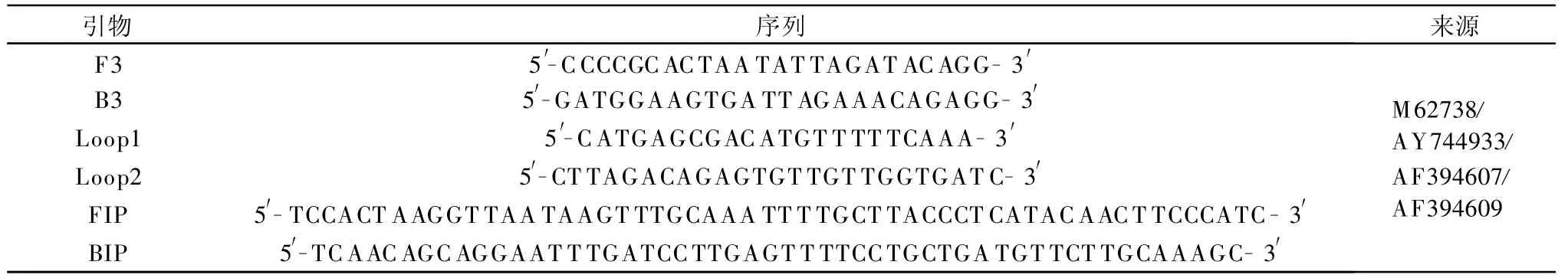
表1 RT-LAMP检测菜豆荚斑驳病毒的引物
1.3 菜豆荚斑驳病毒的RT-LAMP扩增
1.3.1 总RNA提取
采用Trizol试剂方法提取[4]。
1.3.2 RT-LAMP扩增
反应体系:2×U-LAMP Mix 10μL,引物F3和B3的终浓度各为0.2μmol/L,Loop1和Loop2的终浓度各为0.8μmol/L,FIP和BIP的终浓度各为1.6μmol/L,Bst DNA 聚合酶(5 U/μL)1.5μL,AMV RNA 聚合酶(5 U/μL)1 μL,模板 RNA 1μL,用dd H 2O补充至总体积20μL。
反应条件如下:在恒温60℃的水浴锅中扩增1 h。
1.3.3 RT-LAMP结果分析
反应结束后,取10μL扩增产物进行1.5%琼脂糖凝胶电泳,在GelDoc-2000(Bio-Rad)凝胶成像系统上观察并记录结果。
1.4 RT-LAMP的特异性试验
抽提得到南方菜豆花叶病毒、南芥菜花叶病毒、大豆花叶病毒、烟草环斑病毒以及番茄环斑病毒等几种侵染大豆的植物病毒RNA,按照建立的菜豆荚斑驳病毒RT-LAMP检测方法,进行特异性研究。健康大豆种子提取液作为阴性对照。
1.5 菜豆荚斑驳病毒RT-PCR检测方法的建立
RT-PCR反应体系参照One-step RNA PCR kit试剂盒说明进行,其中引物为F3和B3。反应条件如下:50℃cDNA合成30 min,94℃预变性2 min;94℃变性30 s,60℃复性 30 s,72℃延伸1 min,35个循环;最后72℃延伸 5 min。
1.6 RT-LAMP的检测灵敏度试验
将提取好的菜豆荚斑驳病毒RNA模板进行10倍系列稀释 ,得到 10-1、10-2、10-3、10-4和 10-5稀释的病毒 RNA样品。采用建立的 RT-LAMP和RT-PCR方法进行扩增灵敏度比对试验。
1.7 进境样品中BPMV的RT-LAMP检测
选取20份从美国进境的大豆样品,通过样品处理得到总RNA[4],采用建立的RT-LAMP方法进行检测。
2 结果与分析
2.1 菜豆荚斑驳病毒的RT-LAMP扩增结果
菜豆荚斑驳病毒的阳性标准物质和含有BPMV的阳性美国大豆样品RNA经过RT-LAMP扩增后,均能够得到特异性的瀑布状条带,而其他病毒毒株的RNA模板则无扩增条带出现,也未从健康大豆种子提取液的RNA模板中扩增到特异性基因条带(图1)。这表明本研究设计的6条引物针对BPMV的检测具有非常好的保守性与特异性。
2.2 RT-LAMP检测灵敏度试验
不同稀释梯度的菜豆荚斑驳病毒RNA经过RT-LAMP扩增后,其检测灵敏度为10-3病毒稀释液(图2a),比普通RT-PCR方法的检测灵敏度高出1 000倍(图2b)。
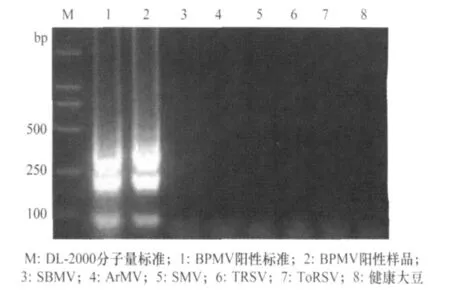
图1 RT-LAMP扩增菜豆荚斑驳病毒
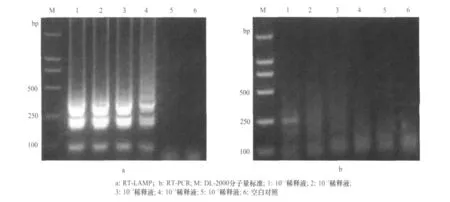
图2 RT-LAMP和RT-PCR检测菜豆荚斑驳病毒的灵敏度
2.3 大豆样品的RT-LAMP检测
针对20份从美国进境的大豆样品,预先采用DAS-ELISA方法进行检测,结果判定为BPMV阳性。然后采用本研究建立的 RT-LAMP方法进行检测,均可获得阳性结果。
3 讨论
自环介导等温扩增技术建立以来,该方法已被逐渐应用于细菌、病毒和寄生虫等的检测。2004年,Fukuta等用免疫捕获RT-LAMP方法检测感染菊花的番茄点状枯萎病毒,结果显示,免疫捕获RTLAMP的敏感性比RT-PCR高出100倍[10]。Hong等用LAMP方法检测严重急性呼吸综合征(SARS)病毒,与传统 RT-PCR方法相比,灵敏度高出100倍,可在1 h内获得结果,最短为11 min[11]。秦智锋等建立口蹄疫病毒的RT-LAMP检测方法,从核酸抽提到检测仅需75 min,并采用加入荧光染料SYBR green I直接进行肉眼或紫外照射观察阳性结果[12]。
本研究建立的菜豆荚斑驳病毒RT-LAMP检测方法,针对RNA的稀释液进行灵敏度研究表明,该方法的检测灵敏度比RT-PCR高1 000倍,从核酸抽提到结果观察的整个检测周期约2~2.5 h,因此,具有灵敏、快速和特异性高的优点。但同时,该方法也存在不足的地方,首先是引物的设计,针对8个基因位点共设计6条引物,缺乏专门的RTLAMP引物设计软件,只能采用普通PCR引物设计软件,其引物设计和评估的难度比较大;另外,FIP和BIP引物因碱基数多且使用量大,检测成本较高。其次,在本研究过程中,曾采用荧光染料 SYBR green I进行RT-LAMP扩增产物的观察,虽然阳性结果在紫外照射下能够显示白色发光,但阴性和空白对照同样有白色发光,这使得在现场很难判定阳性结果,而只能用电泳方法进行判断。SYBR green I染料的工作原理是只要扩增产物中出现双链DNA,就会嵌入当中而发出荧光,RT-LAMP共使用了6条引物约200个碱基,在实际扩增中往往会出现一定程度的自环化现象,从而导致阴性和空白对照也出现荧光反应。最后,RT-LAMP的瀑布状扩增产物与传统的PCR特异性条带存在差异,这会使得研究人员在结果判定方面不适应。
RT-LAMP方法不需要特殊的试剂和仪器设备,随着该技术的不断完善与改进,将会建立起一种成本低廉的检测体系,从而在病原检测和疾病快速诊断等领域具有广泛的应用前景。
[1] Loren JG,Said A G,Thomas E H,et al.Bean pod mottle virus:a threat to U.S.soybean production[J].Plant Disease,2002,86(12):1280-1289.
[2] 魏梅生,相宁,张春泉,等.菜豆荚斑驳病毒的 RT-PCR检测[J].大豆科学,2005,24(4):317-319.
[3] 于翠,杨翠云,宋绍祎,等.进口大豆上菜豆荚斑驳病毒的免疫捕获巢式RT-PCR检测[J].植物检疫,2006,20(4):201-204.
[4] 闻伟刚,崔俊霞,赵秀玲,等.半巢式RT-PCR检测进口大豆中菜豆荚斑驳病毒的研究[J].植物病理学报,2006,36(4):296-300.
[5] Eun J C,Seoh M L,Wong S M.Simultaneous quantitation of two orchid viruses by the TaqManReg real-time RT-PCR[J].Journal of Virological Methods,2000,87(1/2):151-160.
[6] Mumford R A,Walsh K,Barker I,et al.Detection of Potato mop top v ir us and Tobacco rattle virus using a multiplex realtime fluorescent reversetranscription polymerasechain reaction assay[J].Phytopathology,2000,90(5):448-453.
[7] 朱建裕,朱水芳,廖晓兰,等.实时荧光 RT-PCR一步法检测番茄环斑病毒[J].植物病理学报,2003,33(4):338-341.
[8] 闻伟刚,谭钟,张吉红,等.应用 TaqMan MGB探针技术检测菜豆荚斑驳病毒[J].植物保护学报,2009,36(1):51-54.
[9] Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):e63.
[10]Fuk uta S,Ohishi K,Yoshida K,et al.Development of immunocapture reverse transcrip tion loop-mediated isothermal amplification for the detection of Tomato spotted wilt vir us from chrysanthemum[J].Journal of Virological Methods,2004,21(1):49-55.
[11]Hong T C,Mai Q L,Cuong D V,et al.Development and evaluation of a novel loop-mediated isothermal amp lification method for rapid detection of sever acute respiratory syndrome coronavirus[J].Journal of Clinic Microbiology,2004,4:1956-1961.
[12]秦智锋,曾少灵,阮周曦,等.口蹄疫病毒RT-LAMP检测方法的建立[J].中国预防兽医学报,2008,30(5):375-378.

