体外培养所形成的细胞外基质对MC3T3-E1细胞生长和分化的影响
郭勇,刘璐,郝庆新,李瑞欣,张西正,王亮,宁波
军事医学科学院卫生装备研究所,天津 300161
细胞外基质 (Extra cellular matrix,ECM) 是机体发育过程中由细胞分泌到细胞外空间的分泌蛋白和多糖构成的精密有序的网络结构[1-2]。ECM对组织细胞起支持、保护、营养作用,在细胞的增殖、分化、代谢、识别、黏着、迁移等基本生命活动方面起重要作用[3-4]。
ECM 在细胞的功能和生长分化方面起重要调节作用[5-6],为维护体外和体内的细胞生长提供重要微环境[7]。从仿生角度看细胞外基质更接近天然状态,是优良的生物材料和组织工程支架[8],必将在细胞和组织工程等方面得到更广泛和深入的应用。胶原、层粘连蛋白、纤连蛋白等ECM成分早已作为培养皿 (瓶) 表面裱衬材料得到应用,可促进细胞的粘附和生长[9-10]。近年来,ECM 对细胞 (组织) 生长分化的研究更加深入全面,很多研究通过脱细胞技术,脱去体外培养的细胞,获得包被在培养皿或支架上的ECM,然后研究这些ECM的生物活性。例如:体外形成的成骨细胞ECM在二维条件下和三维条件下均可促进干细胞骨向分化[11-12]。软骨细胞来源的ECM可促进间充质干细胞软骨向分化,维持软骨细胞的特征,并有助于软骨组织形成[13]。体外形成的心肌成纤维细胞 ECM可促进骨髓间充质干细胞的粘附和增殖。研究者将体内不同组织的ECM包被在培养皿 (板) 上,发现这些ECM在体外培养条件下可促进同种组织细胞的生长并有助于保持同种组织来源细胞的分化状态[14]。
分析以上研究结果,我们认为体外培养细胞形成的ECM也具有“组织特异性”,即不同组织来源的ECM具有不同生物活性。为证实这个假设,我们选择了两种比较典型的细胞:原代小鼠成骨细胞和心肌成纤维细胞。利用脱细胞技术,获得这两种ECM包被的培养皿 (板),将小鼠成骨前体细胞MC3T3-E1接种在包被了体外形成的成纤维细胞和成骨细胞外基质的培养 (皿) 板中,通过检测细胞的生长、增殖、骨向分化,比较这两种ECM的生物活性,探讨二维培养条件下不同ECM对细胞生长和分化的影响,为将ECM用于不同的细胞和组织工程打下基础。
1 材料与方法
1.1 材料和试剂
C57小鼠乳鼠 (军事医学科学院动物中心),MC3T3-E1细胞 (中国医学科学院细胞库),α-MEM培养液、胎牛血清 (Invitrogen公司),MTT细胞增殖检测盒 (Promega公司),钙检测试剂盒 (南京建成生物工程所),碱性磷酸酶活性检测试剂盒和AEC显色液 (北京中杉公司),兔抗骨形成蛋白2抗体、兔抗骨桥蛋白抗体 (武汉博士德公司),VG胶原染色试剂盒 (福建迈威公司),化学发光液 (Santa Cruz公司)。
1.2 方法
1.2.1 ECM包被培养板的制备
无菌条件下取 C57小鼠乳鼠颅顶骨和心室组织,分别剪成碎片,以组织块法培养成骨细胞[15]和心肌成纤维细胞,传到第3代后,将成骨细胞和成纤维细胞分别接种于培养板中培养6 d。通过去细胞处理-PBS缓冲液反复清洗后获得ECM包被培养板[16],按照试剂盒说明书,进行Van Gieson (VG) 胶原纤维染色观察并拍照,-20 ℃冻存备用。
1.2.2 ECM骨形成蛋白2免疫组化
将包被于培养板中的ECM用95%乙醇固定,蒸馏水漂洗3次,5% BSA室温封闭20 min后,滴加1∶200倍稀释的兔抗骨形成蛋白2多克隆抗体,4 ℃过夜,PBS磷酸盐缓冲液漂洗2 min,重复3次;滴加辣根过氧化物酶标记山羊抗兔IgG,37 ℃湿盒孵育45 min,PBS磷酸盐缓冲液漂洗2 min,重复3次;AEC显色液室温显色10 min,显微镜下观察、拍照。
1.2.3 细胞的接种和生长
将MC3T3-E1细胞以每孔1.0×104个细胞的密度接种在24孔ECM包被培养板中,以含10%胎牛血清的α-MEM培养液接种1、3、5、7 d后,以MTT细胞增殖检测盒检测细胞的增殖活性,增殖活性以560 nm下的吸光值 (A560) 表示相对大小。以未包被ECM的培养板为对照。
1.2.4 MC3T3-E1细胞的骨向诱导
将细胞以每孔 2.0×104个细胞的密度接种在24孔ECM包被培养板中,以含50 mg/L维生素C、10 mmol/L β-甘油磷酸钠的α-MEM培养液培养,每3天换1次培养液。诱导后,检测细胞骨向分化:
1) 碱性磷酸酶活性检测
以含0.1% Triton-X100的PBS室温下处理培养板中的细胞30 min,反复冻融3次后,用碱性磷酸酶活性检测盒试剂盒检测裂解液中的碱性磷酸酶活性,按照说明书进行,酶活性以裂解液总活性金氏单位 (U) 与其总蛋白含量 (g) 的比值表示 (U/g)。
2) 骨形成蛋白2和骨桥蛋白免疫印迹检测
将细胞以 0.25%的胰蛋白酶消化后离心,PBS重悬后再离心1次,RIPA细胞裂解液裂解细胞,提取细胞总蛋白,BCA蛋白定量试剂盒定量。常规电泳、转膜、封闭,然后分别用兔抗骨桥蛋白和BMP-2抗体 (1∶500) 孵育,二抗采用 HRP耦联的羊抗兔(1∶1 000),以GAPDH为内参,化学发光液作用10 min后X光片曝光显影。扫描胶片后以图像分析软件QuantityOne分析蛋白含量变化。
3) 钙分泌检测
在24孔板培养7 d的细胞用PBS洗涤2次,每孔加入200 μL 0.1 mol/L的HCl,反复吹打裂解,室温下处理24 h,然后收集所有裂解液,4 000 r/min离心,弃细胞碎片,通过钙检测试剂盒测定上清液中的钙含量,此即为培养板的总钙含量,同时检测ECM包被的培养板中的钙含量,总钙含量减去ECM培养板的钙含量,即为细胞实际分泌的钙量。
以上实验均以未包被ECM的培养板为对照。
2 结果
2.1 ECM的观察和染色
倒置纤维镜下观察ECM包被的培养板,未见任何细胞结构,可见到织网状纤维结构,VG染色可见红色胶原纤维,也未见细胞结构,两种ECM的形态基本相同 (图 1)。BMP-2免疫组化显示成骨细胞ECM为阳性,成纤维细胞ECM为阴性 (图2)。
2.2 细胞增殖检测
MC3T3-E1细胞在ECM培养板上培养2 d,就发现成纤维细胞ECM包被板中细胞的A560值最高,且显著高于对照组和成骨细胞 ECM组,成骨细胞ECM组的A560值也显著高于对照组;培养3 d后,检测结果与培养2 d后的基本相同,接种于成纤维细胞ECM包被板中的细胞的A560值为最高;培养5 d后,成纤维细胞ECM包被板中细胞的A560值仍最高,且显著高于对照组,但成骨细胞 ECM组的A560值与对照组无明显差异;培养 7 d后 3组 A560值均无显著差异 (图3)。
图1 ECM VG胶原纤维的染色Fig. 1 VG histochemical staining for collagen fiber of ECMs. (A) Osteoblasts ECM. (B) Fibroblasts ECM.

图2 ECM BMP-2免疫组化染色Fig.2 Immunohistochemical staining for BMP-2 of ECMs. (A) Osteoblasts ECM. (B) Fibroblasts ECM.
2.3 细胞分化检测
2.3.1 碱性磷酸酶活性检测
MC3T3-E1细胞在ECM包被培养板中培养3 d后,3组中碱性磷酸酶活性虽有差异但不显著;培养5 d后,3组中碱性磷酸酶活性开始有了明显差异,成骨细胞ECM组的酶活性显著高于其他2组,其他2组间酶活性无明显差异;培养7 d后,3组的酶活性差距明显降低,但仍是成骨细胞ECM组的酶活性最高 (图4)。
2.3.2 骨形成蛋白2和骨桥蛋白免疫印迹
MC3T3-E1细胞在ECM包被培养板中培养5 d后,其骨形成蛋白 2免疫印迹结果显示:对照组和成纤维细胞ECM组BMP-2蛋白表达水平差别不大,成骨细胞 ECM组的 BMP-2蛋白表达水平最高,BMP-2蛋白表达水平显著高于其他组 (图5)。培养5 d后骨桥蛋白免疫印迹结果与BMP-2的结果相同:对照组和成纤维细胞 ECM组蛋白表达水平差别不大,成骨细胞ECM组的骨桥蛋白表达最高。
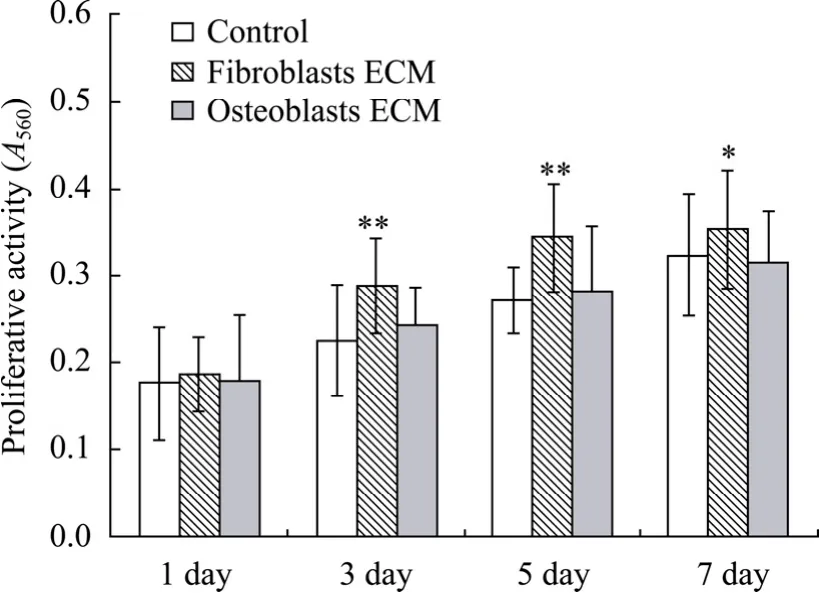
图3 MC3T3-E细胞增殖活性 MTT检测 (*P<0.05; **P<0.01)Fig. 3 MC3T3-E1Cells proliferation assay with MTT. *P<0.05; **P<0.01.
图 4 MC3T3-E1碱性磷酸酶活性检测(*P<0.05; **P<0.01)
Fig. 4 Alkaline phosphatase activity of MC3T3-E1 assay. *P<0.05; **P<0.01.
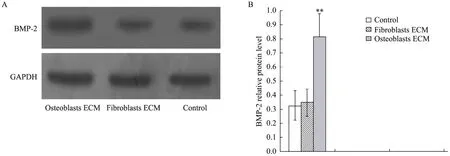
图5 MC3T3-E1BMP-2免疫印迹检测Fig. 5 Western blotting analysis of BMP-2 in MC3T3-E1cella. (A) Photo of Western blotting. (B) Relative protein levels. **P<0.01.
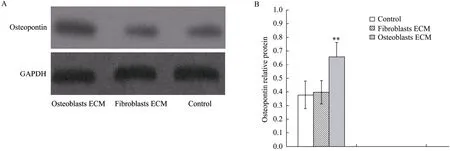
图6 MC3T3-E1骨桥蛋白免疫印迹检测Fig. 6 Western blotting analysis of osteopontin in MC3T3-E1cells. (A) Photo of Western blotting. (B) Relative protein levels. **P<0.01.
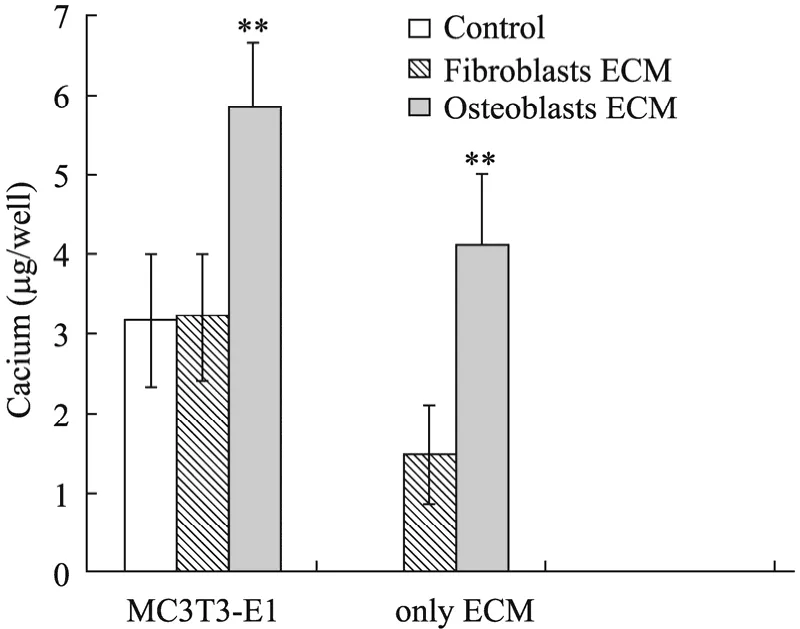
图7 MC3T3-E1细胞钙分泌量检测 (**P<0.01)Fig. 7 Secreted calcium assay of MC3T3-E1 cells. **P<0.01.
2.3.3 钙分泌检测
MC3T3-E1细胞在ECM包被培养板中培养7 d后,其钙分泌检测结果显示:对照组和成纤维细胞ECM组差别不大,成骨细胞ECM组的钙分泌量最高,比其他组高1倍左右,如图7所示。
3 讨论
细胞外基质是细胞重要生存环境,从上世纪60年代开始,研究者就逐渐发现细胞外基质在调节胚胎组织发育和细胞分化方面有重要作用[17]。细胞外基质或细胞外基质中的胶原、粘连蛋白等已用于包被细胞培养板 (瓶)[18]或用于组织工程支架[19],这些基质成分可促进细胞的粘附和生长,甚至可促进细胞的分化。因此,在细胞/组织工程研究中,要充分考虑细胞外基质和细胞外基质成分的作用。
组织工程支架材料,本质上就是细胞外基质材料,细胞外基质是一种复杂的网络状的具有生物活性功能的复合材料。在组织修复方面已得到广泛应用的脱细胞小肠粘膜下层、脱细胞膀胱粘膜下层等脱细胞材料以及脱细胞/蛋白松质骨[20-24],都是细胞外基质材料,人工的支架材料,也必须模拟细胞外基质,才有可能得到更好的应用[24]。Nicholas发现MC3T3-E1细胞ECM可促进胚胎干细胞向成骨细胞分化[25]。Pham等以骨髓细胞诱导的成骨细胞ECM包被三维钛支架,发现该支架可促进骨髓干细胞的成骨分化[26]。可见,细胞外基质在促进细胞生长和分化方面有重要作用,在组织工程支架材料的改进方面,也有积极作用。
本实验制备出原代小鼠心肌成纤维细胞和成骨细胞的ECM包被的两种细胞培养板,通过观测体外二维培养条件下 MC3T3-E1细胞的增殖和分化情况,首次比较这两种ECM的生物活性,为将ECM用于组织工程打下基础。
本实验所制备的两种ECM包被的培养板,均未见任何细胞结构,通过显微观察,可见网络状显微结构,经VG胶原染色表明是胶原纤维,胶原是ECM的主要成分之一,这表明本实验制备的ECM包被培养板是成功的。将MC3T3-E1细胞接种在成纤维细胞ECM包被的培养板中,培养1 d,即检测出细胞的增殖活性明显高于其他组,成骨细胞ECM组的增殖活性也高于对照组;培养3 d后,增殖活性与其他组间的差距更明显,5 d后细胞达到饱和,各组间几乎无差异,这表明ECM可促进细胞的增殖,成纤维细胞ECM的效果可能要优于成骨细胞ECM。另外,成骨细胞ECM中含BMP-2,这是一种重要的成骨诱导因子,可诱导干细胞分化为成骨细胞,导致骨形成[27-28],存在于骨基质中和在体外培养成骨细胞胞外胶原纤维中[23]。这表明本实验制备的成骨细胞ECM可能具有成骨活性。
本实验将MC3T3-E1细胞接种在两种ECM包被的培养板中,通过检测碱性磷酸酶、BMP-2、骨桥蛋白以及钙分泌量,来评价细胞的骨向分化。在成骨细胞ECM培养板中的MC3T3-E1细胞在碱性磷酸酶、BMP-2和钙分泌量方面的指标均明显高于对照组和成纤维细胞ECM组,碱性磷酸酶、骨桥蛋白、骨形成蛋白 2、骨桥蛋白以及钙分泌量均是骨向分化的重要指标,这表明成骨细胞ECM可促进细胞的骨向分化。在成纤维细胞 ECM 培养板中的MC3T3-E1细胞在碱性磷酸酶、BMP-2、骨桥蛋白以及钙分泌量方面的指标与对照组的差别不明显或较小,表明成纤维细胞ECM对细胞骨向分化影响很小。细胞外基质中除含有胶原、蛋白多糖、氨基聚糖外,还含有多种活性蛋白和生长因子,例如成骨细胞ECM中含有骨钙素、骨桥蛋白、骨连接蛋白、骨涎蛋白等[29],这些活性因子可能在促进细胞生长和分化方面起重要作用。在以后的工作中,我们将进一步检测ECM中的活性成分。
在本研究中,包被在培养板上的这两种细胞外基质有不同的生物活性,成纤维细胞的胞外基质可促进MC3T3-E1细胞增殖,但对细胞骨向分化影响不大;成骨细胞的胞外基质含BMP-2,对MC3T3-E1细胞增殖的影响较小,但可促进MC3T3-E1细胞骨向分化。这两种不同的细胞在体外形成的细胞外基质,具有不同的生物活性。成骨细胞在体外形成的ECM适合应用于骨组织和细胞工程,而心肌成纤维细胞在体外形成的 ECM 应该适用于心肌组织和细胞工程,我们将在以后的研究中进一步证实。
REFERENCES
[1] Nelson CM, Tien J. Microstructured extracellular matrices in tissue engineering and development. Curr Opin Biotechnol, 2006, 17(5): 518–523.
[2] Badylak SF, Freytes DO, Gilbert TW. Extracellular matrix as a biological scaffold material: structure and function. Acta Biomater, 2009, 5(1): 1–13.
[3] Han YR. Molecular Cell Biology. 3rd ed. Beijing: Higher Education Press, 2007: 102–121.韩贻仁. 分子细胞生物学. 3版. 北京: 高等教育出版社, 2007: 102–121.
[4] Kleinman HK, Philp D, Hoffman MP. Role of the extracellular matrix in morphogenesis. Curr Opin Biotechnol, 2003, 14(5): 526–532.
[5] Adams JC, Watt FM. Regulation of development and differentiation by the extracellular matrix. Development, 1993, 117(4): 1183–1198.
[6] Badylak SF. Regenerative medicine and developmental biology: the role of the extracellular matrix. Anat Rec B New Anat, 2005, 287(1): 36–41.
[7] Metallo CM, Mohr JC, Detzel CJ, et al. Engineering the stem cell microenvironment. Biotechnol Prog, 2007, 23(1): 18–23.
[8] Zheng JM, Gu HQ. The use and development of the natural extracellusar matrices in tissue engineering and renegerative medicine of urology. Chin J Dialysis Artif Organs, 2003, 14(1): 36–40.郑建明, 顾汉卿. 天然细胞外基质及其在泌尿外科组织工程和再生医学中的应用与发展. 透析与人工器官, 2003, 14(1): 36–40.
[9] Dejana E, Colella S, Languino LR, et al. Fibrinogen induces adhesion, spreading, and microfilament organization of human endothelial cells in vitro. J Cell Biol, 1987,104(5): 1403.
[10] Macarak EJ, Howard PS. Adhesion of endothelial cells to extracellular matrix proteins. J Cell Physiol, 1983, 116(1): 76–86.
[11] Datta N, Holtorf HL, Sikavitsas VI, et al. Effect of bone extracellular matrix synthesized in vitro on the osteoblastic differentiation of marrow stromal cells. Biomaterials, 2005, 26(9): 971–977.
[12] Pham QP, Kasper FK, Baggett LS, et al. The influence of an in vitro generated bone-like extracellular matrix on osteoblastic gene expression of marrow stromal cells. Biomaterials, 2008, 29(18): 2729–2739.
[13] Choi KH, Choi BH, Park SR, et al. The chondrogenic differentiation of mesenchymal stem cells on an extracellular matrix scaffold derived from porcine chondrocytes. Biomaterials, 2010, 31(20): 5355–5365.
[14] Zhang YY, He YJ, Bharadwaj S, et al. Tissue-specific extracellular matrix coatings for the promotion of cell proliferation and maintenance of cell phenotype. Biomaterials, 2009, 30(23/24): 4021–4028.
[15] Guo Y, Zhang XZ, Liu X, et al. Culture in vitro and observation of osteoblasts derived from rabbit calvarial bone. J Lanzhou Univ: Nat Sci, 2002, 38(5): 487–493.郭勇, 张西正, 刘欣等. 兔成骨细胞的体外培养及生物学行为观察. 兰州大学学报: 自然科学版, 2002, 38(5): 487–493.
[16] Shirasuna K, Saka M, Hayashido Y, et al. Extracellular matrix production and degradation by adenoid cystic carcinoma cells: participation of plasminogen activator and its inhibitor in matrix degradation. Cancer Res, 1993, 53(1): 147–152.
[17] Adams JC, Watt FM. Regulation of development and differentiation by the extracellular matrix. Development, 1993, 117(4): 1183–1198.
[18] Lin L, Cai GX, Liu BY. Biological effects of extracellular ground substance on bone marrow mesenchymal stem cells. China J Modern Med, 2005, 15(11): 1644–1646.林琳, 蔡光先, 刘柏炎. 细胞外基质对大鼠骨髓间充质干细胞生物学特性的影响. 中国现代医学杂志, 2005, 15(11): 1644–1646.
[19] Badylak SF. Xenogeneic extracellular matrix as a scaffold for tissue reconstruction. Transpl Immunol, 2004, 12(3/4): 367–377.
[20] Nagahara S, Matsuda T. Cell-substrate and cell-cell interactions differently regulate cytoskeletal and extracellular matrix protein gene expression. J Biomed Mater Res, 1996, 32(4): 677–686.
[21] Spiegel JH, Egan TJ. Porcine small intestine submucosa for soft tissue augmentation. Dermatol Surg, 2004, 30(12): 1486–1490.
[22] Altman AM, Chiu ES, Bai X, et al. Human adipose-derived stem cells adhere to acellular dermal matrix. Aesthet Plast Surg, 2008, 32(4): 698–699.
[23] Merguerian PA, Reddy PP, Barrieras DJ, et al. Acellular bladder matrix allografts in the regeneration of functional bladders: evaluation of large-segment (>24 cm) substitution in a porcine model. BJU Int, 2000, 85(7): 894–898.
[24] Yang ZM. Tissue engineering and experimental surgery. Chin J Exper Surgery, 2002, 19(2): 103–104.杨志明. 组织工程学与实验外科. 中华实验外科杂志, 2002, 19(2): 103–104.
[25] Evans ND, Gentleman E, Chen XY, et al. Extracellular matrix-mediated osteogenic differentiation of murine embryonic stem cells. Biomaterials, 2010, 31(12): 3244–3252.
[26] Pham QP, Kasper FK, Baggett LS, et al. The influence of an in vitro generated bone-like extracellular matrix on osteoblastic gene expression of marrow stromal cells. Biomaterials, 2008, 29(18): 2729–2739.
[27] Suzawa M, Takeuchi Y, Fukumoto S, et al. Extracellular Matrix-Associated bone morphogenetic proteins are essential for differentiation of murine osteoblastic cells in vitro. Endocrinology, 1999, 140(5): 2125–2133.
[28] Granjeiro JM, Oliveira RC, Bustos-Valenzuela JC, et al. Bone morphogenetic proteins: from structure to clinical use. Braz J Med Biol Res, 2005, 38(10): 1463–1473.
[29] Qi J, Yang ZM. The extracellular matrix in bone tissue engineering. Chin J Repar Reconstr Surgery, 2006, 20(1): 61–64.祁洁, 杨志明. 骨组织工程细胞外基质的研究进展. 中国修复重建外科杂志, 2006, 20(1): 61–64.
