降解未处理纤维素厌氧混合菌群的筛选及功能
于艳玲,冯玉杰,高 霏,于丽新,徐 琛
(哈尔滨工业大学市政环境工程学院城市水资源与水环境国家重点实验室,150090哈尔滨,yujief@hit.edu.cn)
包括木材及其加工废弃物、快速生长的各种草类、农作物秸秆及城市垃圾等在内的纤维素类物质是世界上最广泛和廉价的可再生资源[1-3].科学、合理地开发利用这一资源,将是实现可续发展的最有潜力的途径之一.将纤维素降解为小分子物质——糖类或糖代谢中间产物[4],从而利用糖转化平台,使纤维素资源化,如产乙醇[5-6]、产电[7-9]、产氢[10]等,是木质纤维素获得应用的重要途径.但由于木质纤维素的复杂结构,纤维素尤其是不经预处理的纤维素物质很难被微生物降解或降解周期很长.因此,获得高效稳定的原木质纤维素降解微生物,是国内外的研究热点.动物的瘤胃是自然界最高效的发酵罐,瘤胃微生物能在48 h内消化瘤胃内50%的纤维素[11].因此,瘤胃是很好的纤维素降解菌的菌源库.模拟瘤胃条件,驯化瘤胃微生物体外降解纤维素,对于获得效果好的纤维素降解菌或菌群和研究厌氧纤维素降解菌群内的生态作用有着重要意义.
1 试验
1.1 样品来源
取哈尔滨郊区以秸秆为主要饲料的成年牛的牛胃残渣.
1.2 培养条件
筛选培养基:750 mL无机盐溶液,250 mL瘤胃液,L-半胱氨酸盐酸盐1.5 g;刃天青(0.1%,质量分数)1 mL,煮沸并充氮气消氧后,每个培养瓶分装90 mL,秸秆1 g,每瓶有两条1 cm×3 cm的新华滤纸作降解指示物,用作失重率实验时,不加滤纸条,培养基121℃,湿热灭菌20 min.其中,无机盐溶液的成分(750 mL):KH2PO4·2H2O 0.5 g,NaCl 1.0 g,(NH4)2SO40.5 g,CaC12· 2H2O 0.1 g,MgS04·7H2O 0.1 g,K2HPO4· 3H2O 0.5 g.
瘤胃液的制取:牛瘤胃液4层纱布过滤.
秸秆:自然风干当年收成的玉米秸秆,粉碎至2~3 mm.
预处理的秸秆:预处理的方法见文献[12].
1.3 纤维素厌氧降解菌混合菌群的筛选和驯化
取哈尔滨郊区以秸秆为主要饲料的成年牛的瘤胃液与瘤胃残渣悬浊液10 mL接种到90 mL的筛选培养基中,38.5℃恒温静止培养.待培养基中的指示滤纸崩解时,转接于同样的新鲜培养液中,如此转接数代,挑选降解速度快且性能稳定的样品,直至筛选出高效稳定的混合菌群.
1.4 混合菌群纤维素分解特性测定
1.4.1 底物失重率的测定
将1.0 g纤维素类物质作为唯一碳源制作90 mL培养基,接种10 mL菌液,38.5℃静止培养5 d后,5 000 r/min离心,倒出清液,用盐酸和硝酸的混合液冲洗而消除菌体,离心,清水洗,离心,105℃烘干后称重,计算失重量和失重率[13].
1.4.2 纤维素酶酶活测定方法
取0.5 mL酶液,加pH=4.8乙酸-乙酸钠缓冲液1.0 mL,加卷曲的新华1号滤纸(1 cm× 6 cm)一条,于 50℃水浴反应 30 min,加入1.0 mL的DNS溶液,沸水浴5 min,冷却后加入蒸馏水定容至10 mL,在530 nm下测定其吸光度.同时在相同条件下做空白样调零.
酶活力单位的定义为:在pH=4.8、50℃条件下,1 mL酶液每分钟水解滤纸生成1 μg葡萄糖的酶量,称为一个酶活力单位(IU).
1.4.3 混合菌群中菌种的分离纯化
将1.2中所述的培养基中的秸秆和滤纸,换成羧甲基纤维素钠,质量分数为1%,再加入2% (质量分数)的琼脂,厌氧操作制成平板,将富集得到的纤维素厌氧降解菌液采用平板划线分离法获得一系列单个菌落,再挑取单菌落重复以上操作,直至获得纯培养.可作片在显微镜下观察,直至菌株形态相同,编号做好记录.
2 结果与分析
2.1 纤维素厌氧降解菌混合菌群的筛选与驯化
用1.3所介绍的筛选与驯化方法,得到了高效稳定的纤维素厌氧降解混合菌群,命名为FYG -2.FYG-2混合菌群在筛选培养的第2天,降解指示物滤纸条出现透明的蚀斑,5 d后滤纸完全崩解,秸秆底物变成乳浊状,溶液浑浊;以滤纸为唯一碳源时,溶液颜色变浅(图1).在培养过程中,有大量气体生成,说明FYG-2混合菌群中不仅存在纤维素降解菌,还存在产甲烷菌等其他瘤胃菌种[14].培养3 d,FYG-2混合菌群对于灭菌和未灭菌滤纸的分解率分别是45.6%和44.8%,误差小于5%,可以认为FYG-2对灭菌和未灭菌滤纸的降解性能是相同的.

图1 FYG-2混合菌群培养物
经过30代以上的传代培养,FYG-2混合菌群对滤纸分解3 d后,滤纸的失重率基本保持稳定(如图2所示),说明该混合菌群对纤维素的降解性能稳定.FYG-2是一个混菌体系,利用瘤胃中自然存在的微生物之间的协同作用降解纤维素,这样的体系环境适应性和抗干扰能力都要优于纯菌,多次传代以后一般不会出现纯菌中存在的退化现象.

图2 FYG-2的底物失重率与传代次数的关系
2.2 FYG-2混合菌群的纤维素分解特性
2.2.1 对不同纤维素类物质的分解
分别以预处理的秸秆、未处理的秸秆和滤纸为底物,考查了FYG-2混合菌群对不同类型纤维素的分解情况(表1).表1结果表明,38.5℃静止培养3 d后,预处理秸秆的底物失重率最低,仅为12.4%,而未处理的秸秆失重率却达到了36.5%,滤纸条的失重率最高,为45.6%,说明底物降解的难易顺序为滤纸>未处理的秸秆>预处理后的秸秆.滤纸比秸秆易降解与底物的成分组成和结构有关,滤纸是纯纤维素,暴露的表面积大,则纤维素的吸附可及度就大,所以滤纸降解得快,而天然秸秆中的纤维素包埋在木质素和半纤维素中,纤维素降解菌很难吸附到纤维素的表面,致使纤维素降解的难度有所增加.秸秆经过预处理以后,纤维素与木质素产生了剥离,氢键也被打开,纤维素充分暴露出来,但是其失重率却降低了,这可能有两方面的原因:一方面可能是秸秆预处理过程中产生的乙酸、糠醛、小分子酚类等副产物对混合菌群中的某些菌种有毒性作用[15],破坏了菌群微生物之间的协同作用;另一方面,自然界中瘤胃微生物降解的都是未经过预处理的自然形态的纤维素,所以,其协同作用的机制在降解自然形态的木质纤维素时能得到更充分的发挥.
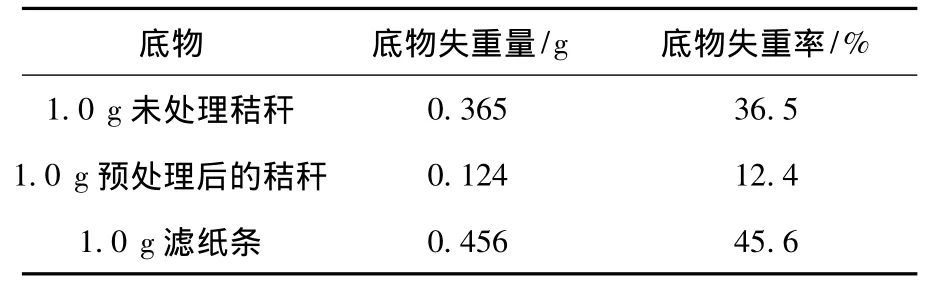
表1 FYG-2混合菌群降解不同纤维素类物质实验
2.2.2 FYG-2混合菌群的酶活与产酶时间的关系
在接菌量为10%,FYG-2混合菌群纤维素酶活随时间的变化如图3所示,在培养的前3天酶活一直处于上升趋势,在第3天时达到最高为126 IU,而在滤纸已经完全崩解的第5天,纤维素酶活却已经降到111 IU,此时发酵液的含糖量却最高达到了50 mg/L.从图3还可以看出,第3天和第4天的酶活保持相对稳定,说明此时混合菌群中纤维素降解菌是优势菌群.所以,做为种子液时,以第3、4天的培养物为宜,而将纤维素的分解产物作为其他用途的底物时,以第5天的培养物为宜.

图3 FYG-2酶活与产酶时间的关系
2.2.3 FYG-2混合菌群纤维素酶活与初始接菌比例之间的关系
在不同初始接菌量时,培养3 d,FYG-2混合菌群的酶活和溶液的葡萄糖质量浓度变化如图4所示.可以看出,FYG-2的酶活和糖化率不与初始接菌量成正比.在初始接菌量为15%时,FYG-2的酶活最高,而当初始接菌量增加到50%时,其酶活降低了一半,但是反应体系中的葡萄糖质量浓度却提高了一倍多.
纤维素酶是一种反馈抑制酶,其酶活受到产物的反馈抑制.当初始接菌量从10%提高到15%,培养液中的含糖量和酶活都在上升,说明接种量增加,产酶量也在增加,而酶解产生的糖质量浓度也不足以产生反馈抑制.但是当初始接种量增加到20%,酶量增加,但是酶解产生的糖质量浓度也在增加,此时的糖质量浓度已经可以对纤维素酶产生很大的反馈抑制作用,所以酶活降低.而接种量在20%~40%是一个产糖和反馈抑制的平衡阶段,酶活和产糖量都不会有太大变化.但是当初始接种量足够大(达到50%),糖化速度会比较快,糖质量浓度会在短时间内快速增加,同时反馈作用也会使酶活迅速降低.因此,可以依据不同的目的,选择初始接种量.

图4 FYG-2酶活与初始接菌比例之间的关系
2.2.4 混合菌群微生物间的协同作用
采用厌氧平板划线分离的方法,从FYG-2中分离到7株纯菌,分别命名为F1、F2、F3、F4、F5、F6、F7.将这7株菌和FYG-2分别单独接入以纤维素为唯一碳源的筛选培养基.接入纯菌的样品,纤维素底物未见明显降解.培养3 d后,分别测定各个菌株和FYG-2的酶活,结果如图5所示.可以看出,各个单菌的纤维素酶活远远小于混合菌群.这表明FYG-2中微生物间存在强烈的协同作用.这种协同作用可能包括纤维素降解菌之间[16]、纤维素降解菌与非纤维素降解菌之间[17]和可培养微生物与不可培养微生物间的协同作用[18].

图5 FYG-2中纯培养微生物与混菌酶活的对比
限于目前的微生物分离技术的局限性,自然环境中可分离培养的微生物种类只占该环境下微生物种类总数的0.1% ~10%[19],不能检测那些尚未能培养的微生物,不能很好地反映自然环境中微生物多样性的原始状态.即便对于可分离培养的微生物,虽然经过多次分离纯化,获得的菌株也存在偶然性.本研究采用以纤维素为唯一碳源的限制性分离方法,获得的菌株均为纤维素降解菌,无法获得非纤维素降解菌和不可培养菌.从现有获得的7株纯菌无论单独还是混合都未得到好的纤维素降解结果来看,混合菌群中的协同作用很可能存在于纤维素降解菌与非纤维素降解菌之间或存在于可培养微生物与不可培养微生物间,因此,很难通过人工分离再复配的方式获得该菌群的功能.关于此混合菌群协同作用的进一步研究,将另作报道.
2.3 FYG-2混合菌群与其他文献中报道的混合菌群的比较
国内外学者已经从不同的筛选源中,采用不同的限制培养方法,构建和筛选出一些具有不同功能的纤维素降解混合菌群,选出几个效果比较好的菌群MC[18]、MC1[20]、WSC-6[21]、PCS-S[22]和本研究筛选出的FYG-2进行了比较(表2).在5个纤维素降解混合菌群中,FYG-2的纤维素酶活最高,水解液中的还原糖质量浓度也最高,这可能与厌氧微生物对糖的代谢速度慢有关.除了MC,FYG-2的滤纸失重量与其他几个菌群不相上下,表明FYG-2对纤维素的降解速度与其他菌群相当.但是FYG-2分解纤维素时的作用温度却是最低的,这有利于FYG-2与其他利用纤维素的分解产物产电、产乙醇等微生物的复配,是FYG-2不可比拟的优势.

表2 各纤维素降解混合菌群的比较
3 结论
1)获得了高效稳定的纤维素厌氧降解混合菌群,命名为FYG-2.该菌群可以在5 d内使1 g的滤纸完全崩解.经过30代以上的传代培养,其降解性能仍保持稳定.且纤维素底物的灭菌与否不影响失重率.
2)FYG-2对不同类型的纤维素底物降解的难易顺序为滤纸>未处理的秸秆>预处理后的秸秆,混合菌群更适合于降解天然木质纤维素.
3)FYG-2混合菌群具有高效且性能稳定的酶活.培养第3天纤维素酶活最高,初始接种量为15%可以获得最高纤维素酶活.
4)FYG-2中微生物间存在强烈的协同作用,这种协同作用很可能存在于纤维素降解菌与非纤维素降解菌之间或存在于可培养微生物与不可培养微生物间.
5)FYG-2对纤维素的分解速度与其他文献报道的混合菌群相当,但是作用温度较低,有利于和其他微生物复配进行纤维素资源化的研究.
[1]RAGAUSKAS A J,WILLIAMS C K,DAVISON B H,et al.The path forward for biofuels and biomaterials[J]. Science,2006,311:484-489.
[2]郭德宪,曹健,鲍宇茹.利用生物技术降解纤维素的研究进展[J].郑州工程学院学报,2001,22(3):84 -85.
[3]COYLE W.The future of biofuels:a global perspective[J].Amber Waves,2007,5:24-29.
[4]WYMAN C E.Potential synergies and challenges in refining cellulosic biomass to fuels,chemicals,and power[J].Biotechnol Prog,2003,19:254-262.
[5]邢启明,孙启忠,高凤芹.木质纤维素类物质生产燃料乙醇的研究进展[J].中国农业科技导报,2008,10 (S1):41-44.
[6]SREENATH H K,JEFFRIES T W.Production of ethanol from wood hydrolyzate by yeasts[J].Bioresource Tech,2000,72:253-260.
[7]RISMANI-YAZDI H,CHRISTY A D,DEHORITY B A,et al.Electricity generation from cellulose by rumen microorganisms in microbial fuel cells[J].Biotechnology and Bioengineering,2007,97(6):1398-1407.
[8]WANG Xin,FENG Yujie,WANG Heming,et al.Bioaugmentation for electricity generation from corn stover biomass using microbial fuel cells[J].Environ Sci Technol,2009,43(15):6088-6093.
[9]REN Zhiyong,WARD T,REGAN J.Electricity production from cellulose in a microbial fuel cell using a defined binary culture[J].Environ Sci Technol,2007,41:4781 -4786.
[10]REN Nanqi,CAO Guangli,WANG Aijie,et al.Dark fermentation of xylose and glucose mix using isolated Thermoanaerobacterium thermosaccharolyticum W16[J].International Journal of Hydrogen Energy,2008,33:6124-6132.
[11]王梦芝,徐爱秋,李世霞,等.瘤胃微生物对纤维素类物质降解的研究[J].饲料工业,2007,28(14):53-57.
[12]李冬梅,冯玉杰,任南琪.纤维素类物质生产燃料酒精的研究进展[C]//第八次全国环境微生物学术研讨会论文集.北京:化学工业出版社,2005:40-47.
[13]UPDEGRAFF D M.Semimicro determination of cellulose in biological materials[J].Analytical Biochemistry,1969,32:420-424.
[14]赵玉华,杨瑞红,王加启.瘤胃微生物甲烷生成的机理与调控[J].微生物学杂志,2005,25(5):68 -73.
[15]PANAGIOTOU G,OLSSON L.Effect of compounds released during pretreatment of wheat straw on microbial growth and enzymatic hydrolysis rates[J].Biotechnol Bioeng,2007,96:250-258.
[16]冯玉杰,李冬梅,任南琪.混合菌群用于纤维素糖化和燃料酒精发酵的试验研究[J].太阳能学报,2007,4:375-379.
[17]KATO S,HARUTA S,CUI Zongjun,et al.Effective cellulose degradation by a mixed-culture system composed of a cellulolytic Clostridium and aerobic noncellulolytic bacteria[J].FEMS Microbiology Ecology,2004,51:133-142.
[18]HARUTA S,CUI Zongjun,HUANG Z,et al.Construction of a stable microbial community with high cellulose -degradation ability[J].Apply Microbiol Biotechnol,2002,59:529-534.
[19]MUYZER G,WALL E C D,UITTERLINDEN A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reactiorr amplified genes coding for 16S rDNA[J].Appl Environ Microbiol,1993,59:695-700.
[20]崔宗均,李美丹,朴哲,等.一组高效稳定纤维素分解菌复合系MC1的筛选及功能[J].环境科学,2002,23(3):36-39.
[21]王伟东,王小芬,高丽娟,等.高效稳定纤维素分解菌复合系WSC-6的筛选及其功能[J].黑龙江八一农垦大学学报,2005,17(3):14-17.
[22]FENG Yujie,YU Yanling,WANG Chengwu,et al.Selection of microbial community with high cellulosedegradation ability and its characteristics[C]//Bioinformatics and Biomedical Engineering ICBBE.Wuhan: ICBBE,2008:4218-4221.

