柱花草总RNA提取方法比较
张倩茜,张伟丽,刘凤民,许修宏,庞丹丹
(1.东北农业大学资源与环境学院,黑龙江 哈尔滨 150030; 2.仲恺农业工程学院生命科学学院,广东 广州 510225; 3.仲恺农业工程学院教学科研基地,广东 广州 510225)
柱花草属(Stylosanthes)植物是热带亚热带地区的优质豆科牧草[1-2],具有茎叶产量高、草品质好、耐旱、耐酸性贫瘠土壤的特点。自20世纪60年代从东南亚国家引入我国后,柱花草被广泛用于青饲料、草粉生产、放牧、水土保持、果园覆盖和绿肥作物等[3]。近年来,随着牧草分子技术的广泛应用,从基因水平研究柱花草(S.guianensis)遗传特性的研究受到了重视。提取完整性好、纯度高的柱花草总RNA,是开展柱花草基因表达调控及抗性分子机制研究的前提。目前植物RNA提取方法有很多种[4-7],常用的提取方法有SDS-酚抽提法、CTAB法和异硫氰酸胍法等,常用的试剂盒主要有Trizol试剂盒等商品化的产品。但没有一种方法是适应所有植物RNA提取的,要根据具体的植物种类和试验条件选择适宜的试验提取方法[8-12]。成熟的柱花草组织富含多糖、酚类化合物及一些尚未确定的次生代谢产物使得RNA提取的产率和纯度受到影响[13]。热研2号柱花草(S.guianensisReyan No.2)是我国亚热带地区的重要柱花草栽培品种,本研究采用改良SDS-酚抽提法、改良CTAB法、Trizol法和柱式植物RNAout试剂盒法等提取热研二号柱花草总RNA,并对总RNA反转录cDNA的看家基因β-actin进行扩增,进而检测提取柱花草总RNA的纯度和质量,旨为后续的柱花草基因表达调控研究奠定基础。
1 材料与方法
1.1材料和试剂
1.1.1材料 试验材料选用热研2号柱花草(S. guianensis cv. Reyan No.2),材料种植在仲恺农业工程学院试验地盆钵中,待植株生长2个月后采集幼嫩叶片提取RNA。
1.1.2试剂和处理方法 RNase Inhibitor、DNaseⅠ、M-MLV反转录酶、Taq DNA聚合酶、D2000 Marker为TaKaRa产品;反转录所用的锚定引物Oligo(dT)18和β-actin基因片段cDNA的特异引物序列特异引物由上海生工有限公司合成,β-actin基因片段的上游引物5′-CAGTGGTCGTACAACTGGTAT-3′,下游引物5′-ATCCTCCAATCCAGACACTGT-3′,扩增的PCR产物为600 bp左右。SDS、CTAB、Tris、PVP、EDTA-Na2、NaCl和NaAc·3H2O等试剂均为国产分析纯。
研钵、药匙、玻璃三角瓶用0.1%焦碳酸二乙酯(DEPC)浸泡24 h后,放入烘箱于180 ℃干热灭菌8 h。移液枪头、离心管等,用0.1% DEPC溶液浸泡24 h,湿热灭菌40 min,然后放入烘箱于65 ℃烘干。电泳槽用0.4 mol/L NaOH浸泡4 h以上,以10 V/cm的电压强度对电泳槽进行电泳灭菌。
1.2总RNA提取方法
1.2.1改良SDS-酚抽提法 1)称取0.1 g柱花草幼嫩叶片,于液氮中研磨成粉末,加入离心管中,立即加入65 ℃预热的提取缓冲液1.5 mL(2% SDS、1.5% PVP、1% NaCl、NaAc-HAc缓冲液)和16 μL β-巯基乙醇于65 ℃水浴20 min。2)取出后加入等体积氯仿充分摇匀,4 ℃ 10 000 r/min离心25 min。3)取上清液加入1/2体积氯仿和1/2体积水饱和酚,充分摇匀8 min后4 ℃ 12 000 r/min离心20 min。4)取上清液加等体积冷异丙醇充分混匀后于-20 ℃静置40 min。5)4 ℃ 12 000 r/min离心15 min后弃上清液,所得沉淀为总核酸样品。6)用186 μL无RNase的ddH2O溶解后加入10×DNaseⅠbuffer 10 μL、40 U/μL的RNase Inhibitor 1 μL、5 U/μL的DNaseⅠ3 μL,于37 ℃水浴40 min。7)加入1/2体积氯仿和1/2体积水饱和酚(4 ℃保存,充分混匀后4 ℃ 12 000 r/min离心13 min(重复此步骤1次)。8)取上清液于新的离心管中,加1/10体积3 mol/L NaAc和两倍体积的无水乙醇混匀后于-20 ℃放置40 min。9)4 ℃ 12 000 r/min离心20 min后弃上清液,用体积分数70%乙醇洗涤沉淀1次,然后将沉淀保存于-80 ℃无水乙醇中。使用时弃掉乙醇,于冰盒上晾干后用50 μL无RNase的ddH2O溶解用于试验。
1.2.2改良CTAB法 (1)取0.1 g柱花草幼嫩叶片,直接置于液氮中迅速充分地研磨成粉末状,装入离心管中,迅速加入1 mL预热的65 ℃的RNA提取缓冲液(100 mmol/L Tris-HCl、2.5 mmol/L EDTA-Na2、2% CTAB、2% PVP、2 mol/L NaCl)和20 μL β-巯基乙醇混匀,于65 ℃水浴30 min。期间每10 min振荡1次,使反应充分。(2)取出,加入等体积的氯仿∶异戊醇(V∶V=24∶1)的混合液,盖上盖子,上下剧烈摇动5 min,混匀。然后于4 ℃ 10 000 r/min,离心15 min。(3)小心吸取上清液至一个新的离心管,重复上述抽提步骤1次。(4)取上清液于新的离心管中,加入1/3体积的8 mol/L LiCl溶液混匀后,于4 ℃冰箱中过夜或-20 ℃放置12 h,以使RNA充分析出、沉淀。(5)4 ℃ 12 000 r/min,离心20 min,弃掉上清液,得到粗提的总RNA沉淀。(6)加入91.5 μL DEPC处理水重新溶解RNA沉淀,加入10×DNaseⅠbuffer 10 μL、40 U/μL的RNase Inhibitor 1 μL、5 U/μL的DNaseⅠ3 μL,于37 ℃反应1 h。(7)取出加入200 μL DEPC处理水后再加入等体积的水饱和酚∶氯仿∶异戊醇(V∶V∶V=25∶24∶1)的混合液,用力摇匀,于4 ℃ 12 000 r/min离心15 min(重复该抽提步骤1次)。(8)取上清液,加入两倍体积预冷(4 ℃)无水乙醇和1/10体积3 mol/L NaAc(pH值5.2),混匀后至于冰箱-20 ℃中40 min后,12 000 r/min离心20 min弃上清液。(9)70%乙醇洗涤沉淀1次,于冰盒上晾干(约15 min),加入50 μL DEPC处理水溶解RNA,保存于-80 ℃备用。
1.2.3Trizol试剂盒法 Trizol试剂盒购于北京拜尔迪生物技术有限公司,操作严格按照试剂盒说明书。
1.2.4柱式植物RNAout试剂盒法 柱式植物RNAout试剂盒购于北京天泽基因工程生物技术有限公司。严格按试剂盒说明进行操作,提取的RNA溶于DEPC水中。
1.3RNA的纯度、浓度与完整性检测 取5 μL提取的RNA样品进行1.5%的琼脂糖凝胶电泳,电泳结束后用凝胶成像系统拍照记录试验结果,以检测RNA的完整性。测定OD230 nm、OD260 nm和OD280 nm,计算OD260 nm/OD280 nm、OD260 nm/OD230 nm以检测RNA的纯度和浓度(μg/mL)。本试验用DU640核酸蛋白测定仪测定所提取RNA样品的OD260 nm和OD280 nm(以无RNase水为空白液调零)。每种方法重复提取3次,分别测定后,取其平均值。根据OD260 nm/OD280 nm、OD260 nm/OD230 nm的比值分析RNA纯度,用公式计算RNA产率(μg/g):
RNA浓度=40×OD260 nm×稀释倍数[14]。
1.4cDNA第一链的合成及看家基因β-actin的扩增 反转录所用的锚定引物Oligo(dT)18,按照TaKaRa公司的M-MLV反转录试剂盒的说明书进行反转录反应,合成柱花草叶片的cDNA第一链。取柱花草叶片cDNA进行PCR,PCR扩增柱花草β-actin基因片段引物(上游引物5′-CAGTGGTCGTACAACTGGTAT-3′,下游引物5′-ATCCTCCAATCCAGACACTGT-3′),cDNA模板经94 ℃变性7 min,按94 ℃ 45 s、55 ℃ 45 s、72 ℃ 45 s程序扩增30个循环,最后72 ℃延伸10 min。以DL2000 Marker作为分子量标记,PCR扩增产物用1.5%琼脂糖凝胶电泳检测。
2 结果
2.1不同方法提取RNA完整性检测 琼脂糖凝胶电泳是检测RNA完整性与质量的重要方法,图1为4种试验方法的检测结果。改良SDS-酚抽提法提取的RNA完整性较好,两条条带清晰可见,并且28S带亮度是18S带的两倍,但是点样孔有少量杂质残留,稍有拖带现象出现。说明该方法提取柱花草RNA杂质去除不彻底。改良CTAB法提取的RNA的28S与18S条带清晰明亮,28S带亮度是18S带的两倍,点样孔无杂质残留,表明提取的总RNA完整性好。Trizol法经多次试验,电泳时RNA样品为粘稠状,结果均未能提取到柱花草叶片的RNA。柱式植物RNAout试剂盒法可以得到完整、高质量的RNA,有两条清晰的条带且无降解。点样孔无杂质残留,28S带亮度是18S带的两倍,且条带丰富、清晰,没有拖尾降解现象,说明得到了质量很好的RNA样品。

图1 柱花草叶片凝胶电泳图谱
2.2不同提取方法RNA纯度、浓度的比较与分析 测定不同方法的RNA样品的OD230 nm和OD260 nm、OD280 nm,改良SDS-酚抽提法、改良CTAB法及柱式植物RNAout试剂盒法所提取柱花草叶片总RNA的OD260 nm/OD280 nm分别为1.74、1.85和1.93;OD260 nm/OD230 nm分别为1.74、2.00和2.04(表1)。结果表明,改良CTAB法及柱式植物RNAout试剂盒法所提取RNA纯度较高,并有效除去了蛋白、多糖、酚类物质,可以用于深入的分子试验。柱式植物RNAout试剂盒法的产率高于改良CTAB法,柱式植物RNAout试剂盒法提取RNA的质量、纯度、产率都好于改良CTAB法。改良SDS-酚抽提法所提取的RNA存在蛋白质、多糖等杂质的污染。OD260 nm/OD280 nm较小,说明有蛋白和酚存在;OD260 nm/OD230 nm小于2.0,表明有小分子或盐存在。
2.3柱花草RNA样品的cDNA合成及质量检测 把柱花草总RNA反转录成cDNA,以此为模板进行PCR扩增β-actin基因片段,进一步检测所提取RNA的质量。电泳结果显示,CTAB法和柱式植物RNAout试剂盒法都得到了长度约为600 bp的带,与预期结果一致(图2)。说明所提取的RNA具有较强的反转录活性。柱式植物RNAout试剂盒法比CTAB法的条带更亮、更清晰,说明柱式植物RNAout试剂盒法所提取的RNA质量更好,能满足更高的实验要求。反转录合成的cDNA进一步说明了改良CTAB法和柱式植物RNAout试剂盒法提取的柱花草总RNA 具有较高的质量, 可用于进一步的分子生物学研究。
3 讨论与结论
研究表明,植物组织或富含酚类化合物,或富含多糖,或含有某些尚无法确定的次级代谢产物,导致未能有效地分离纯化其组织中的RNA[15]。多糖的许多理化性质与RNA很相似,因此很难将它们分开。在去除多糖的同时RNA也被去除,造成RNA产量的减少;而在沉淀RNA时,也产生多糖的凝胶状沉淀,这种含有多糖的RNA沉淀难溶于水,或溶解后产生粘稠状的溶液。由于多糖可以抑制许多酶的活性,因此污染了多糖的RNA样品无法用于进一步的分子生物学研究[16]。在植物材料匀浆时,酚类物质会释放出来,氧化后使匀浆液变为褐色,并随氧化程度的增加而加深,这一现象被称为褐化效应[17]。被氧化的酚类化合物(如醌类)能与RNA稳定地结合,从而影响RNA的分离纯化[15]。
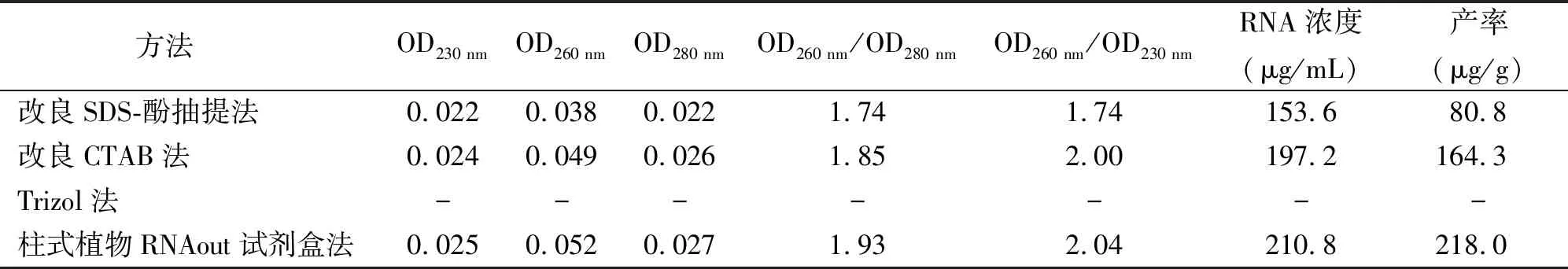
表1 不同提取方法提取的柱花草叶片总RNA的纯度与产率
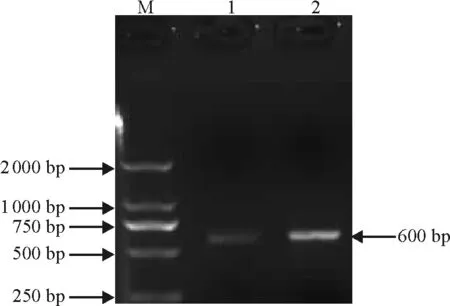
图2 RT-TCR扩增产物电泳检测
成熟的柱花草材料中富含多糖和酚类化合物,干扰了完整RNA的提取。因此提取高质量柱花草总RNA必须要在除糖和除酚这两个关键步骤上进行良好的操作。本研究中改良的CTAB法从柱花草叶片中提取了质量较好的总RNA,得到的RNA能够进行反转录并顺利扩增出看家基因,可以用于后续的分子生物学试验。CTAB法是常用的植物RNA提取方法,CTAB阳离子的去污能力可有效地将多糖除去,并且能使RNA有效地留在水相中。本研究中进行部分改良,通过使用LiCl沉淀剂选择性沉淀RNA,因为LiCl沉淀剂可将干扰物质留在上清液中[18-19],使RNA与多糖有效分离[20]。本研究中为了应对反复抽提过程中RNA产率降低的缺点,采用LiCl沉淀RNA 12 h的方法,可以有效去除柱花草中的多糖。裂解液中PVP和少量的β-巯基乙醇的加入作为强还原剂可以防止酚类物质的氧化;另外在改良CTAB中的高盐缓冲液有助于柱花草叶片中多糖的去除。
用柱式植物RNAout试剂盒法提取柱花草的RNA效果非常好,条带清晰,纯度高,提取产率高。柱式植物RNAout试剂盒法的效果好于改良的CTAB法,但两种方法提取的RNA均能成功的反转录并都扩增出看家基因。改良的CTAB法经济实惠,成本低。比较之下,柱式植物RNAout试剂盒法成本较高,但提取时间快,对于短时间内须提取大量材料RNA的试验非常适合。这两种方法可根据课题实际情况应用到后续的分子试验研究。
Trizol试剂盒是市场上常见的试剂盒之一,本研究中TrizoL试剂法没有提取到RNA,发现在异丙醇沉淀核酸时,下层液体中有一小团粘稠透明不溶物或者是褐色物不溶物与RNA难以分离,这说明异丙醇沉淀RNA时导致了多糖、多酚物质的共沉淀作用[21]。表明TrizoL试剂法不适合柱花草RNA的提取,这是因为Trizol的主要成份是异硫氰酸胍和苯酚,没有特殊去除多糖和多酚的试剂,所以对于大多数多糖、多酚的植物无法成功提取。改良SDS-酚抽提法是常规的RNA提取方法,通过SDS处理可以去除部分多糖,在高浓度Na+或K+离子存在条件下,通过苯酚、氯仿抽提可以除去一些多糖[16],但即使通过这些步骤仍会发现有相当多的多糖与RNA混杂在一起,提取RNA效果不好,提取量少,杂质去除不彻底,试验过程耗时长,不适合含糖量较大的柱花草样品的RNA提取。
本研究通过比较几种柱花草RNA的提取方法,建立了可以获得高质量RNA的试验方法(改良CTAB法与柱式植物RNAout试剂盒法),为后续柱花草分子生物学研究奠定了基础。
[1]刘凤民,张伟丽,余土元,等.锌贝克、崇高和易斑净对柱花草炭疽病的防效[J].草业科学,2009,26(8):152-157.
[2]王小华,庄南生,王英,等.DES诱变与离体培养结合筛选柱花草抗寒突变体的研究[J].草业学报,2010,19(1):263-267.
[3]蒋昌顺.我国对柱花草属不同种的研究与利用[J].热带农业科学,1995(3):64-70.
[4]郝福玲,刘雅莉,王跃进.百合花瓣总RNA提取方法的研究[J].西北植物学报,2005,25(6):1143-1147.
[5]李志强,李莹,陶建敏,等.几种果实不同组织总RNA提取及质量分析[J].果树学报,2008,25(5):764-768.
[6]郭翠英,王跃进,刘雅丽,等.富含多糖葡萄风信子花瓣总RNA提取方法研究[J].西北农业学报,2007,16(3):188-191.
[7]陈昆松,徐昌杰,张上隆.富含多糖猕猴桃果实组织中总RNA提取方法的改进[J].植物生理学通讯,1998,34(5):371-373.
[8]程水源,陈昆松,杜何为,等.银杏RNA的提取[J].果树学报,2005,22(4):428-429.
[9]徐昌杰,陈昆松,张波,等.柑橘组织RNA提取方法研究[J].果树学报,2004,21(2):136-140.
[10]张玉进,孟祥春,潘瑞炽,等.非洲菊花瓣总RNA提取方法的改进[J].植物学通报,2001,18(6):722-726.
[11]李宏,王新力,彭学贤,等.香蕉不同组织中总RNA的有效分离[J].植物生理学通讯,1999,35(5):384-388.
[12]王曼玲,朱虹琳,周明全,等.莲藕组织总RNA的快速提取方法[J].武汉植物学研究,2005,23(5):475-477.
[13]申建斌,田维敏,蒋昌顺.柱花草叶片组织总RNA提取方法[J].热带农业科学,2007,27(3):13-14.
[14]Wang D H,Wang B C,Li B,etal.Extraction of total RNA from Chrysanthemum containing high levels of phenolic and carbohydrates[J].Colloids and Surfaces B:Biointerfaces,2004,36(2):111-114.
[15]李宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通讯,1999(1):36-39.
[16]Fang G,Hammar S,Grumet R.A quick and inexpensive method for removing polysaccharides from plant genomic DNA[J].Biotechniques,1992,13:52-56.
[17]Su X,Gibor A.A method for RNA isolation from marine macroalgae[J].Analytical Biochemistry,1988,174:650-657.
[18]张宇,唐志鹏,邓海燕,等.富含多糖多酚芒果果肉组织总RNA的提取[J].湖南农业大学学报(自然科学版),2009,35(6):637-639.
[19]Salzman R A,Fujita T,Salzman K Z,etal.An improved RNA isolation method for plant tissues containing high levels of phenolic compounds or carbohydrates[J].Plant Molecular Biology Reporter,1999,17:11-17.
[20]樊洪泓,李廷春,林毅,等.石斛总RNA提取方法的研究[J].激光生物学报,2007,16(2):105-108.
[21]Manning K.Isolation of nucleic acids from plants by differential solvent precipitation[J].Analytical Biochemistry,1991,195:45-50.

