静电纺丝新技术及其在生物医药领域的应用
陈思原 孔梅梅 王淑芳* 孔德领 顾忠伟
1(南开大学生命科学学院生物活性材料教育部重点实验室,天津 300071)
2(四川大学国家生物医学材料工程技术研究中心,成都 610064))
引言
近年来,利用静电力来制造纤维的静电纺丝(简称“电纺”)技术在材料开发、装置改进和方法创新等方面都取得了较大进展。电纺新技术的出现,使人们可以根据实际应用的需要,设计和制造具有不同形态、结构和性能的纤维以及多孔支架材料,电纺产品在组织工程和药物传输等领域中的应用价值也因此变得越来越大。本研究介绍几种电纺纤维结构调控的新技术及其应用,并对电纺技术的未来发展方向进行展望。
1 电纺纤维结构调控新技术
采用传统的静电纺丝方法,通常得到表面及内部结构均一、随机排列的纳米纤维,这种普通的纤维往往不能满足实际应用的要求。例如,用于组织重建的纤维支架应能诱导细胞的极性生长和分化,这时纤维的取向性就非常重要;又如,在药物传输中,有时需要将药物包埋在纤维的内部,以实现药物的缓释,保持药物的活性和稳定性。为了解决组织工程和药物传输等领域中需求多样化的问题,电纺纤维的形态和结构需要相应的特殊设计和调控。目前,已有研究对传统电纺技术进行了各种优化,也出现了很多新的电纺技术和设备,可以制备出具有芯-鞘、中空、多孔、串珠和取向等不同形态结构的纳米纤维。
1.1 芯-鞘结构纤维制备技术
所谓芯-鞘结构纤维,是指纤维由同轴的芯质和鞘层组成,而芯质和鞘层通常采用不同的材料。这种结构的纤维特别适用于药物传输,鞘层材料可以很好地保护芯质中的药物或其他生物分子乃至细胞的活性和稳定性,同时也有利于实现药物的缓释,因此正在越来越广泛地应用于生物医药领域。
得到芯-鞘结构纤维的主要方法是同轴共纺和乳液电纺。同轴共纺是使用两个毛细管组成同轴喷嘴,在内层的毛细管中,充有将形成芯质的液体;在两个毛细管的间隙中,充满外层液体,以形成鞘层。两层液体喷出时为同轴分流层,最终形成芯-鞘结构。Klein等利用同轴共纺,制得了含有活性细菌的纤维。他们以聚己内酯(PCL)和聚乙二醇(PEG)的混合溶液为鞘、以假单胞菌和聚环氧乙烷(PEO)的水溶液为芯进行共纺[1]。所得纤维芯质中的细胞保持了磷酸酶和β-半乳糖苷酶活性,并具有反硝化功能,能对环境刺激产生响应。本实验室采用同轴共纺技术[2],制备出以 PCL或明胶为鞘、以负载一氧化氮(NO)供体的PCL为芯的纤维,结果显示纤维的芯质和鞘层间有明显界线,内层溶液流速不稳定可能造成芯质直径的变化(如图1所示)。

图1 PCL/PCL-NO供体纤维的芯鞘结构(TEM照片)[2]Fig.1 TEM image of the core-shell structured PCL/PCL-NO donor fiber[2]
乳液电纺,是先将溶解有不同材料的水和油两相制成稳定、均一的油包水(W/O)或水包油(O/W)乳液,再将得到的乳液进行电纺。这种方法不需要共溶剂,而且可以利用乳液液滴悬浮的特点,将水溶性药物和蛋白质等包埋到电纺纤维中,实现药物控释。Li等以十二烷基硫酸钠(SDS)为乳化剂,将亲水性药物蛋白酶K的水溶液滴入疏水性聚合物乙二醇/乳酸嵌段共聚物(PELA)的氯仿溶液中,形成油包水体系,并进行电纺,所得纤维如图2所示[3]。纤维的鞘层是纯 PELA基质,芯质是分散有蛋白酶K的PELA基质,其中的蛋白酶具有一定的生物学活性。Dai等通过乳液电纺的方法,将漆酶作为芯质成分包埋入聚乳酸(PLA)纤维中,并发现纤维具有多孔表面,这种形态对于保持其中漆酶的活性和稳定性非常有利[4]。

图2 蛋白酶 K/PELA芯-鞘结构纤维的形态[3]Fig.2 Morphology of electrospun fibers of proteinase K/PELA[3]
此外,也有研究报道称,可通过其他技术来制备芯-鞘结构纤维。Zhang等利用相分离的原理,以乙酸作为共溶剂,将PEO和壳聚糖混溶于去离子水中,进行静电纺丝,得到了PEO为芯、壳聚糖为鞘的纳米纤维,并且通过改变 PEO和壳聚糖的混合比例、壳聚糖的分子量以及纺丝的温度等条件,实现了纤维结构的调控[5]。这种方法采用普通电纺装置,不需要使用同轴喷嘴,是一种新的制备芯-鞘结构纤维的方法。
1.2 中空结构纤维制备技术
同轴共纺也是制备中空纤维的一种技术[6-7]。如图3所示,同轴喷嘴的外层流出聚合物溶液,内部毛细管流出与外层溶液不相溶或者难相溶的液体,如矿物油、橄榄油或甘油等;电纺得到芯-鞘结构纤维后,除去芯质物质,得到中空纤维。所以,这种方法实际上是芯-鞘结构纤维制备技术的延伸。在制备过程中,纤维的鞘层要具有一定的力学强度,以确保在除去芯质物质时保持较好的形态。
Li等利用同轴共纺技术,电纺得到重矿物油为芯、TiO2和聚乙烯吡咯烷酮(PVP)为鞘的纤维;然后用辛烷提取除去重矿物油,得到中空纤维,纤维直径和管壁厚度可以通过一系列工艺参数加以调控(见图4)[6]。Loscertales等将电纺技术和凝胶化学结合,使用橄榄油和甘油作为内层溶液,鞘层成分在纤维断裂之前发生凝胶化,而内层溶液在收集器上蒸发,形成中空纤维[7]。

图3 同轴共纺装置[6]Fig. 3 Schematic illustration of the coaxial electrospinning setup

图4 TiO2/PVP纳米管状纤维(电镜照片)。(a)TEM;(b)SEM[6]Fig.4 Images of TiO2/PVP tube.(a)TEM;(b)SEM[6]
相分离原理可以形成芯-鞘结构的纤维,因此可以进一步设想,使用易于逸出或除去的物质作为芯质材料,就能够得到中空纤维。Liu等设计了在高压CO2环境下进行电纺的装置,使用PVP和聚偏氟乙烯(PVDF)进行电纺,得到了具有中空或开放孔洞结构的纤维[8]。他们认为,这种结构的形成是由于高压的 CO2环境使溶剂的挥发受到抑制,同时CO2向纤维中渗透,纤维外层迅速形成后,内部发生相分离,产生CO2空泡,这些空泡逐渐聚集,形成开放孔洞或者中空的结构。
1.3 多孔结构纤维制备技术
利用电纺技术制得无纺纤维材料,一个显著的优点是它具有很大的比表面积。通过各种技术,使电纺纤维具有多孔表面,可以进一步增大纤维的表面积。这种结构的纤维和纤维支架适用于纤维与周围环境需要进行充分接触和反应的场合,如某些药物的释放及催化剂和传感器等领域。
目前,制备多孔结构纤维的方法主要是混纺与溶解结合。先将两种材料进行混纺,再用某种溶剂溶解除去其中一种高分子,从而在纤维上形成孔或者其他复杂的几何形状。在文献报道中,既有用水或水溶液除去水溶性的物质,也有用氯仿等除去脂溶性的物质。例如:Zhang等将明胶和PCL在三氟乙酸中进行混纺,然后通过浸出法用PBS缓冲液去除水溶性的明胶,得到含有明显沟槽的纳米纤维[9](见图5);Li等将聚乙烯醇(PVA)与壳聚糖共混的纳米纤维用碱溶液去除 PVA,以制备多孔纤维[10];Greiner等对PLA/PEO进行电纺,然后将其溶于水,除去PEO,得到了表面多孔的 PLA纤维[11];You等将聚丙交酯(PGA)与 L-聚乳酸(PLLA)溶解在六氟丙烯中电纺,用氯仿除去后者,得到了具有三维连通孔洞的纤维[12]。

图5 PCL/明胶混纺纤维的形态。(a)PCL/明胶电纺纤维;(b)使用浸出法去除明胶后纤维的形貌[9]Fig.5 Morphology of PCL/gelatin electrospun fibers.(a)PCL/gelatin nanofibers;(b)After extraction with buffer to remove gelatin[9]
先通过交联使一种材料不溶,然后除去另外一种成分,也可以制得具有多孔结构的纤维。Gupta等用路易斯酸对GaCl3和尼龙-6络合,将得到的络合物进行电纺,再将纳米纤维浸入水中24 h,去除GaCl3,得到多孔的尼龙-6 纤维[13]。
此外,在特定条件下对单一材料进行电纺,也可以得到多孔纤维。Casper等以四氢呋喃(THF)为溶剂,在湿度超过30%时对聚碳酸酯(PC)进行电纺,发现获得的纤维表面具有很多微孔,并且孔密度随湿度增大而增加[14]。Bognitzki等以二氯甲烷为溶剂,分别对PLLA、PC和聚乙烯咔唑(PVK)进行电纺,结果发现所得纤维呈现多孔结构,图6所示为PLLA纤维的形态[15]。他们认为,这种具有规律的表面形貌是由电纺过程中的快速相分离过程造成的,富含溶剂的区域会形成孔洞。

图6 PLLA纳米多孔纤维的SEM照片[15]Fig.6 SEM photographs of PLLA nanofibers[15]
1.4 串珠状结构纤维制备技术
在电纺过程中,很多参数都会影响所得纤维的形态和结构。通过改变材料分子量、溶液黏度、溶液表面张力、电纺电压、接收距离,以及加入某些物质等方法,可以得到具有串珠状结构的纤维,一般较低的分子量和黏度、较小的接收距离以及过低或过高的电压容易产生串珠状结构。在通常情况下,串珠状纤维被认为是“失败”的电纺产物,但它在某些特定领域有独特的应用价值,其特有的串珠部分可以用于装载药物或其他物质,因此近年来对它的关注也逐渐增多。
Qi等人通过乳液电纺,得到了含有串珠状结构的纤维。首先将海藻酸盐和牛血清白蛋白(BSA)的混合水溶液滴入二氯甲烷中并搅拌形成混合物,再加入Ca2+使海藻酸盐交联,形成包裹有BSA的海藻酸钙颗粒,然后将PLLA溶解在该W/O乳液中进行电纺[16]。所得纤维具有类似串珠的结构,但当电压增大时纤维整体形态发生变化,串珠结构变为纺锤形结构。此外,他们还将 PVA溶解在聚苯乙烯(PS)的O/W乳液中进行电纺,也得到了具有明显串珠结构的纤维,如图7所示。
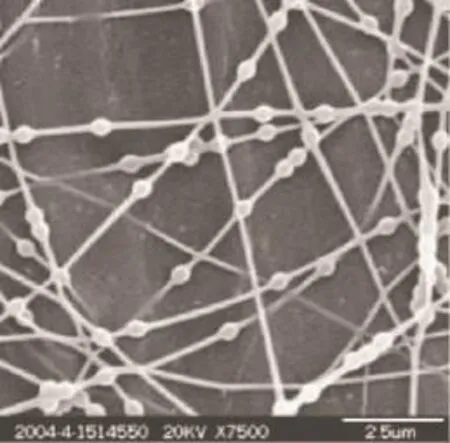
图7 乳液电纺PVA得到的串珠状纤维结构SEM照片[16]Fig.7 SEM micrograph of emulsion electrospun fibers[16]
Zhan等将浓度为4%和20%两种PS溶液进行对纺,得到具有复合性能的PS膜。其中,20%的PS溶液形成微米级纤维,为纤维膜提供了很好的力学强度;而4%的PS溶液形成串珠结构纤维,具有超疏水性[17]。他们认为,纤维在盘绕的过程中伸展速度不够快,因此存在 Rayleigh不稳定性(Rayleigh instability),从而形成串珠。他们还发现,串珠的形成取决于溶液表面的张力、黏度以及导电性,随着PS溶液浓度的增大,纤维上串珠的密度降低。
1.5 取向结构纤维制备技术
在通常情况下,纤维在收集器表面沉积形成的是随机排列的形态。近年来,取向结构纤维的制备已经成为电纺技术研究中的热点,因为纤维的取向性不仅对纤维支架自身的机械性能有很大影响,也对组织修复时细胞的黏附、生长、增殖和分化有很大影响。取向结构纤维制备的关键在于纤维的收集,主要方法是对收集器进行改进,如采用旋转收集器或特殊形状的收集器。此外,在收集器附近添加额外磁场或电场,也可以得到取向性良好的纤维。
最早出现和最简单的获得取向纤维的方法是对纤维收集器进行改进,这也是目前制备取向纤维的主要方法。同时,收集器的形态、旋转等性能对纤维和支架形态结构的影响也是研究的热点之一。Edwards等采用旋转收集器收集电纺 PCL纤维,得到取向性良好的纤维,并发现在某一转速阈值以上,随着转速的增加,纤维的平均直径下降[18]。Secasanu等使用两个并排的尖头电极作为收集装置来制备取向纤维,他们认为电极的尖端可以影响电场的分布(电场线的方向和密度)[19]。实验结果证明,与平头的电极相比,这种装置能够得到更多的取向纤维。Liao等设计了“离心电纺”的装置,将离心场和电场结合,使聚合物溶液从一个环形收集器的圆心喷出,并通过电机使喷嘴以一定的速度旋转,使纤维沉积在圆环的内壁,得到取向性良好的纤维[20]。
Zhang等利用不同的收集器得到了具有不同取向和微图案的纤维,如图8所示。这种纤维具有平行结构或方格形图案,通过改变收集器的形状可以得到所需要的纤维结构[21]。纤维的沉积、排列以及微图案的形成取决于静电力,而不同有序排列的微图案在组织工程中会影响细胞的活性,因此有必要通过调整电压、流速以及溶剂体积比来控制纤维结构的有序度。当电压加大或流速加大时,PCL或PLA纤维的微图案化有序度下降;当溶剂体积比(二甲基甲酰胺(DMF)/THF)变小时,有序度下降(见图9)。

图9 电纺条件对微图案化纤维结构的影响。(a)电压的影响;(b)流速的影响(FD,流速);(c)溶剂体积比的影响(D,DMF;T,THF)(标记尺寸:100 μm)[21]Fig.9 Influence of electrospinning parameters on fibers morphology.(a)influence of voltage on patterned architectures;(b)influence of feeding rate on patterned architectures(FD,feeding rate);(c)influence of volume ratio of solvents on patterned architectures(VR,volume ratio;D,DMF;T,THF)(scale bar:100 μm)[21]
在电纺的收集区域内,添加额外的电场或磁场,可以对电纺纤维的取向产生一定的影响。Kakade等对PEO进行电纺,用两个带电铝板诱导取向,得到宏观上取向性良好的纤维,并使聚合物链平行于纤维轴[22]。Yang等对 PVA进行了磁性电纺,在PVA纤维中加入了磁性纳米颗粒,在收集器前添加了磁场,从而制得了高度有序的平行纤维毡(如图10所示),并进一步得到了不同角度的平行四边形网格结构,但纤维中掺杂的磁性纳米颗粒在实际应用中的影响还有待检验[23]。
2 电纺新技术的应用
2.1 组织工程
利用电纺技术可以制得仿生性优良的支架材料。这种材料与传统材料的重要区别在于它是由超细纤维构成的,其仿生性能主要体现在纤维尺度和支架孔隙两个方面。电纺纤维的尺度可以控制在微米到纳米级,接近于天然细胞外基质中的纤维。另外,支架材料的孔隙率和孔径等也可以通过制备过程中的一系列加工参数加以调控,开放性的孔洞结构和高的孔隙率有利于细胞的植入和培养、组织的生长以及营养物质和代谢产物的流通。因此,电纺支架可以在体内为细胞提供良好的黏附、生长条件,可以应用于血管、骨、肌肉、神经、韧带和肝脏等组织的修复和重建。随着电纺技术的进步,具有降 解可控性、取向性和生物活性的纤维逐步应用于组织工程中。通过新的电纺技术,使材料降解速率与组织再生速率同步,利用材料的取向性,对细胞的黏附、生长、增殖和分化及合成分泌等活性进行诱导和促进,并在材料上负载生物活性物质,以提高材料的生物相容性和生物反应性,已成为组织工程领域研究的热点。

图10 磁性电纺得到的取向纤维和平行四边形网格纤维。(a)不同放大倍数下的取向纤维;(c)(d)不同角度的平行四边形网格纤维[23]Fig.10 Scanning electron microscopy(SEM)images of the aligned fibers.(a)~(b)aligned fibers at different scales;(c)parallelogrammic fibers with different angles[23]
目前,静电纺丝已成为小口径血管组织工程中的一种极具发展潜力的技术。小口径血管移植物失败的一个主要原因是血小板在移植物表面黏附,进而造成血栓。本实验室采用同轴共纺技术[2],以PCL或明胶为鞘,以负载一氧化氮(NO)供体的PCL为芯,制备出了具有芯-鞘结构的纤维,用于小孔径人工血管的构建。此方法制成的芯-鞘结构纤维多孔材料具有控制释放NO的性能,能够抑制血小板的黏附、聚集及其活性,并可防止NO供体滤出而产生细胞毒性,因此是提高人工血管材料的抗凝血性和生物相容性的有效方法。
电纺技术在骨组织工程的研究中也有很大的应用价值。Asran等对 PVA/胶原/羟基磷灰石(HAp)进行电纺,制备了含有串珠状结构的纳米纤维(如图11所示),并且纤维取向性良好,这种支架模拟了骨材料的层次结构和矿物组成,具有高生物活性,在骨支架方面有广泛的应用前景[24]。Fu等使用乳液电纺的方法,将乳酸/羟基乙酸共聚物(PLGA)的有机溶液和骨形成蛋白-2(BMP-2)与HAp的水溶液进行电纺,将 BMP-2包埋入 PLGA/HAp复合基质中形成纤维支架[25]。HAp纳米颗粒在PLGA基质中均匀分布,支架显示出很好的形态和机械强度,并且细胞的黏附良好,从复合支架中释放出的BMP-2能够保持其活性,在体内促进新骨的形成和骨缺损修复。这种支架可以实现BMP-2的缓释,释放时间在2~8周,而增加HAp的含量可以加快其释放。

图11 PVA/Col-Hap纤维的背面散射SEM[24]Fig.11 Back scatteringSEM micrograph for aligned electrospun PVA/Col/n-HAp[24]
此外,电纺技术也可以应用在其他组织的构建和修复当中。Choi等将PCL和胶原进行混纺,得到纳米纤维支架,并在其上种植了人骨骼肌细胞[26]。结果显示,单一取向的纤维可以明显地诱导骨骼肌细胞的取向和肌管的形成,说明这种取向性的纳米纤维支架可以作为大片肌肉损伤患者的功能化肌肉组织移植物。Yang等考察了在体外条件下,PLLA纤维的取向和尺寸对神经干细胞(NSC)的形态、分化和轴突生长的影响[27]。在取向纤维上,NSC的取向与纤维平行,轴突定向生长,而在随机排列的纤维上培养的NSC没有显示出定向生长。另外,NSC分化速率在纳米纤维上比微米纤维上更高,与纤维定向无关。由此可见,取向排列的纳米纤维支架是神经组织工程中的理想材料。Lee等发现,人韧带成纤维细胞在植入取向纳米纤维后,合成的胶原量大大多于随机排列的纳米纤维[28]。可见,在韧带修复中,取向纤维支架不仅能增加细胞黏附,还能增强细胞的活性。Feng等研究了兔的肝细胞在I型胶原涂层的PLA取向纳米纤维上的聚集情况[29]。在3 d的时间里,超过80%的细胞在其上聚集,与随机排列的纤维相比有更好的聚集性,并且肝细胞的功能保持得更好。这种取向纤维在肝组织工程的研究和疾病的治疗方面有很好的应用前景。
2.2 药物传输
近年来,将电纺材料用于构建药物控释系统的研究很多,电纺纤维可以通过涂敷、包埋等方法携带抗生素、抗癌药等药物以及蛋白质和DNA等生物制剂,活细胞也可以通过电纺的方法包埋入纤维中。此外,电纺纤维具有比表面积大、载药量高、药物释放可控等优点,在药物传输中有良好的应用前景。
Huang等应用同轴共纺技术制得具有芯-鞘结构的纳米纤维。他们以乙酰螺旋霉素片剂和明胶蛋白质为芯、以PCL为鞘,将药物包覆在壁厚小于100 nm的超细纤维中。在实验范围内,纤维膜的力学性能随芯质内溶质含量的提高而降低[30]。这种纤维可用作体内手术伤口缝合线,或用于大面积创伤(如烧伤)伤口的敷料。
Xie等使用电纺PLGA纤维毡来包埋抗癌药物紫杉醇,包埋效率超过90%[31]。体外细胞毒性试验显示,在72 h后,多达70%的C6神经胶质瘤细胞被杀死。他们还通过电纺的方法[32],制得了抗癌药顺铂的缓释制剂 PLLA/PLGA复合胶束,这种胶束由于具有芯-鞘结构而减少了突释量。Xu等将水溶性抗癌药盐酸阿霉素(Dox)的水溶液与PEG-PLLA嵌段共聚物的氯仿溶液进行乳液电纺,利用药物与PEG的亲和性,得到包裹有药物的纤维[33]。乳液电纺可以减少药物的初期突释,并保持药物的化学结构,在体外MTT实验中,纤维释放出的 Dox的抗肿瘤效果与普通Dox相当。
Jiang等使用同轴共纺设备,制得了以 PCL为鞘、以含葡聚糖的 BSA为芯的生物可降解芯-鞘结构纤维[34]。他们发现,内层溶液流速高时 BSA装载较多,释放速率较快,而外壳中加入PEG可进一步控制释放速率,增加BSA的释放。通过改变内层溶液的流速和外壳中PEG含量,可以将释放周期控制在1周~1个月左右。Jiang等以含有BSA或溶菌酶的PEG为芯、以PCL为鞘,制得了芯-鞘结构纤维,然后考察了这两种模型蛋白的释放和活性[35]。结果显示,第一天存在轻微的突释现象,随后进入相对稳定的释放期,另外,包裹在纤维中的溶菌酶保持了其一级和二级结构,具有较好的催化活性。
Saraf将同轴共纺应用于调控非病毒基因的传递等[36]。他们以 PEG为芯并加入质粒 DNA,以PCL为鞘并加入非病毒基因载体r-PEI-HA,然后进行同轴共纺,发现非病毒基因载体r-PEI-HA的释放取决于它本身的浓度和质粒DNA的浓度,并且发现这种基因传递载体的释放时间延长到60 d,质粒DNA的转染也持续了60 d,转染效率与PEG的分子量有关。
3 结论及展望
近年来,静电纺丝作为一种在组织工程和药物传输等领域中具有普遍应用的聚合物加工技术,受到了人们的关注。电纺技术的优点表现在:操作简便,可加工材料种类多,纤维特性可控,应用广泛。近年来各种新技术和新装置的出现,使得人们可以获得具有不同结构(芯-鞘、中空、多孔、串珠和取向等)和性能的纤维及多孔支架材料。未来电纺技术的发展仍然在于对已有技术进行改进,进而获得更能满足生物医药和其他领域需要的纤维材料。首先,应进一步研究各种不同电纺技术中特殊结构纤维形成的机制,进而改进和优化电纺条件,对纤维的特殊精细结构进行调控;其次,有必要加强电纺材料的功能化,如通过生物活性物质的包埋,使支架材料具有更好的体内反应性,并制备具有特殊理化性质的多功能材料;再次,还应将电纺技术与具体应用结合,着重考察电纺材料在实际使用中的优势和缺点(如组织工程支架植入体内的反应性),以不断改进电纺及其应用技术;另外,还可以将电纺技术与其他技术结合,扩展其应用范围(如本实验室正在进行将电纺与自组装结合以制备组织工程血管支架的研究)。静电纺丝技术作为一种制备超细纤维和多孔材料的先进手段,必将在生物医药和化学化工等领域得到更广泛的应用,并取得快速发展。
[1]Klein S,Kuhn J,Avrahami R,et al.Encapsulation of bacterial cells in electrospun microtubes[J].Biomacromolecules,2009,10(7):1751-1756.
[2]Zhang Lei,Wang Kai,Zhao Qiang,et al.Core-shell fibrous vascular grafts with the nitric oxide releasing property[J].Science China-Chemistry,2010,53(3):528-534.
[3]Li Xiaoran,Zhang Hong,Li Hua,et al.Encapsulation of proteinase k in PELA ultrafine fibers by emulsion electrospinning:Preparation and in vitro evaluation[J].Colloid Polym Sci,2010,288(10-11):1113-1119.
[4]Dai Yurong,Niu Junfeng,Liu Jia,et al.In situ encapsulation of laccase in microfibers by emulsion electrospinning:Preparation,characterization,and application[J].Bioresour Technol,2010,101(23):8942 -8947.
[5]Zhang Jianfeng,Yang Dongzhi,Xu Fei,et al.Electrospun core-shell structure nanofibers from homogeneous solution of poly(ethylene oxide)/chitosan[J].Macromolecules,2009,42(14):5278-5284.
[6]Li Dan,and Xia Younan.Direct fabrication of composite and ceramic hollow nanofibers by electrospinning[J].Nano Lett,2004,4(5):933-938.
[7]Loscertales IG,Barrero A,Marquez M,et al.Electrically forced coaxial nanojets for one-step hollow nanofiber design[J].J Am Chem Soc,2004,126(17):5376-5377.
[8]Liu Jun,Shen Zhihao,Lee SH,et al.Electrospinning in compressed carbon dioxide:Hollow or open-cell fiber formation with a single nozzle configuration[J].J Supercrit Fluids,2010,53(1-3):142-150.
[9]Zhang YZ,Feng Y,Huang ZM,et al.Fabrication of porous electrospun nanofibres[J].Nanotechnology,2006,17(3):901-908.
[10]Li Lei,and Hsieh YL.Chitosan bicomponent nanofibers and nanoporous fibers[J].Carbohydr Res,2006,341(3):374 -381.
[11]Greiner A,and Wendorff J.Electrospinning:A fascinating method for the preparation of ultrathin fibers[J].Angew Chem,2007,46(30):5670-5703.
[12]You Y,Youk JH,Lee SW,et al.Preparation of porous ultrafine PGA fibers via selective dissolution of electrospun PGA/PLA blend fibers[J].Mater Lett,2006,60(6):757 - 760.
[13]Gupta A,Saquing CD,Afshari M,et al.Porous nylon-6 fibers via a novel salt-induced electrospinning method [J].Macromolecules,2009,42(3):709-715.
[14]Casper CL,Stephens JS,Tassi NG,et al.Controlling surface morphology of electrospun polystyrene fibers:Effect of humidity and molecularweightin the electrospinning process[J].Macromolecules,2004,37(2):573-578.
[15]Bognitzki M,Czado W,Frese T,et al.Nanostructured fibers via electrospinning[J].Adv Mater,2001,13(1):70 -72.
[16]Qi Hongxu,Hu Ping,Xu Jun,et al.Encapsulation of drug reservoirs in fibers by emulsion electrospinning:Morphology characterization and preliminary release assessment[J].Biomacromolecules,2006,7(8):2327-2330.
[17]Zhan Naiqian,Li Yaoxian,Zhang Chaoqun,et al.A novel multinozzle electrospinning process for preparing superhydrophobic PS films with controllable bead-on-string/microfiber morphology[J].J Colloid Interface Sci,2010,345(2):491-495.
[18]Edwards MD,Mitchell GR,Mohan SD,et al.Development of orientation during electrospinning of fibres of poly(epsiloncaprolactone)[J].Eur Polym J,2010,46(6):1175 -1183.
[19]Secasanu VP, Giardina CK, Wang Yadong. A novel electrospinning target to improve the yield of uniaxially aligned fibers[J].Biotechnol Progr,2009,25(4):1169 -1175.
[20]Liao CC,Hou SS,Wang CC,et al.Electrospinning fabrication of partially crystalline bisphenol a polycarbonate nanofibers:The effects of molecular motion and conformation in solutions[J].Polymer,2010,51(13):2887-2896.
[21]Zhang Daming, Chang Jiang. Electrospinning of threedimensional nanofibrous tubes with controllable architectures[J].Nano Lett,2008,8(10):3283 - 3287.
[22]Kakade MV,Givens S,Gardner K,et al.Electric field induced orientation of polymer chains in macroscopically aligned electrospun polymer nanofibers[J].J Am Chem Soc,2007,129(10):2777-2782.
[23]Yang Dayong,Lu Bo,Zhao Yong,et al.Fabrication of aligned fibirous arrays by magnetic electrospinning[J].Adv Mater,2007,19(21):3702-3706.
[24]Asran AS,Henning S,Michler GH.Polyvinyl alcohol-collagenhydroxyapatite biocomposite nanofibrous scaffold:Mimicking the key features of natural bone at the nanoscale level[J].Polymer,2010,51(4):868-876.
[25]Fu YC,Nie H,Ho ML,et al.Optimized bone regeneration based on sustained release from three-dimensionalfibrous PLGA/HApcompositescaffoldsloaded with BMP-2[J].Biotechnol.Bioeng.,2008,99(4):996-1006.
[26]Choi JS,Lee SJ,Christ GJ,et al.The influence of electrospun aligned poly(epsilon-caprolactone)/collagen nanofiber meshes on the formation of self-aligned skeletal muscle myotubes[J].Biomaterials,2008,29(19):2899-2906.
[27]Yang F,Murugan R,Wang S,et al.Electrospinning of nano/micro scale poly(l-lactic acid)aligned fibers and their potential in neural tissue engineering[J].Biomaterials,2005,26(15):2603-2610.
[28]Lee CH,Shin HJ,Cho IH,et al.Nanofiber alignment and direction of mechanical strain affect the ECM production of human ACL fibroblast[J].Biomaterials,2005,26(11):1261-1270.
[29]Feng Zhanqi, ChuXuehui, HuangNingping, etal.Rat hepatocyte aggregate formation on discrete aligned nanofibers of type-i collagen-coated poly(l-lactic acid)[J].Biomaterials,2010,31(13):3604-3612.
[30]黄争鸣,张彦中.药物和蛋白质与聚己内酯分层复合纳米纤维的微观结构与力学特性[J].高等学校化学学报,2005,26(5):968-972.
[31]Xie Jingwei,and Wang CH.Electrospun micro-and nanofibers for sustained delivery of paclitaxel to treat c6 glioma in vitro[J].Pharm Res,2006,23(8):1817-1826.
[32]Xie Jingwei, Tan Ruoshan Wang CH. Biodegradable microparticles and fiber fabrics for sustained delivery of cisplatin to treat c6 glioma in vitro[J].J Biomed Mater Res Part A,2008,85A(4):897-908.
[33]Xu Xiuling,Yang Lixin,Xu Xiaoyi,et al.Ultrafine medicated fibers electrospun from W/O emulsions[J]. JControlled Release,2005,108(1):33-42.
[34]Jiang Hongliang, Hu Yingqian, Zhao Pengcheng, etal.Modulation ofprotein release from biodegradable core-shell structured fibers prepared by coaxial electrospinning[J].J Biomed Mater Res Part B-Applied Biomaterials,2006,79B(1):50-57.
[35]Jiang Hongliang, Hu Yingqian, LiYan, etal. A facile technique to prepare biodegradable coaxial electrospun nanofibers for controlled release of bioactive agents[J]. J Controlled Release,2005,108(2-3):237-243.
[36]Saraf A,Baggett LS,Raphael RM,et al.Regulated non-viral gene delivery from coaxial electrospun fiber mesh scaffolds[J].J Controlled Release,2010,143(1):95-103.

