酿酒酵母乙醇发酵性能与胁迫耐性的相关性*
李莉莉 叶美莉 叶燕锐 林影
(华南理工大学生物科学与工程学院,广东广州510006)
酿酒酵母(Saccharomyces cerevisiae)是一类重要的工业微生物,长期应用于面包烘焙、酒精和饮料的生产中.近年来,研究发现生物燃料乙醇可作为石油基能源的替代品,因而酿酒酵母菌发酵生产乙醇的生理特性研究倍受关注[1-2].
在乙醇的发酵过程中,酵母细胞会暴露在一系列的环境胁迫下,如高温、高渗透压、不断积累的高浓度乙醇、底物饥饿和氧化胁迫等,这些不利的环境都会降低细胞活力和发酵效能[1].目前,酵母细胞胁迫耐受能力是筛选乙醇高产菌株的一个重要评价标准,通过改善酵母胁迫耐受能力可明显提高酵母发酵生产乙醇的能力[2].在酿酒酵母菌种筛选的标准中,很多方面都与菌体的胁迫耐性相关,但对于酵母细胞耐性和发酵乙醇性能之间的相关性至今都未见系统的分析.
多变量数据分析在分类学中起着重要作用,其中线性判别式分析法(LDA)是一种多元变量的分类统计方法,可用于对测量结果的分组以及把新的测量结果分配至已经定义好的组类中[3].基于LDA,多元变量的依赖性和关联性的分析成为可能,同时能够对数据进行简化分析及对不同类别进行分类.LDA被广泛应用于多元变量的数据分析中,如面部识别、肿瘤分类、芯片数据及食品科学的统计学分类中[4-5].
文中应用高通量的微孔板液体培养方法来比较酵母适应不同胁迫条件的能力,为了更加客观地描述细胞的胁迫耐性,引入一量化评价参数——生长抑制因子(Gi).文中考察了14株酿酒酵母在乙醇发酵过程中所遇到的各种胁迫条件及不同的胁迫强度,以期通过对14株酿酒酵母的统计学分析提出两者具体的相关性,并且建立基于胁迫耐性预测发酵性能的统计学模型.
1 材料与方法
1.1 菌种
酵母菌株1-13号(No.1-No.13)均为不同的工业生产菌,来自不同的乙醇生产公司.酿酒酵母BY 4743(14 号菌株(No.14),MATa/α his3Δ1/his3Δ1 leu2Δ0/leu2Δ0 LYS2/lys2Δ0 met15Δ0/MET15 ura3Δ0/ura3Δ0)购自美国Invitrogen公司.
1.2 酵母菌株26S rDNA的序列分析
通过分析14株酵母的D1/D2序列来探讨它们之间的亲缘关系.提取培养过夜的酵母的基因组作为PCR的模板[6].LSU rRNA基因的差异结构域通过以下引物进行 PCR扩增:NL-1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和 NL-4(5'-GGTCCGTGTTTCAAGACGG-3').PCR 反应程序为:94℃预变性5min,循环开始,94℃变性1 min,53℃退火1min,72℃延伸 80 s,36 个循环之后,72℃延伸 10 min,最后冷至4℃.通过琼脂糖凝胶电泳对PCR产物进行分析,来确认是否成功将目的基因从基因组中扩增出来.对获得的PCR产物测序,将获得的序列与已知数据库中的相应结果进行比较.通过Clustal X软件的邻位连接(neighbor-joining)功能对其亲缘关系进行分析.
1.3 酵母细胞的培养
酵母细胞首先在YPD培养基(酵母粉1%、蛋白胨2%、葡萄糖2%)中过夜培养,然后转接入新鲜的YPD培养基中并置于自动读数的恒温酶标仪(美国热电公司)中震荡培养,细胞生长情况通过测定595 nm下的菌体浊度来监测.
1.4 胁迫处理
对于酵母的胁迫耐性实验,采用了 Carrasco、Aranda等[7-8]的研究方法,只对其进行了稍微的改动.在高温胁迫实验中,生长于30℃的细胞先被转移至新鲜的YPD培养基中,然后于42℃下进行培养.在山梨醇胁迫实验中,细胞分别被转移至0、1.0、1.5、2.0和 2.5 mol/L的山梨醇 YPD培养基中;在NaCl胁迫实验中,细胞分别被转移至0、0.5、1.0和1.5mol/L的NaCl YPD培养基中;在乙醇胁迫实验中,细胞分别被转移至0、10%、15% 和20%(体积分数)的乙醇YPD培养基中,然后于30℃下进行培养,其中胁迫开始的接种细胞数均约为2.5×105个/mL.胁迫耐性实验都进行了3次独立的生物学重复.
1.5 乙醇发酵
过夜培养的酵母细胞被转接至新鲜的乙醇发酵培养基(酵母粉0.6%、蛋白胨1%、葡萄糖30%、(NH4)2SO40.5%、KH2PO41%、MgSO4·7H2O 0.05%和CaCl2·2H2O 0.015%)中,最初接种细胞数均约为2.5×105个/mL,在30℃下培养48h,每隔4h取样对发酵性能进行分析.其中样品的准备方法及乙醇和葡萄糖的检测都参照文献[9]中的实验方法.发酵实验进行3次生物学重复.
1.6 数据分析
用LDA对酵母细胞乙醇发酵性能与其胁迫耐性进行了相关性分析,同时利用交叉验证法对其误分类的可能性进行了评估.数据处理均采用SPSS软件.
2 结果与讨论
2.1 基于发酵性能对酵母菌株进行分类
将14株酵母菌株的26S rDNA D1/D2结构域扩增序列与GenBank数据库中酿酒酵母核苷酸序列比对,其同源性高达98%.基于26S rDNA D1/D2的系统发育进化树分析在分子水平上显示,这些菌株均为酿酒酵母(S.cerevisiae)(见图1).其中14号菌株S.cerevisiae BY4743为标准的阳性菌株.
为了分析这些菌株的发酵性能,在高糖浓度培养基(葡萄糖含量超过250 g/L)中进行了14株酵母菌株的乙醇发酵实验,结果如表1所示,其中乙醇终产量由乙醇体积分数表示.相比于14号实验室标准菌株,其它工业菌株均显示出了较快的葡萄糖消耗速率和乙醇生产速率.根据葡萄糖消耗和乙醇生产能力对14株酵母菌株进行层次聚类分析发现,14株酵母菌株被分为3个发酵性能差异的组别(见图2).结合表1的数据,发现第1组为发酵性能最好的一类,具有较高的乙醇终产量(大于12%,体积分数)和葡萄糖消耗速率;第3组是发酵性能最差的一类,具有较低的乙醇终产量(小于7%)和葡萄糖消耗速率;第2组菌株的发酵能力介于第1和第3组之间,此类菌株包括 No.1、No.10、No.4、No.8、No.11和No.7.
2.2 酵母胁迫耐性的分析
乙醇胁迫、渗透压胁迫和高温胁迫是乙醇发酵过程中,特别是高密度(VHG)发酵中最重要的3种胁迫类型[10-12].对实验室条件下细胞在各种不同环境胁迫下的耐性进行分析,结果发现,在山梨醇浓度为2.5mol/L、NaCl浓度为2.0mol/L、乙醇协迫实验强度为15%和20%的条件下细胞生长受到严重抑制.细胞正常条件下的生长情况也被监测,作为对照.No.6菌株显示出了最差的生长能力,No.3、No.4、No.5、No.9、No.11、No.12、No.13 菌株长势较好.

图1 基于26S rDNA D1/D2的系统发育进化树Fig.1 Phylogenetic trees based on 26S rDNA D1/D2 domain sequence
为了更好地评价菌株的胁迫耐性,引入生长抑制因子Gi(见表2).Gi定义为菌体在胁迫条件与在正常条件下菌体浊度的比例(菌体培养48h时).变量Gi不仅考虑到了菌体受胁迫环境的抑制作用,还考虑到了菌体正常条件下的生长情况,与仅研究胁迫条件下菌体的生长情况相比更为客观.表2所示结果显示,对于工业菌株来说,细胞耐性与发酵能力存在一定的正相关性,但对于实验室标准菌株,此种关系不存在.

表1 酿酒酵母的乙醇产量和底物消耗情况1)Table 1 Ethanol yield and substrate consumption of S.cerevisiae

图2 酵母发酵性能的层次聚类分析系统树图Fig.2 Dendrogram of hierarchical cluster of fermentation behavior of S.cerevisiae
2.3 多变量判别式分析
对各类胁迫条件下的数据进行全局性分析发现,发酵性能较差的菌株对不利环境会显示出较强的敏感性(见表2),可以建立一个预测发酵性能的标准以及对3种发酵性能差异类别的有效分类规则.LDA对个体样本有一种先验性的假定,如果一种特定的组别在数据空间中能够很好地分类,那么LDA将会建立一种分类函数.该功能函数能够将未知的样本分配至已定义的特定组别中.在本研究中,可以建立基于细胞胁迫耐受能力、通过LDA的分类功能来预测发酵性能的模型.
通过SPSS软件建立了数据矩阵(见表2),其中矩阵包括14行(14株菌株)、9列(菌株编号、菌株对4种不同胁迫的抑制因子、菌株发酵性能的分类组别).在建立线性判别函数(LDF)时输入所有自变量,然后SPSS会根据所输入变量推测出两个(菌株分类数3减1)功能函数(参数见表3).根据表3,最小的p值代表了最大的判别份量,函数Ⅰ对判别结果起着决定性的作用.另一种获得函数判别力量的方式是通过散点图(见图3),该图把14株菌株根据两个函数的判别数值通过二维平面图展示出来.图3中,中心数值代表了每个组中的典型类型.各个中心位点之间的关系再一次证明函数Ⅰ是决定性的判别函数.同时,进一步的判别分析对每个样本在原来总样本中的类别进行了验证,并且给出了一个分类可能值,见表4,菌株被归入先前根据发酵行为所分的类别中.

表2 各种胁迫条件下的菌体生长的受抑制情况1)Table 2 Inhibition of cell growth under various stress conditions

表3 SPSS建立的功能函数参数Table 3 Parameters of functions defined by SPSS program
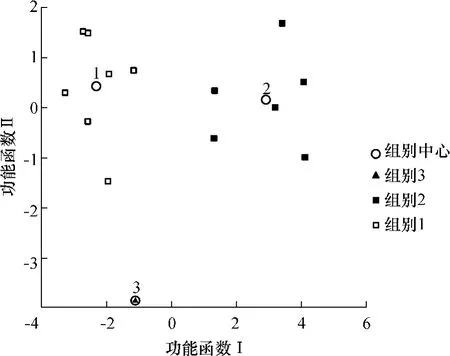
图3 酵母菌株发酵性能预测点值空间分配图Fig.3 Predicted scores plot of yeast strains considering the fermentation behavior

表4 SPSS功能函数在菌株分组中的判别分析1)Table 4 Discriminant application of SPSS program functions to the group of strains
交叉性的验证用于对数据的进一步检验分析.在该程序中,样本被分为k份,只有一份不参与建立分类规则,然后用建立的分类函数对不参与的样本进行分类,该过程重复k次,验证结果的可能性为k次重复可行性的平均值.交叉验证结果见表4,菌株No.5和菌株No.14分别被误分在第3组和第1组.菌株No.14组别被误分在意料之中,因为预测函数几乎都是根据工业酿酒酵母建立起来的,而菌株No.14是实验室标准菌株,该菌株的发酵性能与胁迫耐性的关系与工业菌株差异较大.造成该差异的原因可能是工业菌株在长久的进化过程中经历了较为复杂的环境胁迫驯化历程;另外,为了保证优良的乙醇发酵性能,工业菌株需要具有较快、较好的环境响应能力.
以上结果显示,对于各种胁迫条件,发酵能力与胁迫耐性是相关的,尽管这种相关性是不完全的.为了验证这种相关性是否具有某种特定的相关模式,判别式分析法被用于对胁迫耐性和发酵能力的全部数据进行分析.像其他的预测方法一样,该方法主要关注于预测变量与响应变量矩阵之间的关系,目的是对不同类别进行适当的分类,为未知个体分配至不同类别提供分类依据.此外,LDA能够帮助解释不同预测变量在组别分类中的具体作用.文中借助LDA,对酵母胁迫耐性和工业发酵过程的相关性有了更深入的了解,这种相关性可以在基于细胞耐性的条件下用于预测其他工业菌株的发酵性能.利用交叉验证的方法发现85.7%的菌株是能够被正确预测的,这就意味着对个体的分类并非偶然.
3 结语
文中考察了14株酿酒酵母在乙醇发酵过程中所遇到的各种胁迫条件及不同的胁迫强度,通过对14株酿酒酵母的统计学分析提出了两者具体的相关性,并且建立了基于胁迫耐性预测发酵性能的统计学模型.
用于燃料乙醇发酵的理想菌株应该具有抵抗各种不同环境胁迫的能力,在实验室条件下通过对细胞胁迫耐受能力的判定能够对乙醇发酵菌株进行一个最初的筛选.用无需特殊技术的高通量的耐性评价试验替代对酵母工业发酵能力的测定为整个菌株筛选提供了一种简单快捷的方式,对酵母胁迫耐性的深度分析为理解和改善乙醇的发酵能力提供了依据.由于胁迫耐性和基因表达之间的相关性,不同胁迫条件下基因表达的差异对细胞抵抗不利环境也起到了很重要的作用.因此,可以通过对基因表达的研究获得对细胞代谢行为更深入的认识,为菌株选育提供更有价值的线索.此外,Gi值被引入用于定量评价细胞的胁迫耐受能力.通过细胞胁迫耐性对发酵性能的正确预测说明用Gi来评价细胞胁迫耐性是科学且可行的.该方法不仅减少了耐性评价的主观性和困惑性,而且可以通过高通量的试验方式来实现.
[1]Gibson B R,Lawrence S J,Leclaire J P R,et al.Yeast responses to stresses associated with industrial brewery handling[J].FEMS Microbiology Reviews,2007,31(5):535-569.
[2]叶燕锐,朱怡,李莉莉,等.耐热酵母中海藻糖代谢途径对热胁迫的响应[J].华南理工大学学报:自然科学版,2010,38(5):139-143.Ye Yan-rui,Zhu Yi,Li Li-li,et al.Response of metabolic pathway of trehalose in heat-resistant yeast Saccharomyces cerevisiae to heat stress[J].Journal of South China University of Technology:Natural Science Edition,2010,38(5):139-143.
[3]Ni W D,Brown S D,Man R L.Wavelet orthogonal signal correction-based discriminant analysis[J].Analytical Chemistry,2009,81(21):8962-8967.
[4]Tai F,Pan W.Incorporating prior knowledge of gene functional groups into regularized discriminant analysis of microarray data [J].Bioinformatics,2007,23(23):3170-3177.
[5]Huang D S,Zheng C H.Independent component analysisbased penalized discriminant method for tumor classification using gene expression data [J].Bioinformatics,2006,22(15):1855-1862.
[6]Liti G,Barton D B H,Louis E J.Sequence diversity,reproductive isolation and species concepts in Saccharomyces[J].Genetics,2006,174(2):839-850.
[7]Carrasco P,Querol A,del Olmo M.Analysis of the stress resistance of commercial wine yeast strains[J].Archives of Microbiology,2001,175(6):450-457.
[8]Aranda A,Querol A,del Olmo M.Correlation between acetaldehyde and ethanol resistance and expression of HSP genes in yeast strains isolated during the biological aging of sherry wines[J].Archives of Microbiology,2002,177(4):304-312.
[9]Li L L,Ye Y R,Pan L,et al.The induction of trehalose and glycerol in Saccharomyces cerevisiae in response to various stresses[J].Biochemical and Biophysical Research Communications,2009,387(4):778-783.
[10]Sree N K,Sridhar M,Suresh K,et al.Isolation of thermotolerant,osmotolerant,flocculating Saccharomyces cerevisiae for ethanol production[J].Bioresource Technology,2000,72(1):43-46.
[11]Birch R M,Walker G M.Influence of magnesium ions on heat shock and ethanol stress responses of Saccharomyces cerevisiae[J].Enzyme and Microbial Technology,2000,26(9/10):678-687.
[12]Querol A,Fernandez-Espinar M T,del Olmo M,et al.A-daptive evolution of wine yeast[J].International Journal of Agricultural and Food Chemistry,2003,86(1/2):3-10.

