亚热带木腐真菌产漆酶及其酶学性质*
傅恺 付时雨 张丽 周攀登 詹怀宇
(华南理工大学制浆造纸工程国家重点实验室,广东广州510640)
纤维素、半纤维素和木质素是地球上最丰富的可再生三大有机资源,统称为木质纤维素.自然界中参与木质纤维素降解的微生物主要有真菌、细菌和放线菌,但是很多微生物都没有独立降解木质纤维素——特别是木质素的能力,而木腐真菌则能够通过其分泌的生物酶进攻纤维细胞壁,造成木质纤维素的降解,表现为木质腐朽.白腐菌是对木质素降解能力最强的木腐真菌之一,是目前已知的能在一定条件下将木质素彻底降解为CO2和H2O的唯一一类生物,其分泌的木质素降解酶主要有木质素过氧化物酶、锰过氧化物酶和漆酶[1].
漆酶(Laccase,EC 1.10.3.2)是一种含铜的多酚氧化酶,底物范围非常广泛,能够催化氧化多种酚类和芳胺类化合物.在某些小分子介体存在的条件下,漆酶还能够氧化非酚型木质素,此过程中,介体在漆酶的作用下会形成活性较高且有一定稳定性的中间体,这些活性中间体能从氧分子中获得电子传递给底物,从而使底物降解.相对于酶,介体形成的中间体体积较小,易扩散,可以达到酶蛋白所不能进入的区域,从而扩大了漆酶催化反应的作用范围[2].近十几年来,漆酶对木质素和与木质素结构相似的许多环境污染物的降解作用越来越受到科研工作者的关注,特别是在纸浆生物漂白[3]、工业废水处理[4]、有机染料脱色[5]和高分子催化合成[6]等方面,表现出了很大的研究价值和应用潜力.
随着检测分析技术的不断发展,国内外的研究者通过多种生物化学和分子生物学方法,对漆酶有了更深入的研究和了解,主要集中在蛋白分子质量、多糖含量、等电点、催化反应动力学常数、最适反应温度和pH值、热稳定性、酸碱稳定性和底物特异性等方面[7-12].总体而言,真菌漆酶在蛋白结构方面具有诸多的共性,但是来源于不同菌种的漆酶之间,以及来源于同一菌种的漆酶同工酶之间也存在着不同程度的差异,必须掌握它们特定的酶学性质才能够提供正确的反应条件以发挥漆酶的催化作用.然而微生物的发酵液通常都是以复杂的混合物形式存在,含有很多分子质量、结构和功能等都不同的无机盐、多糖和蛋白质等,不利于对漆酶的深入精确研究,因此采用高效率、高得率的分离纯化方法,从真菌发酵液中获得高纯度、高活性和完整的漆酶蛋白,成为研究漆酶结构、功能以及酶学性质的前提.
P.candolleana隶属于真菌门,担子菌亚门,伞菌目,鬼伞科,脆柄菇属,是中国南方地区常见的一种可食用型真菌,野生量较大,但是目前为止国内外还未见关于其生产木质纤维素降解酶,特别是漆酶的研究和报道.笔者所在实验室从采集的多株野生木腐菌子实体或菌丝样品中,分离筛选出一株产漆酶能力较强的菌株,在自然环境下能够使植物的木质部分发生白腐现象,故也称白腐菌,经18s rDNA序列分析鉴定为P.candolleana.该野生菌种经人工紫外线诱变选育和优化培养后,摇瓶发酵的漆酶产量大幅提高,具有较高的深入研究的价值和应用潜力[13-14].文中将 P.candolleana漆酶的生产扩大到发酵罐规模(5 L),对其所产漆酶进行分离纯化,并对该漆酶的部分酶学性质进行了研究.
1 实验材料与方法
1.1 材料与仪器
菌种:P.candolleana野生菌株经笔者所在实验室紫外诱变选育后,4℃下保存于PDA培养基中.
种子培养基:1L马铃薯浸出液中加入无水葡萄糖 20g,蛋白胨 1g,KH2PO43g,MgSO4·7H2O 3g.
发酵培养基:1L种子培养基中再加入麦麸10g,消泡剂0.2mL,CuSO4·5H2O 2mmol.
主要设备和仪器:SHKE5000恒温摇床,Thermo公司生产;BioFlo 110型5 L机械搅拌式发酵罐系统,NBS公司生产;3K15冷冻离心机,Sigma公司生产;8453紫外可见分光光度计,Agilent公司生产;Pellicon超滤系统,Millipore公司生产;AKTA自动层析系统,GE公司生产;垂直电泳仪,BIO-RAD公司生产.
1.2 方法
1.2.1 白腐菌液体深层发酵
供试P.candolleana菌种由PDA斜面转接入装有50mL种子培养基的300mL三角瓶中,150r/min、28℃震荡培养3 d后,菌丝体经过滤、洗涤后打散,收集于无菌水中制成菌丝悬浮液,将500mL菌丝悬浮液于无菌条件下转接入装有3 L发酵培养基的发酵罐中,叶轮转速300 r/min,培养液温度通过循环冷凝水维持在28℃,同时向发酵罐中通入氧气以维持发酵液的溶氧度.定时抽取发酵液用于测定葡萄糖浓度和漆酶活力,并记录pH值的变化情况.发酵结束后,发酵液经纱布过滤除去菌丝体和麦麸残渣,4℃下5000r/min冷冻离心15min,收集上清液即得粗酶液.
1.2.2 漆酶的分离纯化步骤
在100mL粗酶液中加入17.4g(NH4)2SO4(使(NH4)2SO4在粗酶液中的饱和度达到硫酸铵总饱和度的30%),4℃静置2 h,冷冻离心后收集上清液,再加入35.6 g(NH4)2SO4(使(NH4)2SO4在粗酶液中的饱和度达到硫酸铵总饱和度的80%),4℃静置4h,冷冻离心后收集沉淀备用.固体粗酶用去离子水充分溶解,转入Pellicon切向流超滤系统中,超滤膜阻留分子质量为10 ku,超滤至酶液中无离子存在.将充分溶胀和酸碱预处理后的DE52纤维素离子交换剂装入层析柱(1.5 cm×70cm),以0.05 mol/L、pH4.8的醋酸缓冲液(缓冲液A)充分平衡色谱柱.酶液上样体积30mL,用0~1.0mol/L NaCl溶液(以缓冲液A为溶剂配制)梯度洗脱,洗脱时间8h,全程恒流速度1mL/min,分部收集过柱分离液(5 mL/管).检测分离液的漆酶活力,将有酶活的部分合并,转入超滤系统中,超滤至酶液中无Cl-离子存在.
1.2.3 漆酶活力测定
用等体积 0.5 mmol/L 2,2'-联氮-二(3-乙基苯并噻唑-6-磺酸)(ABTS)溶液和适当稀释的酶液反应,测定反应过程的前3 min内420 nm处吸光度的变化量,定义每分钟使1 μmol ABTS转化所需要的酶量为1个漆酶活力单位(U).
1.2.4 蛋白质含量测定
酶液中蛋白质含量的测定采用考马斯亮蓝G-250 染色法[15].
1.2.5 SDS-PAGE分析
采用变性聚丙烯酰胺凝胶电泳法(SDS-PAGE)测定漆酶蛋白分子量,浓缩胶和分离胶浓度(质量分数)分别为5%和12%,以低分子质量蛋白Marker为标准,电泳结束后胶板用考马斯亮蓝R-250染色.
1.2.6 漆酶动力学常数的测定
在常温下,将漆酶分别与不同浓度的ABTS溶液反应,记录反应过程的前3 min内反应体系在420nm处吸光度的变化,通过 Michaelis-Menten方程,采用Lineweaver-Burk双倒数作图法计算漆酶对底物ABTS的米氏常数Km.
1.2.7 pH值对漆酶活力和稳定性的影响
分别在不同酸碱条件下测定漆酶的活力,设最高者的相对酶活为100%.为考察漆酶的酸碱稳定性,将漆酶于4℃下分别保存于不同pH值的缓冲液中(pH值在3.0~7.0之间的醋酸缓冲液),定时测定其剩余活力,设定原始漆酶的相对活力为100%.
1.2.8 温度对漆酶活力和稳定性的影响
分别在不同温度下测定漆酶的活力,设最高者的相对酶活为100%.为考察漆酶的热稳定性,将漆酶分别保存于不同温度条件下,定时测定其剩余活力,设定原始漆酶的相对活力为100%.
1.2.9 金属离子对漆酶活力的影响
将漆酶分别用一定浓度的 CuSO4、KCl、NaCl、MnSO4、CaCl2、FeSO4、FeCl3、MgSO4、ZnSO4、BaCl2和AlCl3溶液适当稀释,然后与等体积的0.5 mmol/L的ABTS溶液混合,使反应体系中金属离子的浓度分别达到1 mmol/L和5 mmol/L,立即测定漆酶活力,设定原始纯化漆酶的活力为100%.
1.2.10 实验结果的处理
以上实验均平行做2个样品,实验结果取其平均值.
2 结果与讨论
2.1 漆酶的产生
真菌漆酶的生产扩大化和规模化是漆酶从实验室研究走向工业化生产的关键环节和必由之路,对提高漆酶产量、降低生产成本以实现其工业化应用具有极其重要的现实意义.本研究将P.candolleana漆酶的生产由摇瓶扩大到5L规模(工作体积3.5L)的发酵罐中,对真菌漆酶的初步扩大化生产进行探索,实验结果如图1所示.由图1可见,漆酶在第1天时即表现出一定的活力,随后快速升高,至第5天时酶活升至最大,约9100U/L.发酵液的pH值始终保持缓慢上升的趋势,由原始pH5.3上升至第6天时的7.1左右.此外,由于氧气供给充足,发酵液中溶氧度一直维持在较高水平,因此白腐菌细胞繁殖很快,菌丝生长较为旺盛,相应的对营养物质需求量较大,这可能是培养基中葡萄糖消耗速度较快的主要原因.
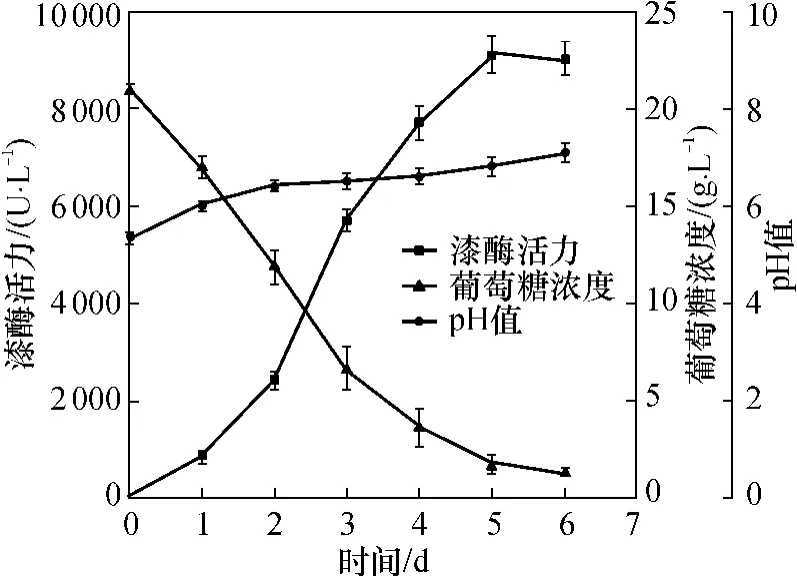
图1 P.candolleana漆酶的生产Fig.1 Laccase production from P.candolleana
近几年国内外报道的相关研究结果表明,P.candolleana在发酵罐中的漆酶产量较高,并且发酵周期短,具有较大的研究和应用优势[16-17].但是相比于笔者所在实验室之前报道的摇瓶发酵研究结果[13-14],相同条件下 P.candolleana在发酵罐中漆酶的单位体积产量还较低,只达到摇瓶中的50%左右.这主要是因为发酵罐中存在着与摇瓶发酵迥异的动力、热量、物料以及氧气等的传递特性,发酵过程中各种参数不易控制,严重影响微生物的生长和代谢.观察实验过程发现,P.candolleana菌丝体生长后期发酵液的黏稠度显著提高,对物料、热量和氧气的均匀传递会有一定的影响,这可能也是导致漆酶产量低于摇瓶发酵的原因之一.另外,虽然可以通过提高搅拌转速来促进物料的传递,但是许多报道都指出,过高的转速会导致菌丝受到的剪切力增大,抑制细胞繁殖代谢和漆酶的分泌,甚至导致细胞破裂[16].
2.2 漆酶的分离纯化
粗酶液经(NH4)2SO4分级盐析和离子交换色谱柱分离后,其在280nm处的洗脱曲线共出现两个可明显辨认的紫外吸收峰,用ABTS检测出只有第一个洗脱峰附近的分离液具有明显的漆酶活性.合并此洗脱峰附近的分部收集液,得到P.candolleana纯化漆酶,纯化结果如表1所示.纯化漆酶的比活力达438.0U/mg,提高到原始粗酶液的13.2倍,总漆酶活力得率为50.1%.该样品经SDS-PAGE电泳检测只显示出一条蛋白染色谱带,如图2所示,表明分离纯化得到的漆酶为单一组分蛋白,已达到电泳纯级别.
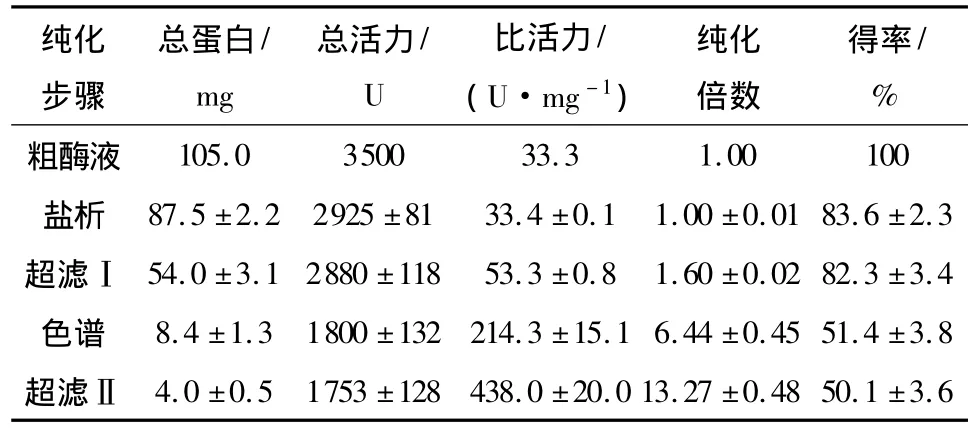
表1 P.candolleana漆酶的纯化结果Table 1 Purification of laccase from P.candolleana
2.3 漆酶的酶学性质
2.3.1 漆酶蛋白分子质量
真菌漆酶的分子量通常集中在50~80 ku之间[18],P.candolleana纯化漆酶经变性聚丙烯酰胺凝胶电泳和考马斯亮蓝R-250染色后显示出单条谱带,以低分子质量标准蛋白为参比(图2),根据分子质量与相对迁移率之间的关系,求得该漆酶的分子质量约为61.2ku,与大多数真菌漆酶的分子质量相近.
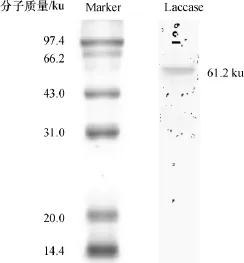
图2 P.candolleana漆酶的SDS-PAGE图Fig.2 SDS-PAGE patterns of laccase from P.candolleana
2.3.2 漆酶动力学常数
米氏常数Km是酶的特征常数之一,能够反映漆酶对底物亲和力的大小,Km值越小,亲和力越大,漆酶对底物的氧化率也就越高.通过米氏方程,采用双倒数作图法得到酶促反应速度v和底物浓度之间的关系曲线如图3所示.由此计算出P.candolleana漆酶对底物ABTS的Km为0.016 mmol/L.与已报道[7-12]的其它来源的真菌漆酶相比,相同条件下P.candolleana漆酶的米氏常数较低,表现出了对底物ABTS更高的亲和力,催化反应速度较快.何为等[19]认为,在纸浆生物漂白过程中,漆酶/介体系统的介体浓度是不断下降的,Km值小的漆酶可以在介体浓度降低的条件下,维持较快的介体自由基的形成速度,从而有利于纸浆的脱木素过程.
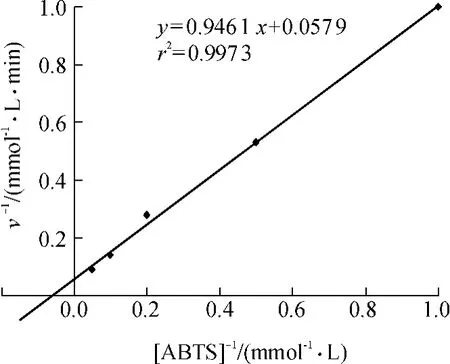
图3 P.candolleana漆酶的Lineweaver-Burk曲线Fig.3 Linewear-Burk plots of laccase from P.candolleana
2.3.3 漆酶最适反应pH值和酸碱稳定性
pH值对P.candolleana漆酶活力的影响如图4所示.由图4可见,以ABTS为底物时,漆酶在酸性条件下活力较高,其中在pH值为5.0时的活力最高.当pH值大于5.5后,酶活下降非常迅速,在pH值为6.0和7.0条件下漆酶酶活分别仅为最高酶活的89.6%和72.2%.
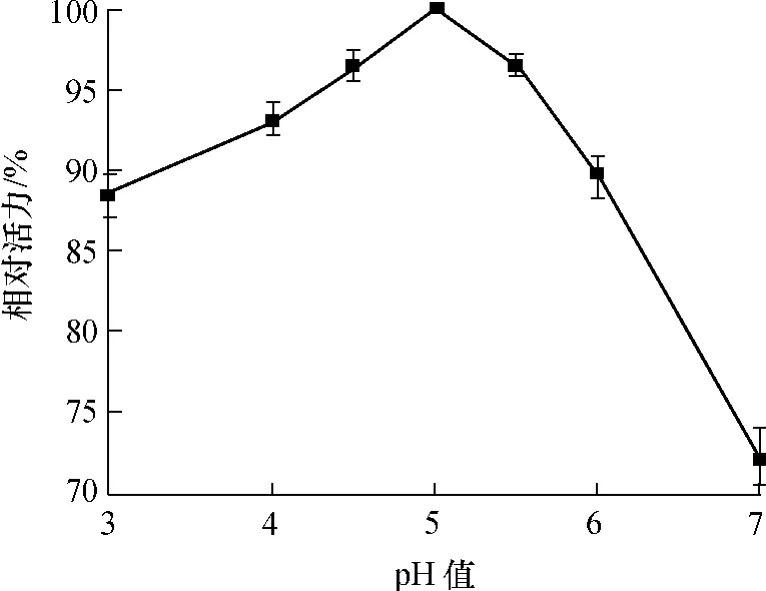
图4 pH值对漆酶活力的影响Fig.4 Effect of pH value on laccase activity
将漆酶分别置于不同pH值的缓冲液中,4℃下保存,漆酶活力随保温时间的变化如图5所示.漆酶的活力随保温时间的增加而降低,酸碱环境对其影响较大,在弱碱性条件下时酶活稳定性较好,其中在pH值为9.0的条件下,漆酶活力损失最慢,保存16d后,酶活能够保持为初始酶活的84.5%.过酸或过碱的环境都会损害漆酶活力的稳定性,酶活损失较快,当pH值小于6.0或者大于10.0时,漆酶活力在保存16d后损失即超过1/4.

图5 不同pH值下漆酶的稳定性Fig.5 Stability of laccase at different pH value
2.3.4 漆酶最适反应温度和热稳定性
不同反应温度对P.candolleana漆酶活力的影响如图6所示.漆酶在40~50℃时能保持较高的活力,其中在45℃时,酶活达到最高.当温度低于30℃或者高于50℃后,酶活降低很快,在20℃和70℃时,漆酶酶活分别仅为最高酶活的74.3%和74.1%.
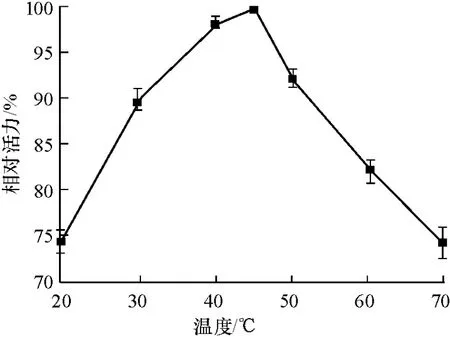
图6 温度对漆酶活力的影响Fig.6 Effect of temperature on laccase activity
不同温度下,漆酶活力随保温时间的变化如图7所示.漆酶活力随保温时间的增加而降低,在低温条件下,漆酶活力损失较慢,在4℃和10℃下保存16d后,漆酶活力分别为初始酶活的84.5%和81.5%;当温度超过30℃后,酶活损失较快,16d后已基本丧失殆尽;温度超过40℃,保存6d后,漆酶活力即完全丧失.这说明P.candolleana漆酶的最适保存温度和最适反应温度相差较大,因此在实际应用中,工作温度的确定应当兼顾漆酶最适反应温度和热稳定性的要求,可在稍低于漆酶最适反应温度的范围内选择.
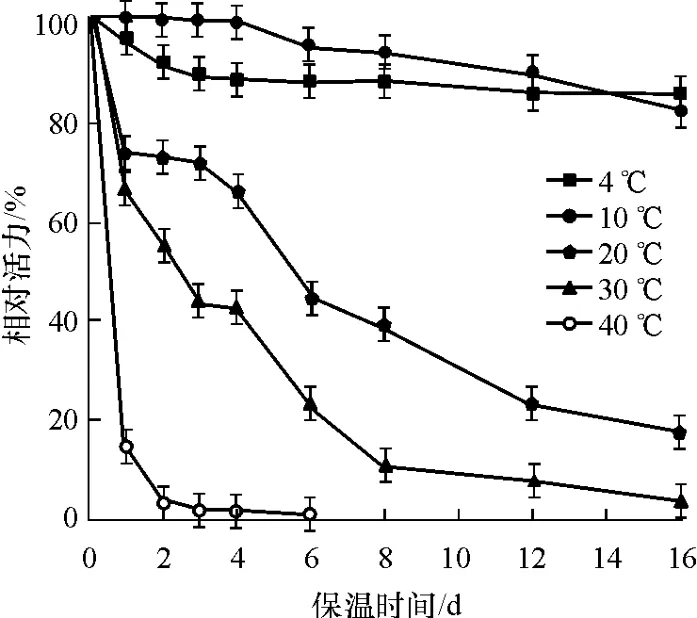
图7 不同温度下漆酶的稳定性Fig.7 Stability of laccase at different temperature
2.3.5 常见金属离子对漆酶活力的影响
未漂纸浆、有机废水等白腐菌漆酶的生物处理环境中往往含有大量不同种类的金属离子,都会在一定程度上影响漆酶的活性,使漆酶的用量和浓度不易控制.以ABTS为底物时,各金属离子对漆酶活力的影响如表 2所示.Mg2+、Mn2+、Zn2+对 P.candolleana漆酶活力的影响很小,分别表现为微弱的激活或抑制作用,酶活基本都保持在100%左右;K+、Na+、Ca2+、Cu2+、Ba2+、Al3+、Fe3+等对漆酶活力都表现出了比较明显的抑制作用,特别是离子浓度较高(5mmol/L)时抑制作用更加明显;Fe2+对漆酶活性的抑制作用最为强烈,Fe2+浓度为5 mmol/L时,表现为完全抑制,测定的酶活几乎为0.王习文等[20]对Fe2+影响漆酶活力的机理进行了较为详细的研究,结果表明,Fe2+的抑制作用是暂时性的,一段时间后漆酶又能重新恢复活性,并继续进行催化反应,且反应速度与未加入Fe2+时近似,恢复所需时间随Fe2+浓度的增加而延长.其机理可能为:Fe2+的抑制位点既不是漆酶本身,也不是底物分子,没有改变漆酶和底物的状态,也没有影响漆酶和底物的结合速度,但是Fe2+能通过对催化反应产物ABTS自由基的还原作用,使其恢复到底物起始状态来延缓漆酶催化氧化反应的进程,因此,Fe2+抑制漆酶催化活性的有效位点是催化反应的产物ABTS自由基.

表2 金属离子对漆酶活性的影响Table 2 Effect of metal ions on laccase activity
3 结论
(1)P.candolleana经人工诱变选育后,其发酵罐培养的漆酶产量最高可达9100U/L.
(2)分离纯化发酵液后得到的P.candolleana漆酶,比活力达到438.0U/mg.
(3)SDS-PAGE电泳检测显示出单条蛋白染色谱带,漆酶蛋白分子质量约为61.2ku.
(4)通过对酶学性质的分析表明,该漆酶表现出较为典型的真菌漆酶特征,其米氏常数为0.016mmol/L,催化反应最适温度和pH值分别为45℃和5.0,漆酶活性在4~10℃和pH9.0条件下具有较好的稳定性,Mg2+、Mn2+、Zn2+等金属离子对其活力的影响较小.
(5)和文献报道的多种漆酶相比,P.candolleana漆酶底物亲和力较强,在纸浆生物漂白、有机染料脱色和废水处理等工业污染控制领域具有较好的应用潜力和价值.
[1]李慧蓉.白腐真菌生物学和生物技术[M].北京:化学工业出版社,2005.
[2]Petri W,Andreas K.Laccase applications in the forest products industry:A review [J].Enzyme and Microbial Technology,2008,42(4):293-307.
[3]Zhan Huai-yu,Fu Shi-yu,Yu Li,et al.Study on the LMS biobleaching of Eucalyptus kraft pulps[J].Journal of South China University of Technology:Natural Science E-dition,2000,28(12):6-11.詹怀宇,付时雨,喻力,等.桉木硫酸盐浆LMS生物漂白的研究[J].华南理工大学学报:自然科学版,2000,28(12):6-11.
[4]Fenice M,Sermanni G G,Federici F,et al.Submerged and solid-state production of laccase and Mn-peroxidase by Panus tigrinus on olive mill wastewater-based media[J].Journal of Biotechnology,2003,100(1):77-85.
[5]Hou Hongman,Zhou Jiti,Wang Jing,et al.Enhancement of laccase production by Pleurotus ostreatus and its use for the decolorization of anthraquinone dye[J].Process Biochemistry,2004,39(11):1415-1419.
[6]周攀登,付时雨.漆酶催化对苯基苯酚的聚合[J].高分子学报,2004,8(4):614-616.Zhou Pan-deng,Fu Shi-yu.The polymerization of 4-phenylphenol catalyzed by laccase[J].Acta Polymerica Sinica,2004,8(4):614-616.
[7]刘梦茹,付时雨,詹怀宇,等.毛柄金钱菌漆酶的纯化与理化性质研[J].造纸科学与技术,2006,25(3):9-13.Liu Meng-ru,Fu Shi-yu,Zhan Huai-yu,et al.Purification and Characterization of Laccase from Flammulina velutipes[J].Paper Science and Technology,2006,25(3):9-13.
[8]黄乾明,杨婉身,陈华萍,等.粗毛栓菌诱变菌株SAH-12漆酶的分离纯化及酶学性质研究[J].菌物学报,2007,26(4):539-548.Huang Qian-ming,Yang Wan-shen,Chen Hua-ping,et al.Purification and characterization of a laccase from the mutated strain SAH-12 of Trametes gallica[J].Mycosystema,2007,26(4):539-548
[9]Derek L,Marielle J V,Andre T,et al.Purification and kinetics of a thermostable laccase from Pycnoporus sanguineus(SCC 108)[J].Enzyme and Microbial Technology,2007,40(4):563-568.
[10]Sadhasivam S,Savitha S,Swaminathan K,et al.Production,purification and characterization of mid-redox potential laccase from a newly isolated Trichoderma harzianum WL1 [J].Process Biochemistry,2008,43(7):736-742.
[11]Zhang Guo-Qing,Wang Yi-Fan,Zhang Xiao-Qing,et al.Purification and characterization of a novel laccase from the edible mushroom Clitocybe maxima[J].Process Biochemistry,2009,45(5):627-633.
[12]Mohamed N,Atef J,Raoudha E G,et al.Purification,characterization and decolourization ability of Fomes fomentarius laccase produced in solid medium[J].Journal of Molecular Catalysis B:Enzymatic,2010,64(1/2):68-74.
[13]傅恺,付时雨,李雪云,等.产漆酶白腐菌的诱变选育及其液体发酵的研究[J].造纸科学与技术,2009,28(5):21-24.Fu Kai,Fu Shi-yu,Li Xue-yun,et al.Mutational screening of white rot fungi for laccase production in liquid cultivation [J].Paper Science and Technology,2009,28(5):21-24.
[14]Fu Kai,Fu Shi-yu,Zhou Pan-deng,et al.Laccase production by Psathyrella candolleana in a Stirred-tank Fermentor[C]∥Research Progress in Paper Industry and Biorefinery.Guangzhou:South China University of Technology Press,2010:546-549.
[15]赵亚华.生物化学实验技术教程[M].广州:华南理工大学出版社,2000.
[16]Couto S R,Jose L T.Laccase production at reactor scale by filamentous fungi [J].Biotechnology Advances,2007,25(6):558-569.
[17]高大文,文湘华,钱易.白腐真菌木质素降解酶的反应器发酵[J].环境科学,2006,27(2):333-337.Gao Da-wen,Wen Xiang-hua,Qian Yi.Production of ligninolytic enzymes in bioreactor[J].Environmental Science,2006,27(2):333-337.
[18]Thurston C F.The structure and function of fungal laccase[J].Microbiology,1994,140(1):19-26.
[19]何为,詹怀宇,王习文,等.一种改进的漆酶酶活检测方法[J].华南理工大学学报:自然科学版,2003,31(12):46-50.He Wei,Zhan Huai-yu,Wang Xi-wen,et al.An improved spectrophotometric procedure for the laccase assay[J].Journal of South China University of Technology:Natural Science Edition,2003,31(12):46-50.
[20]王习文,詹怀宇,何为.金属离子对漆酶活性的影响[J].中华纸业,2003,24(6):33-35.Wang Xi-wen,Zhan Huai-yu,He Wei.Effect of metal ions on the laccase activity[J].China Pulp and Paper Industry,2003,24(6):33-35.

