TLR4在细菌性肺炎老龄大鼠多器官损伤中的表达及意义
李建生 王守富 张慧俭 秦金利 李素云 余海滨 王 峰 李 亚 刘四化
(河南中医学院老年医学研究所,河南 郑州 450008)
Toll样受体4(TLR4)是近年来逐渐明确的模式识别受体,主要介导内毒素(LPS)信号从细胞外至细胞内的跨膜转导,体内外实验表明其表达量与前炎症因子释放量直接相关〔1,2〕。过度炎症反应则导致细胞组织损伤,引起脏器功能障碍或衰竭。而有关TLR4在老年多器官功能障碍综合征(MODS)发病中所起作用研究较少,本实验旨在进一步探讨TLR4在老年感染性多器官损伤发病中的意义。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级SD老龄雄性大鼠(21月龄),55只,体重(550±70)g;SD青年雄性大鼠(6月龄),25只,体重(200±20)g,均由河南省实验动物中心提供,合格证号:XK20050001。
1.1.2 试剂 肺炎克雷伯杆菌由中国生物制品检验鉴定所提供,种系号:K46114,使用前用无菌生理盐水稀释至1.2×1010cfu/ml。RT-PCR相关试剂:Trizol为Invitrogen公司提供,批号:1334257。RT-PCR一步法试剂盒为宝生物工程(大连)有限公司提供,批号:BK3601。TLR4、脂多糖结合蛋白(LBP)、亲免疫性蛋白(CD14)和白介素受体相关激酶(IRAK-1)mRNA及内参由上海博尚生物技术有限公司合成,订单号:70714600,70614601。免疫组织化学抗体:TLR4和核转移因子(NF-κB)单克隆抗体由武汉博士德生物工程有限公司提供,批号:BA1717和BA0610。琼脂糖由英国OXOID LIMITED BASINGSTOKE提供,批号:889970-02。
1.2 方法
1.2.1 模型与分组 按李建生等〔3〕报道的方法复制大鼠多器官损伤模型。模型成功标准参照胡森等主编的《多器官功能障碍综合征》提出的动物MODS时器官功能障碍分期诊断及评分标准〔4〕。老龄大鼠35只分为2组,老龄对照组10只、老龄模型组25只;青年大鼠25只分为2组,青年对照组10只、青年模型组为15只。造模48 h后处死动物。无菌留取动物肺、心、小肠组织进行TLR4信号通路相关分子基因表达检测。
1.2.2 TLR4信号通路主要指标检测
1.2.2.1 TLR4、LBP、CD14及IRAK-1 mRNA表达的检测 采用RT-PCR技术测定 TLR4、LBP、CD14及 IRAK mRNA表达。TLR4引物序列 (扩增片段长度为560 bp):5'-TCATCAGTGTATCGGTGGTC-3'(上游),5'-TTTCATCTGGATTCAAGGCT-3'(下游)。LBP引物序列(扩增片段为789 bp):5'-CAAACTCTGCCAGTCACA-3'(上游),5'-GGACATTGGCACCCAAGT-3'(下游)。CD14引物序列(扩增片段为468 bp):5'-GTTGCTGTTGCCTTTGAC-3'(上 游),5'-AGCCAGGTATCCGTTCTT-3'(下游)。IRAK-1引物序列(扩增片段长度为243 bp):5'-CATGTGCCTACTGCCTGCTA-3'(上游),5'-ACCCTGGGTGACTTGTGAAG-3'(下游)。3'-磷酸甘油脱氢酶(GAPDH)引物序列(扩增片段长度为309 bp):5'-TCCCTCAAGATTGTCAGCAA-3'(上游),5'-AGATCCACAACGGATACATT-3'(下游)。应用 Trizol试剂,提取肺、心、小肠组织总RNA,RNA经电泳证实28 S亚基为18 S亚基的2倍,且A260/A280≥1.8。按TaKaRa RT-PCR一步法试剂盒说明书配制RT-PCR反应体系。反应条件为:50℃逆转录反应 30 min,94℃预变性 3 min;94℃ 35 s,55℃ 35 s,72℃55 s,30个循环;72℃延伸7 min。取5 μl PCR产物经2.0%琼脂糖凝胶电泳观察,采用Silver UVI proGA凝胶成像系统成像,进行半定量分析,通过目的基因与内参对照的积分光密度比值表示mRNA相对表达量。
1.2.2.2 TLR4、TRAF6和NF-κB活性检测 采用免疫组织化学(SP)法检测。免疫组化染色结果分析方法:光镜下观察,在400倍视野下,细胞膜、细胞浆呈棕色为免疫组化阳性。以光镜观察,用Image-Pro Plus 5.1专业图像采集与分析系统采集图像,并进行半定量分析。每张切片随机选取不重叠的5个视野拍照,测定其平均光密度值及阳性细胞数,取其平均值代表各细胞因子的表达水平。
1.3 统计学方法 应用SPSS13.0统计分析软件,计量资料用±s表示,各组间比较用单因素方差分析,不符合正态分布者进行数据转化后比较。
2 结果
2.1 各组大鼠脏器组织LBP mRNA表达变化 老龄模型组和青年模型组肺、心、小肠组织LBP mRNA表达分别较老龄对照组和青年对照组明显增强(P<0.01,P<0.05),老龄模型组肺、心组织表达又强于青年模型组(P<0.01,P<0.05)。见表1。
2.2 各组大鼠脏器组织CD14 mRNA表达变化 老龄模型组和青年模型组肺、心、小肠组织CD14mRNA表达分别较老龄对照组和青年对照组明显增强(P<0.01,P<0.05),老龄模型组肺、小肠组织则强于青年模型组(P<0.01,P<0.05)。见表2。2.3 各组大鼠脏器组织TLR4 mRNA表达变化 老龄模型组和青年模型组肺、心、小肠组织TLR4 mRNA表达分别较老龄对照组和青年对照组明显增强(均P<0.01)。见表3。
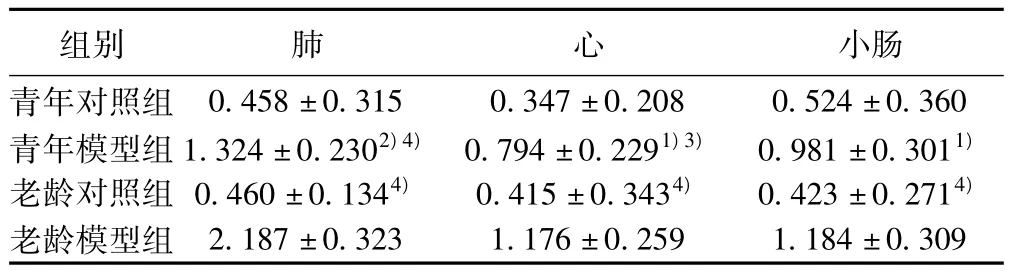
表1 各组大鼠肺、心和小肠组织LBP mRNA的表达(x ± s,n=10)
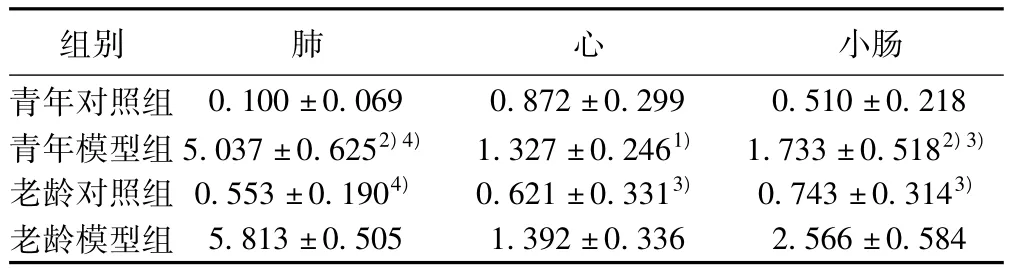
表2 各组大鼠肺、心和小肠组织CD14 mRNA的表达(x ± s,n=10)
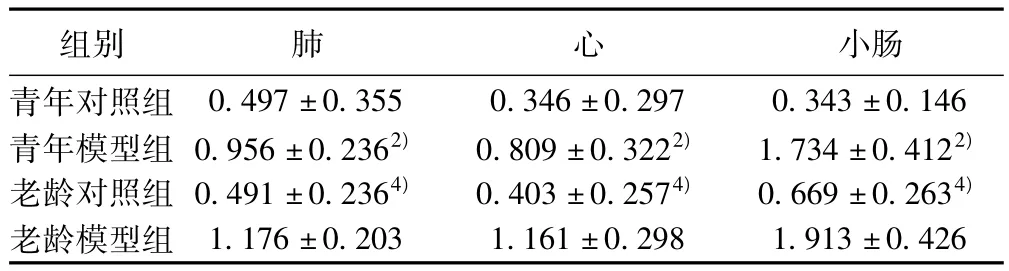
表3 各组大鼠肺、心和小肠组织TLR4 mRNA表达变化(x ± s,n=10)
2.4 各组大鼠脏器组织TLR4蛋白表达变化 老龄模型组和青年模型组肺、心、小肠组织TLR4蛋白表达分别较老龄对照组和青年对照组明显增高(均P<0.01),老龄模型组肺、心组织TLR4光密度和小肠组织阳性细胞数则较青年模型组显著增高(P<0.05或P<0.01)。见表4。
2.5 各组大鼠脏器组织IRAK-1 mRNA表达变化 老龄模型组和青年模型组肺、心、小肠组织IRAK-1 mRNA表达分别较老龄对照组和青年对照组明显增强(均P<0.01),老龄模型组心组织表达则强于青年模型组(均P<0.05),差异均有统计学意义。见表5。
表4 各组大鼠肺、心、小肠组织TLR4表达变化(± s,n=10)
组别 肺阳性细胞数 平均光密度心阳性细胞数 平均光密度小肠阳性细胞数 平均光密度青年对照组 19.50±16.51 0.340±0.047 18.00±13.62 0.246±0.010 7.29±6.98 0.230±0.167青年模型组 175.96±21.102) 0.442±0.03672)3) 194.56±22.102) 0.324±0.0232)4) 146.10±21.352)3) 0.568±0.2422)老龄对照组 29.25±21.194) 0.421±0.0354) 21.57±12.684) 0.284±0.0104) 17.33±13.674) 0.298±0.2884)老龄模型组 173.53±22.00 0.584±0.025 190.78±19.65 0.410±0.017 180.94±20.62 0.692±0.230
2.6 各组大鼠脏器组织TRAF6蛋白表达变化 老龄模型组和青年模型组肺、心、小肠组织TRAF6蛋白表达分别较老龄对照组和青年对照组明显增高(均P<0.01),老龄模型组心脏组织TRAF6阳性细胞数较青年模型组显著增高(均P<0.05)。见表6。
2.7 各组大鼠脏器组织NF-κB蛋白表达变化 老龄模型组和青年模型组肺、心、小肠组织NF-κB蛋白表达分别较老龄对照组和青年对照组明显增高(P<0.01或P<0.05),老龄模型组肺、心、小肠组织蛋白表达阳性细胞数和心组织积分光密度显著高于青年模型组(均P<0.01)。见表7。
表5 各组大鼠肺、心和小肠组织IRAK-1 mRNA表达变化(± s,n=10)
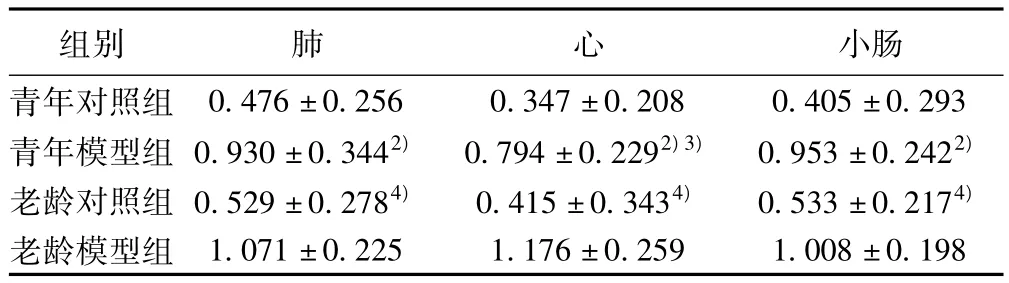
表5 各组大鼠肺、心和小肠组织IRAK-1 mRNA表达变化(± s,n=10)
组别 肺 心 小肠青年对照组0.476±0.256 0.347±0.208 0.405±0.293青年模型组 0.930±0.3442) 0.794±0.2292)3) 0.953±0.2422)老龄对照组 0.529±0.2784) 0.415±0.3434) 0.533±0.2174)老龄模型组1.071±0.225 1.176±0.259 1.008±0.198
表6 各组大鼠肺、心、小肠组织TRAF6表达变化( ± s,n=10)
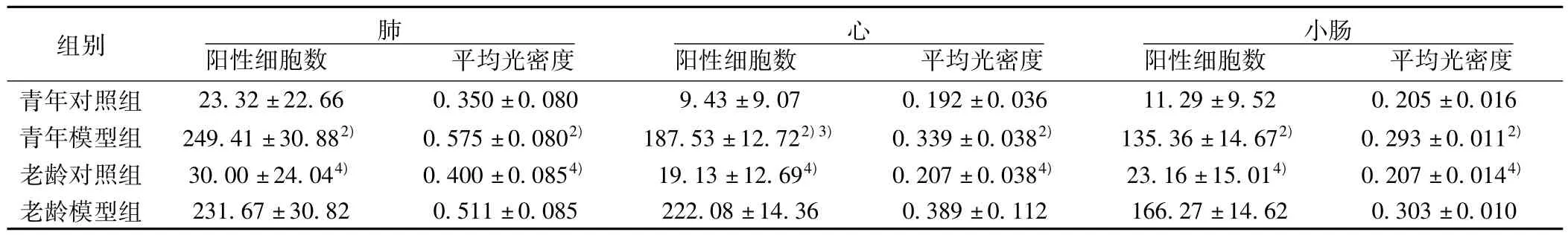
表6 各组大鼠肺、心、小肠组织TRAF6表达变化( ± s,n=10)
组别 肺阳性细胞数 平均光密度心阳性细胞数 平均光密度小肠阳性细胞数 平均光密度青年对照组 23.32±22.66 0.350±0.080 9.43±9.07 0.192±0.036 11.29±9.52 0.205±0.016青年模型组 249.41±30.882) 0.575±0.0802) 187.53±12.722)3) 0.339±0.0382) 135.36±14.672) 0.293±0.0112)老龄对照组 30.00±24.044) 0.400±0.0854) 19.13±12.694) 0.207±0.0384) 23.16±15.014) 0.207±0.0144)老龄模型组 231.67±30.82 0.511±0.085 222.08±14.36 0.389±0.112 166.27±14.62 0.303±0.010
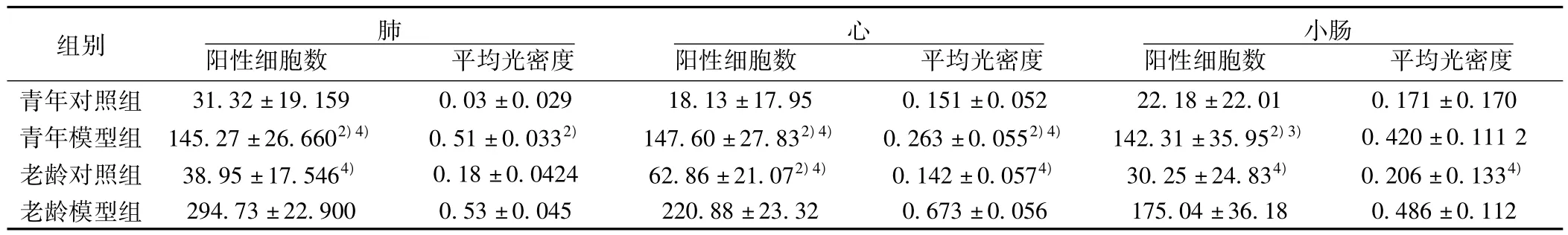
表7 各组大鼠肺、心、小肠组织NF-κB表达变化(x ± s,n=10)
3 讨论
老年MODS的发病诱因以感染最为常见,引起感染致病菌主要是革兰阴性菌,而革兰阴性菌的主要致病因子是LPS。TLR4是LPS的跨膜受体,其信号转导通路由主要LBP、CD14、TLR4、IRAK-1、TRAF6和NF-κB等相关分子组成,它介导了LPS诱导的机体炎症反应。TLR4在老年MODS发病中变化规律和作用则需进一步明确。
肺炎克雷伯菌为革兰阴性杆菌,LPS为其主要致病因子,LPS需通过LBP而发挥致炎作用。LBP是一种由肝脏合成和分泌的血浆蛋白,LBP与LPS在炎症反应急性期血清或单纯LBP与LPS在体外混合后可以高亲和力结合,借以将LPS传递给CD14,形成CD14-LPS复合体。LPS正是借助LBP的转移、递呈和催化作用而激活下游分子的〔5,6〕。本研究表明,模型组肺、心、小肠组织LBP、CD14 mRNA表达较对照组明显增强,增强高的达5倍多;并且老龄模型肺、心组织LBP mRNA表达和肺、小肠组织CD14 mRNA表达又较青年模型增高显著,提示LBP和CD14参与了感染性多器官损伤。LBP、CD14表达增强则进一步激活下游分子,介导炎症反应。Bochkov〔7〕等应用氧化磷脂阻断LPS、LBP和CD14,抑制了LPS诱导的NF-κB介导的炎症基因表达上调。在注入LPS的小鼠,氧化磷脂抑制炎症并保护小鼠,使之避免死于致命的内毒素休克。可见,LBP和CD介导了老年感染性多器官损伤。
TLR是近几年发现的一类天然免疫受体,其分布十分广泛,主要表达于单核细胞、巨噬细胞、树突状细胞、多形核细胞、T淋巴细胞、B淋巴细胞及自然杀伤细胞等表面,属于模式识别受体,可对病原体相关分子模式进行识别、结合,并引发一系列信号转导,进而导致炎性介质的释放,在天然免疫防御中起着重要作用,并最终激活获得性免疫系统〔8,9〕。目前,TLR家族成员至少有11个(TLR1~TLR11),其中LPS引起的组织损伤主要有TLR4介导,国外有不少学者认为许多疾病与TLR4有着密切关系。本实验结果表明肺、心、小肠组织TLR4表达老龄、青年模型组表达较对照组明显增强,提示TLR4参与了感染性多器官损伤。既往研究显示LPS引起急性肺损伤时,肺巨噬细胞TLR4 mRNA表达明显增强,肿瘤坏死因子(TNF-α)分泌增多,说明TLR4参与肺组织炎症反应,其机制可能是通过增加TLR4的表达而使TNF-α等炎症因子分泌增多所致。G-菌LPS性休克在感染性休克中大致占50%,在对G-菌及其产物的识别中,TLR4起着非常重要的作用。当TLR4与配体结合后,激活NF-κB并上调TNF等细胞因子的表达,增强机体的炎性反应,达到杀伤病原体的目的。但是过强的炎性反应将加重组织器官的损害,严重时产生全身炎症反应综合征(SIRS),最终导致G-菌LPS性休克〔10〕。Ruemmele等〔11〕报道肠上皮细胞在 TLR4调节下分泌内源性TNF,引起肠炎。可见,TLR4参与了老年感染性多器官损伤,并在其中发挥了非常重要的作用。实验结果还表明,老龄模型肺、心、小肠组织TLR4蛋白表达较青年模型明显增强,这可能是导致老年脏器损伤较青年重的机制之一。由于TLR4表达较强,其激活NF-κB和c-Jun氨基末端激酶(JNK)更明显,结果导致更多炎性因子和炎症介质分泌,引起组织损伤。
最近研究表明,IRAK-1在IL-1信号转导中起重要的调控作用,这种早期信号分子为白细胞介素(IL-1)活化NF-κB所必需〔12〕。TRAF6是多种生理过程的信号调节分子,先天性和获得性免疫、骨代谢、淋巴结发育、乳腺发育甚至皮肤和中枢神经系统的发育无不与TRAF6密不可分。作为接头分子,激活NF-κB和JNK〔13〕。本研究显示肺、心、小肠组织模型组IRAK-1和TRAF6 mRNA表达较对照组明显增强,老龄心组织表达较青年更为显著,提示IRAK-1和TRAF6作为TLR下游分子参与了老年多脏器损伤的病理生理过程。
NF-κB 通过调控编码细胞因子 (如 IL-1、IL-2、IL-6、TNF-α)、黏附分子、急性期蛋白和多种酶类(如诱导型一氧化氮合成酶、环氧化酶)基因的表达,进而参与炎症反应放大和延续,在脓毒症的发生过程中起非常关键作用〔14,15〕。临床观察显示,术后发生MODS患者中性粒细胞NF-κB活性显著增高。实验研究用NF-κB抑制剂能显著抑制脓毒性休克大鼠肺组织一氧化氮合酶基因表达,并呈剂量依赖性;同时可明显减轻LPS引起的动脉血压下降,表明NF-κB活化参与了机体失控性炎症反应与器官损害的病理生理过程〔16〕。本实验结果显示肺、心、小肠组织模型组NF-κB表达较对照组明显增高,说明NF-κB参与细菌性肺炎所致之多器官损伤,并发挥了重要作用。由于老龄大鼠脏器组织NF-κB的活性较青年增高显著,可能导致更多的炎症因子和炎症介质合成和释放,结果脏器损伤老年较青年为重。当然,老年脏器损伤重,亦可能与增龄因素有关。
1 Hoshino K,Takeuchi O,Kawai T,et al.Cutting edge:Toll-like receptor 4(TLR4)-deficient mice are hyporesponsive to lipopolysaccharide:evidence for TLR4 as the Lpsgene product〔J〕.J Immunol,1999;162(7):3749-52.
2 Tsujimoto H,Ono S,Efron PA,et al.Role of toll-like receptors in the development of sepsis〔J〕.Shock,2008;29(3):315-21.
3 李建生,王守富,秦金利,等.克雷伯杆菌肺炎老龄大鼠多器官损伤模型的建立〔J〕.中国危重病急救医学,2009;21(4):226-9.
4 胡 森,盛志勇.多器官功能障碍综合征〔M〕.北京:科学出版社,1999:186-204.
5 Frantz S,Ertl G,Bauersachs J.Mechanisms of disease:Toll-like receptors in cardiovascular disease〔J〕.Nat Clin Pract Cardiovasc Med,2007;4(8):444-54.
6 Verstak B,Hertzog P,Mansell A.Toll-like receptor signalling and the clinical benefits that lie within〔J〕.Inflamm Res,2007;56(1):1-10.
7 Bochkov VN,Kadl A,Huber J,et al.Protective role of phospholipid oxidation products in endotoxin_induced tissue damage〔J〕.Nature,2002;419(6902):77-81.
8 Akira S.Mammalian Toll-like receptors〔J〕.Curr Opin Immuno1,2003;15(2):5-11.
9 Akira S,Uematsu S,Takeuehi O.Pathogen recognition and innate immunity〔J〕.Cell,2006;124(4):783-801.
10 Knuefermann P,Nemoto S,Baumgarten G,et al.Cardiac inflammation and innate immunity in septic shock:is there a role for Toll-like receptors〔J〕?Chest,2002;121(4):1329-36.
11 Ruemmele FM,Beaalieu JF,Dionne S,et al.Lipopolysaccharide modulation of normal enterocyte turnover by Toll-like receptors is mediated by endogenously produced tumour necrosis factor alpha〔J〕.Gut,2002;51(6):842-8.
12 Huang YS,Misior A,Li LW.Novel role and regulation of the interleukin-1 receptorassocia-ted kinase(IRAK)family proteins〔J〕.Cell Mol Immunol,2005;2(1):36-9.
13 Zapata JM,Lefebvre S,Reed JC.Targeting TRAfs for therapeutic intervention〔J〕.Adv Exp Med Biol,2007;597:188-201.
14 Hayden MS,Ghosh S.Shared principles in NF-κB signaling〔J〕.Cell,2008;132(3):344-62.
15 Tergaonkar V.NFkappaB pathway:a good signaling paradigm and therapeutic target〔J〕.Int J Biochem Cell Biol,2006;38(10):1647-53.
16 蒋建新,姚咏明,郑 江.细菌内毒素基础与临床〔M〕.北京:人民军医出版社,2004:129.

