不同成因类型黄铜矿细菌浸出钝化
傅开彬,林海,莫晓兰,董颖博,汪涵
(北京科技大学 土木与环境工程学院,北京,100083)
黄铜矿属于原生矿,储量丰富,就化学和细菌浸出而言,是最难处理的硫化铜矿物[1]。常温下细菌浸出,速率慢,浸出率低,一般在20%~30%之间[2]。通常认为钝化是黄铜矿浸出率低的原因,在细菌浸出过程中,所谓钝化是指矿物表面形成阻碍层,限制了细菌、营养物质、氧化剂与矿物接触,反应产物难以离开矿物表面,从而抑制浸出继续进行的现象[3]。目前,许多研究者提出了钝化黄铜矿生物浸出的几种可能阻碍层,有黄钾铁矾层、硫层、中间硫化产物层(多硫化物)和氢氧化铁层等,其中以前3种观点最为普遍。硫阻碍论者[4−6]认为在矿物表面形成的元素硫及其多聚物阻止了黄铜矿浸出;黄钾铁矾论者[7−9]认为含铁羟基化物,特别是覆盖在矿物表面的黄钾铁矾才是导致黄铜矿浸出率低的原因,其沉淀直接减少了具有氧化作用的Fe3+,使其浓度降低;多硫化物论者[10−12]认为,黄铜矿浸出率的下降,是由于矿物表面铜铁扩散速率不同,铁优先浸出,形成金属缺陷的多硫化物层阻碍了Cu2+和Fe2+的传输,同时也减缓了反应电子的传递。对钝化层认识不一致,与影响黄铜矿生物浸出的因素多、关系复杂有关,也与矿物成因、浸出条件和研究手段等有关[13]。黄铜矿成因类型与其在细菌浸出过程中的钝化形式之间关系的研究较少。本文作者利用自主分离的嗜酸氧化亚铁流杆菌 LD-1为浸矿菌种,采用X线衍射技术(XRD)、扫描电镜(SEM)和X线光电子能谱(XPS)等技术手段,研究了不同成因类型黄铜矿(斑岩型、黄铁矿型)的细菌浸出及其钝化现象,以了解黄铜矿成因类型与钝化形式之间的联系。
1 原料及研究方法
1.1 原料
试验用的纯矿物购自浙江大学地质标本厂,黄铁矿型黄铜矿源自浙江绍兴漓渚铁矿,斑岩型黄铜矿来自江西德兴铜矿。将矿石清洗脱泥,自然晾干,无污染条件下进行破碎,然后手选挑纯。挑选出来的纯矿物在瓷球磨机内湿磨至粒度小于0.074 mm,过滤,冷冻干燥后,磨口瓶保存备用,送XPS检测的样品采用氮气封存。
对样品进行 X线衍射和化学成分分析(质量分数)。结果表明:黄铁矿型黄铜矿主要含有黄铜矿,以及少量黄铁矿,铜品位为27.38 %,铁品位为28.35%,硫品位为33.31%;斑岩型黄铜矿主要含有黄铜矿,以及少量黄铁矿和石英,铜品位为 27.88%,铁品位为28.29%,硫品位为32.36%。依据化学分析结果计算纯度,黄铁矿型黄铜矿为 79.22%,斑岩型黄铜矿为80.62%。
1.2 菌种和培养基
试验菌种嗜酸氧化亚铁流杆菌 LD-1采自湖北某矿山,经过筛选、培养、驯化和分离得到,菌种最佳培养条件为:摇床转速160 r/min,温度30 ℃,pH 2,采用改进的4.5 K培养基,以硫酸亚铁为能源物质传代培养,其配方如下:(NH4)2SO42.0 g,KCl 0.1 g,K2HPO40.25 g,MgSO4·7H2O 0.25 g,Ca(NO3)20.01 g,FeSO4·7H2O 22.2 g,H2O 1 000 mL。用 10%的稀硫酸调节培养基pH。
1.3 细菌浸出试验
浸出试验采用250 mL三角瓶为容器,瓶内装入100 mL溶液,矿浆浓度为20 g/L,接种量为6×108个。用pH为2.0稀硫酸预处理,10%的稀硫酸溶液调节pH至2.0,待pH稳定,接入驯化后对数生长期的菌LD-1。接种后,在恒温空气振荡培养箱中进行培养,转速为160 r/min,温度为30 ℃。每隔4 d取样1 mL,测试浸出液中Cu2+的质量浓度,取样前用蒸馏水补足蒸发掉的水分,测试消耗的液量用相应的溶液补充,保证溶浸液总体积不变。
浸渣用pH为2的稀硫酸反复调浆清洗,最后用去离子水于3 000 r/min离心处理,冷冻干燥,氮气封存后立即送检测。
1.4 测试分析方法
用碘量法测定浸出液中Cu2+质量浓度;细菌用血球计数板在显微镜下直接计数;用X线衍射技术(XRD)分析浸出前、后黄铜矿的矿物组成;用扫描电镜(SEM)观察矿物表面的浸蚀特征;用 X线光电子能谱(XPS)分析黄铜矿表面层物质组成。
2 结果及讨论
2.1 铜浸出速率变化
利用软件 origin8将浸出液中 Cu2+质量浓度对时间求导,得到Cu2+浸出速率变化如图1所示。由图1可见:2种黄铜矿浸出速率变化趋势相似,都是先升高,后降低,最后接近于0,但相差较大。试验初期,浸出速率都很慢,但斑岩型黄铜矿浸出速率比黄铁矿型黄铜矿浸出速率大,且增长迅速,浸出14 d时,先达到最大值,为6.3×10−2g/(L·d),在其浸出速率开始降低时,黄铁矿型黄铜矿浸出速率开始增长,到第28 d时,上升达到最大,为27.3×10−2g/(L·d),试验后期,浸出速率都逐渐接近于0。
在细菌浸出过程中,黄铜矿浸出速率下降是由于在矿物表面逐渐形成了钝化层[14],但两类黄铜矿表面形成钝化层的性质不同,斑岩型黄铜矿表面钝化层比黄铁矿型黄铜矿表面钝化层形成速率更快,且对浸出的阻碍能力更强。
2.2 浸渣XRD分析
2种不同成因类型黄铜矿浸渣XRD分析结果如图2和3所示。从图2可以看出:浸渣中主要含有黄铜矿、硫的多聚物S8、硫砷铜矿和黄铁矿等,与原矿相比出现硫多聚物。图3结果表明:浸渣中主要含有黄铜矿、硫化铜铁(Cu18.32Fe15.9S32)、硫砷铜矿和辉铜矿(Cu2S)等,与原矿相比黄铁矿基本浸蚀完全,新增硫化铜铁和辉铜矿。XRD分析结果表明:2种不同成因类型的黄铜矿浸出效果不同,浸渣成分也不一样,其反应途径应该有所区别。
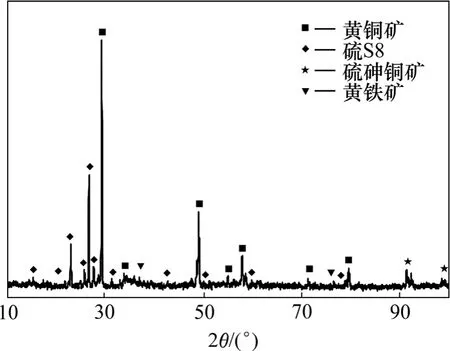
图2 黄铁矿型黄铜矿浸渣的XRD谱Fig.2 XRD pattern of pyritic chalcopyrite leaching residue

图3 斑岩型黄铜矿浸渣的XRD谱Fig.3 XRD pattern of porphyry chalcopyrite leaching residue
张在海等[15]研究 CuFeS2细菌氧化中的矿物转化过程,认为其细菌氧化可能按如下顺序先后产生中 间 产 物 : CuFeS2→Cu9Fe9S16→CuFeS1−x→CuS2→Cu9S5→Cu2S→CuS→Cu2O(CuCl,CuCl2,Cu2OCl2)→Cu3SO4(OH)4→CuSO4。Scott[16]将辉铜矿制成电极,研究了辉铜矿的细菌氧化过程,测定由Cu2S到CuS的中间反应,它们反应顺序如下:Cu2S→Cu1.97S→Cu1.8S→Cu1.6S→Cu1.4S→Cu1.12S→CuS。这些中间反应极快地完成,如Cu2S到Cu1.8S仅用3.5 min就完全转化。因此,CuFeS2→Cu2S是黄铜矿细菌浸出的关键,该阶段铜铁比例为1:1,铜铁的溶解速率相同。而斑岩型黄铜矿浸渣中出现了硫化铜铁Cu18.32Fe15.9S32,则说明其矿物转化过程并没有完全按照上述模型进行,矿物表面铜、铁离子浸出速率有差异,铁离子迁移速率较快。
2.3 浸渣SEM-EDS分析
浸渣表面的扫描电镜照片和能谱分析结果如图4和5所示。从图4可以看出:黄铁矿型黄铜矿浸渣表面浸蚀现象明显,有颗粒状物质,结构疏松,干燥后出现裂纹,能谱分析表明,硫峰很高,铜和铁峰较低,结合 XRD分析结果,表面应该是硫或者硫的多聚物。由图5可见:斑岩型黄铜矿浸渣颗粒表面光滑致密,有少量的浸蚀坑。从图5(b)可以看出:与原矿相比,表面铜、铁和硫的峰都有所降低,而相对含量发生了改变,铜含量上升,铁含量下降。通过分析可以看出:斑岩型黄铜矿浸渣表面致密结构的钝化能力强于黄铁矿型黄铜矿表面以硫为主的疏松阻碍层的钝化能力。

图4 黄铁矿型黄铜矿浸渣SEM-EDS结果Fig.4 SEM-EDS results of pyritic chalcopyrite leaching residue

图5 斑岩型黄铜矿浸渣SEM-EDS结果Fig.5 SEM-EDS results of porphyry chalcopyrite leaching residue
2.4 浸渣XPS分析
为了进一步确认黄铜矿浸渣表面阻碍层的物质组成,利用X线光电子能谱分析原矿和浸渣表面铜、铁和硫的结合能和含量变化。
采用英国Kratos公司生产的AXIS Ultra DLD型XPS谱仪。选择Al Kα靶作为激发源,电压为15 kV,功率为250 W。谱峰均以样品中的C 1s峰(Eb=284.6 eV)为参考进行校正,以消除荷电效应的影响。
2.4.1 黄铁矿型黄铜矿XPS分析
黄铁矿型黄铜矿原矿和浸渣表面铜、铁和硫的X线光电子能谱分析结果如图6所示。从图6可以看出:黄铁矿型黄铜矿浸渣表面铜、铁和硫的含量与原矿相比发生了较大的变化,浸渣表面铜峰完全消失,铁和硫峰强度降低。浸出前后矿物表面铜、铁和硫含量见表1。
表1中数据表明:黄铁矿型黄铜矿浸渣表面铜的相对含量为0,铁含量较低,为19.74%,以硫为主,为80.26%。图6(c)所示为S 2p谱。由图6(c)可见:与细菌作用后,矿物表面S 2p峰从161.8~162.7 eV上升到163.7 eV,主要是因为原矿中含有黄铜矿(162.7 eV)和少量黄铁矿(161.8 eV),但双峰不明显,低价态的硫被氧化为硫单质或多聚物(163.7 eV)沉淀在矿物表面,所以,浸渣表面出现S0峰。
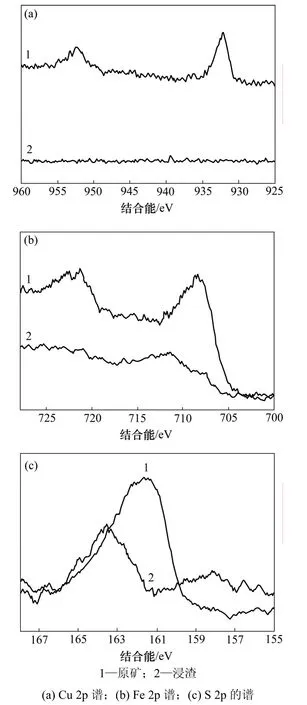
图6 浸出前和浸出后黄铁矿型黄铜矿表面的XPS谱Fig.6 XPS spectra of pyritic chalcopyrite before and after bio-leaching

表1 浸出前、后黄铁矿型黄铜矿表面铜、铁和硫含量(质量分数)Table1 Content of Cu, Fe and S on surface of pyritic chalcopyrite before and after bio-leaching %
图6(a)所示为黄铁矿型黄铜矿表面Cu 2p谱。原矿表面Cu的强峰在932.4 eV处,表示3d轨道没有完全充满,处于激发态,这与纯的Cu(Ⅰ)不匹配,Todd等[17]通过黄铜矿、铜蓝和辉铜矿表面铜结合能的比较,认为黄铜矿中铜离子应为+2价,结构式为:Cu2+Fe2+S2,铁 L-边光谱分析结果也证实了这一结构的正确性,浸渣表面铜被单质硫或多聚物覆盖,没有检测到Cu 2p峰。原矿表面Fe(Ⅱ)(708.9 eV)(见图6(b))被氧化为Fe(Ⅲ)(711.8 eV),少量吸附或夹杂在硫中。
综上所述,黄铁矿型黄铜矿浸渣表面以硫单质为主,吸附少量Fe3+,其表面阻碍层应为硫及其多聚物。
2.4.2 斑岩型黄铜矿XPS分析
斑岩型黄铜矿X线光电子能谱分析结果如图7所示。从图7可以看出:浸出前和浸出后斑岩型黄铜矿表面铜、铁和硫相对含量发生了变化,铜峰向低漂移,铁峰向高处移动,硫峰强度增大,峰位基本不变。3种元素含量见表2。
从表2中可以看出:与原矿相比,浸渣中铜的相对含量增加至27.0%,铁减少为 13.13%,硫含量增加为59.87%。
从图7(a)可知:浸渣表面铜峰强度升高,原矿表面Cu(Ⅱ)的结合能为933.2 eV,细菌浸出后,表面形成Cu(Ⅰ),而结合能降低为932.2 eV,结合能变化规律符合 Hiroyoshi等[18]提出黄铜矿浸出的 2步溶解模型。
图7(b)所示为斑岩型黄铜矿表面Fe 2p谱。从图7(b)可知:浸渣表面铁的强度降低,结合能向高偏移,价态发生了改变,原矿表面Fe(Ⅱ)(708.8 eV)被氧化成 Fe(Ⅲ)(711.8 eV),使 Fe(Ⅲ)峰升高,Fe(Ⅱ)峰强度降低。
然而,细菌浸出后,硫结合能(见图7(c))没有变化,只是强度升高,S 2p双峰更为明显,主要是因为浸渣表面存在黄铜矿(162.7 eV)和辉铜矿Cu2S(161.8 eV)。
通过以上分析,可以看出浸渣表面含有Cu+,Fe3+和S2−,由这些离子组成的具有特殊结构的富铜贫铁层阻碍了斑岩型黄铜矿的浸出。
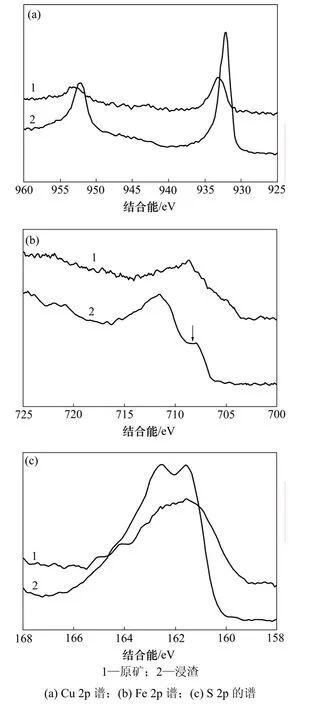
图7 浸出前和浸出后斑岩型黄铜矿表面XPS谱Fig.7 XPS spectra of porphyry chalcopyrite before and after bio-leaching
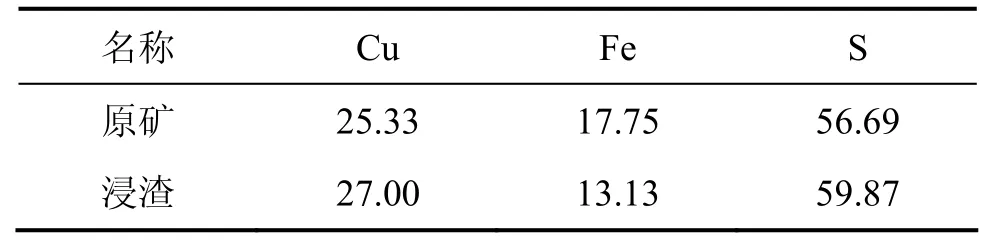
表2 浸出前和浸出后斑岩型黄铜矿表面铜、铁和硫含量(质量分数)Table2 Content of Cu, Fe and S on surface of porphyry chalcopyrite before and after bio-leaching %
3 结论
(1)2种黄铜矿浸出速率变化规律相似,都是先升高,后降低,最后接近于0,但差异较大。试验初期,斑岩型黄铜矿浸出速率比黄铁矿型黄铜矿浸出速率大,且增长迅速,14 d时,先达到最大值 6.3×10−2g/(L·d),在其浸出速率开始降低时,黄铁矿型黄铜矿浸出速率开始增长,到28 d时,达到最大值,为27.3×10−2g/(L·d)。
(2)在细菌浸出过程中,黄铜矿浸出速率下降是由于在矿物表面逐渐形成了钝化层,但两类黄铜矿表面形成钝化层的性质不同,斑岩型黄铜矿表面钝化层比黄铁矿型黄铜矿钝化层形成速度更快,且对浸出的阻碍能力更强。
(3)黄铁矿型黄铜矿浸渣中主要含有黄铜矿、硫多聚物S8、硫砷铜矿和黄铁矿等,与原矿相比,出现硫多聚物。斑岩型黄铜矿浸渣中主要含有黄铜矿、硫化铜铁Cu18.32Fe15.9S32、硫砷铜矿和辉铜矿等,黄铁矿被完全浸蚀,产生了硫化铜铁和辉铜矿等。
(4)黄铁矿型黄铜矿浸渣表面浸蚀现象明显,结构疏松;斑岩型黄铜矿浸渣颗粒表面光滑致密,有少量浸蚀坑。
(5)通过X线光电子能谱可以确定,黄铁矿型黄铜矿浸渣表面阻碍层应为硫及其多聚物;而斑岩型黄铜矿浸渣表面含有Cu2+,Fe3+和S2−,由这些离子组成的具有特殊结构的富铜贫铁层阻碍了浸出反应继续进行。
[1]Arce E M, Gonzalez I.A comparative study of electrochemical behavior of chalcopyrite, chalcocite and bornite in sulphuric acid solution[J].International Journal of Mineral Processing, 2002,67(1/2/3/4): 17−28.
[2]Rodriques Y, Ballester A, Blazques M L, et al.New information on the pyrite bioleaching mechanism at low and high temperature[J].Hydrometallurgy, 2003, 71(1/2): 37−46.
[3]Stott M B, Watling H R, Franzmann P D, et al.The role of iron-hydroxy precipitates in the passivation of chalcopyrite during bioleaching[J].Minerals Engineering, 2000, 13(10):1117−1127.
[4]Dutrizac J E.Elemental sulphur formation during the ferric sulphate leaching of chalcopyrit[J].Canadian Metallurgical Quarterly, 1989, 28(4): 337−344.
[5]Klauber C, Parker A, Bronswijk W V, et al.Sulphur speciation of leached chalcopyrite surfaces as determined by X-ray photoelectron spectroscopy[J].International Journal of Mineral Processing, 2001, 62(1/4): 65−94.
[6]Bevilaqua D, Diezperez I, Fugivara C S, et al.Oxidative dissolution of chalcopyrite by Acidithiobacillus ferrooxidans analyzed by electrochemical impedance spectroscopy and atomic force microscopy[J].Bioelectrochemistry, 2004, 64(1): 79−84.
[7]Sandstrom A, Shchukarev A, Paul J.XPS characterisation of chalcopyrite chemically and bioleached at high and low redox potential[J].Minerals Engineering, 2005, 18(5): 505−515.
[8]Third K A, Cordruwisch R, Watling H R.The role of iron-oxidizing bacteria in stimulation or inhibition of chalcopyrite bioleaching[J].Hydrometallurgy, 2000, 57(3):225−233.
[9]Parker A, Klauber C, Kougianos A, et al.An X-ray photoelectron spectroscopy study of the mechanism of oxidative dissolution of chalcopyrite[J].Hydrometallurgy, 2003, 71(1/2): 265−276.
[10]Parker A J, Paul R L, Power G P.Electrochemistry of the oxidative leaching of copper from chalcopyrite[J].Journal of Electroanalytical Chemistry, 1981, 118: 305−316.
[11]Acero P, Cama J, Ayora C.Kinetics of chalcopyrite dissolution at pH 3[J].European Journal of Mineralogy, 2007, 19(2): 173−182.
[12]Lazaro I, Nicol M J.The mechanism of the dissolution and passivation of chalcopyrite:an electrochemical study[C]//Young C, Alfantazi A M, Anderson C G, et al.Hydrometallurgy 2003.Warrendale, PA: The Minerals, Metals & Materials Society, 2003:405−417.
[13]舒荣波, 阮仁满, 温建康.黄铜矿生物浸出中钝化现象研究进展[J].稀有金属, 2006, 30(3): 395−400.SHU Rong-bo, RUAN Ren-man, WEN Jian-kang.Review on passivation of chalcopyrite during bioleaching process[J].Chinese Journal of Rare Metals, 2006, 30(3): 395−400.
[14]Klauber C.A critical review of the surface chemistry of acidic ferric sulphate dissolution of chalcopyrite with regards to hindered dissolution[J].International Journal of Mineral Processing, 2008, 86(1/2/3/4): 1−17.
[15]张在海, 王淀佐, 邓吉牛, 等.黄铜矿细菌转化与浸出机理探讨[J].中国工程学, 2005, 7(增刊): 266−268.ZHANG Zai-hai, WANG Dian-zuo, DENG Ji-niu, et al.Discuss on the bacterial transformation and leaching mechanism of chalcopyrite[J].Engineering Science, 2005, 7(S): 266−268.
[16]Scott D J.The mineralogy of copper leaching: Concentrates and heaps, copper’95[C]//Copper Hydrometallurgy Short Course.Santiago, 1995: 65.
[17]Todd E C, Sherman D M, Purton J A.Surface oxidation of chalcopyrite (CuFeS2)under ambient atmospheric and aqueous(pH 2-10)conditions: Cu, Fe L- and O K-edge X-ray spectroscopy[J].Geochimica et Cosmochimica Acta, 2003,67(12): 2137−2146.
[18]Hiroyoshi N, Miki H, Hirajima T, et al.A model for ferrous-promoted chalcopyrite leaching[J].Hydrometallurgy,2000, 57(1): 31−38.

