一种新型壳聚糖分离介质的制备
易 喻,崔国艳,王 鸿,李 敏,朱克寅,应国清
(1浙江工业大学药学院,浙江 杭州 310032,2杭州博林生物技术有限公司,浙江 杭州 310018)
研究开发
一种新型壳聚糖分离介质的制备
易 喻1,崔国艳1,王 鸿1,李 敏1,朱克寅2,应国清1
(1浙江工业大学药学院,浙江 杭州 310032,2杭州博林生物技术有限公司,浙江 杭州 310018)
以壳聚糖为载体、液体石蜡为分散介质、戊二醛为交联剂、Span80 为乳化剂,采用反相悬浮法制备壳聚糖微球,以环氧氯丙烷为活化剂、亚氨基二乙酸为螯合配基制备新型壳聚糖分离介质,并研究分离介质制备过程中各参数对壳聚糖分离介质性能的影响。确定最佳活化工艺为:40% DMSO/NaOH(0.6 mol/L)、ECH体积分数10%、反应温度40 ℃、反应时间4 h,测得环氧基修饰密度可达到0.15 mmol/g(gel);最佳螯合工艺:IDA(0.6 mol/L)/ NaOH(2.0 mol/L)混合液,反应时间为6 h,制备的新型壳聚糖分离介质对Cu2+吸附量达到172.787 g/g gel,壳聚糖分离介质含水率为45.60%,孔隙率为69.45% ,得到一种新型金属螯合层析填料。
壳聚糖;金属螯合层析填料;环氧氯丙烷
固定化金属螯合亲和层析(immobilized metal ion affinity chromatography,IMAC)是近二十年发展起来的一项新型分离技术。该法最早由 Porath等[1]提出,其主要是利用蛋白质表面的一些氨基酸,如组氨酸、色氨酸、赖氨酸等能和金属离子发生特殊的相互作用,从而对蛋白质加以分离。IMAC具有螯合介质制备简单方便、交换载量大、分离条件温和、通用性强、易于放大,特别是在蛋白的纯化过程中,其温和的洗脱条件,可较好的保持蛋白的生物学活性等优点,使得其应用越来越受到重视,将成为蛋白质纯化中最具潜力的层析方法[2-3]。
开发新型性能良好、适于蛋白质分离的固定化金属螯合分离介质具有重要的意义[4]。壳聚糖作为产量仅次于纤维素的天然高分子,是迄今为止发现的唯一天然碱性多糖,其分子链上丰富的羟基和氨基使其易于进行化学修饰而赋予多种功能[5],近年来由于其无毒性及较好的生物相容性和生物降解性[6],在医药、食品、环保、轻工、农业等方面获得广泛的应用[7]。如将壳聚糖制备成单分散的窄分布高分子微球,使壳聚糖和高分子微球的功能相结合,使其在蛋白分离中得到更大的应用[8]。
本文选用壳聚糖为基质载体、戊二醛为交联剂、环氧氯丙烷为活化剂、亚氨基二乙酸(IDA)为鳌和配基制备新型壳聚糖分离介质,并研究了制备过程中各因素对壳聚糖介质吸附性能的影响,从而确定出最佳的制备工艺。
1 材料与方法
1.1 材料
壳聚糖(脱乙酰度≥95%,浙江金壳生物化学有限公司,Mw为300 kDa)、冰乙酸、NaOH、液体石蜡、环己烷、戊二醛溶液(25%,体积比)、环氧氯丙烷、亚氨基二乙酸、二甲基亚砜等,试剂均为分析纯。
1.2 方法
1.2.1 壳聚糖介质的制备
(1)交联 将适量壳聚糖溶解在100 mL质量分数为2%的乙酸溶液中,室温下静置过夜,备用。于装有机械搅拌器及温度计的500 mL 三口瓶内,依次加入液体石蜡、环己烷和少许Span 80 ,搅拌0.5 h 后,加入上述壳聚糖溶液,用水浴锅将体系加热至55 ℃,搅拌1 h,恒压滴液漏斗缓慢滴加质量分数为25% 的戊二醛;用10% NaOH 溶液调pH值至10 ,然后升温至65 ℃,继续反应3 h后,趁热用真空抽滤泵将得到的微球滤出,用蒸馏水反复水洗后,再在圆底烧瓶中加150 mL 石油醚,用索氏提取器抽提,然后用无水乙醇索氏抽提,晾干、真空干燥至恒重,制得壳聚糖微球[9-10]。
(2)活化 称取一定量壳聚糖微球,经水充分溶胀后,依次用20%、50%、70%的DMSO水溶液清洗;向处理后的产物中加入一定量的DMSO/NaOH溶液和环氧氯丙烷,振荡反应一定时间。反应结束后用大量蒸馏水冲洗,直至清洗液中无环氧基检出。其中,壳聚糖环氧基修饰密度采用硫代硫酸钠滴定法测定[11]。
(3)键合螯合配基 取 50 mL一定浓度的IDA/NaOH混合溶液加入到活化后的壳聚糖微球中,在水浴摇床中振荡反应一定时间,洗涤至中性,用布氏漏斗抽干,得适于蛋白质分离的壳聚糖介质。
(4)金属离子螯合 取壳聚糖分离介质装柱(1.0 cm × 15 cm),用0.1 mol/L的CuSO4溶液灌流,分离柱螯合铜离子至饱和后用0.05 mol/L pH值7.5 Tris-HCl缓冲液清洗,可得到螯合铜离子的壳聚糖分离介质。
1.2.2 壳聚糖分离介质孔度值(P)的表征[12]
于比重瓶中加满正庚烷并称重(W1),倒出正庚烷,加入一定量干燥过的交联壳聚糖树脂(W),将树脂在正庚烷中浸泡2 h后,用正庚烷加满比重瓶并称重(W2),则干燥过的树脂骨架体积见式(1)。

式中,dt为测定温度下正庚烷的密度,dt= 0.6830 g/cm3,骨架密度见式(2)。

另外称取一定量的水溶胀后的交联壳聚糖树脂(尽量吸干表面水分)于烘箱中烘至恒重(G),则树脂中水分所占的质量分数为式(3)。

树脂的孔度值可用式(4)计算。

1.2.3 环氧基修饰密度的定量分析
壳聚糖介质的环氧基修饰密度采用硫代硫酸钠滴定法[13]测定,经去离子水清洗后的活化介质用布氏漏斗抽干,随后称取0.5 g置于磨口锥形瓶中并加入约5 mL1.3 mol/L硫代硫酸钠和酚酞指示剂1~2滴,锥形瓶封口后置于室温下振荡反应30 min,反应后的溶液用0.1 mol/L盐酸标准溶液滴定,直至溶液由红色变为无色为止,根据消耗的盐酸标准溶液的体积,由式(5)计算环氧基修饰密度。

式中,S为环氧基修饰密度,mmol/g;MHCl为 HCl浓度,mol/L;V0、V1分别为滴定前、后 HCl的体积,mL;ρ为介质密度,1.02 g/mL。
1.2.4 Cu2+螯合量的测定
称取一定量的壳聚糖介质,加入 10 mL 0.4 mol/L的CuSO4溶液,置于摇床中振荡反应一定时间,真空抽滤后利用分光光度法[14]测定滤液中Cu2+含量,即可确定Cu2+螯合量。
2 结果与分析
2.1 实验参数对壳聚糖成球的影响
2.1.1 戊二醛浓度对壳聚糖微球制备的影响
当壳聚糖在酸性条件下交联时,会因分子中的—NH2被质子化形成—NH3+而溶于水造成分离介质的流失,影响其性能,也不利于再生,因此可用戊二醛进行交联,使原来无序线状分子形成立体网孔状结构,从而提高吸附效率[15-16]。
将壳聚糖的浓度固定为 3%,液体石蜡与壳聚糖溶液的比例定为1∶1,环己烷15 mL,以不同体积的戊二醛进行交联,其它条件不变进行实验,结果见图1。
实验结果表明(图 1),交联剂对壳聚糖的成球有重要影响。戊二醛用量增大,使得表面交联层增厚,导致产物颜色加深,黏着严重,微球交联过于致密,多孔性降低,从而使得微球的孔隙率降低,但戊二醛加量太少,壳聚糖形成的球形不好。因此,综合考虑,当戊二醛加量为 3 mL时,这时壳聚糖微球球形较好,测得的壳聚糖微球含水率为60.07%,孔隙率为53.92%,并且分布粒度较窄。
2.1.2 搅拌速度对微球成球性及粒度大小的影响
固定其它实验条件不变,改变反应体系的搅拌速度进行实验,结果见图2。
高速公路隧道工程施工难度系数比较高,各种不确定情况发生的概率也比较高,高速公路隧道施工的特殊性是比较明显的。为了切实提升高速公路隧道项目的施工质量,要根据实际情况对施工方案更加优化,同时选择最合适的施工技术。

图1 戊二醛对壳聚糖交联的影响

图2 搅拌速度对壳聚糖交联的影响
由图2可以看出,搅拌速度对壳聚糖成球以及颗粒大小有重要影响,搅拌过快,虽然成球粒径分布较窄,微球孔隙率降低;搅拌过慢,成球性降低;这主要是因为当搅拌速度提高时,分散介质中的壳聚糖液滴粒径减小,液滴数目增多,比表面积增大,与交联剂接触面积增加,导致交联致密。综合考虑,只有当转速为400 r/min 时,对壳聚糖成球最有利,此时测得的壳聚糖微球孔隙率为53.47%。
2.2 壳聚糖介质的性能测定
经上述各条件实验,交联剂用量为3 mL、搅拌速度为400 r/min时,得到产物的扫描电镜图见图3。
图3中,壳聚糖微球有个别出现凹陷现象,可能是在制备过程中,壳聚糖微球表面附着了极细的壳聚糖珠体,但在后续处理过程中脱落。
2.3 活化条件的确定
2.3.1 DMSO对环氧基修饰密度的影响
其它条件不变,分别加入体积分数(φ)为0.2、0.4、0.6、0.8、1.0的DMSO与NaOH(1 mol/L)的混合溶液进行反应,结果见图4。

图3 壳聚糖微球的扫描电镜图(×100)

图4 φDMSO对环氧基修饰密度的影响
由图4可知,随着反应体系中DMSO含量的增大,环氧基修饰密度有所提高,当DMSO体积分数达到0.4后壳聚糖微球的环氧基密度趋于稳定。这可能是由于溶剂效应造成的。因为DMSO能与环氧氯丙烷互溶,使整个反应体系处于均相,从而使得环氧基密度增加。环氧氯丙烷作为一种常用的活化试剂,其在水溶液中有限的溶解度以及由此引发的其在壳聚糖微球中的低扩散通量是引起活化时间长、活化密度低的重要因素之一。本实验通过在活化体系中引入水溶性有机试剂提高环氧氯丙烷在活化体系中的溶解度,以期强化环氧氯丙烷活化反应;而DMSO不仅与水完全混溶,而且对于多种配基亦有很好的溶解性,这对获得高配基修饰密度是至关重要的。
2.3.2 NaOH 浓度对环氧基修饰密度的影响
其它条件不变,分别加入浓度为0、0.2 mol/L、0.4 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/L的NaOH与DMSO(φDMSO为0.4)的混合溶液进行反应,结果见图5。
由图5可知,NaOH浓度对活化程度也有影响,随着NaOH浓度增加,环氧基修饰密度先上升后降低,但在浓度为0.6 mol/L时,环氧基密度达到最大,这可能是由于碱浓度过高会导致壳聚糖分离介质上的环氧基开环所致。

图5 NaOH浓度对环氧基修饰密度的影响
2.3.3 环氧氯丙烷加量对环氧基修饰密度的影响
其它条件不变,分别加入体积分数φECH为5%、10%、15%、20%、25%的ECH进行反应,结果见图6。
由图6可知,随着ECH浓度的增加,环氧基活化密度有所增加,当其体积分数达到10%之后,环氧基修饰密度趋于稳定,这与水溶液体系中的结果是一致的[16]。
2.3.4 反应时间对环氧基修饰密度的影响
其它条件不变,分别反应2 h、4 h、6 h、8 h、10 h,其结果见图7。
由图7可知,环氧基修饰密度随着反应时间的延长而增加;在4 h以后开始有所下降,此时活化反应基本完成,但 ECH在碱性条件下因为发生水解而失活,导致测定的环氧基有所下降。
2.3.5 反应温度对环氧基修饰密度的影响
其它条件不变,分别在20 ℃、40 ℃、60 ℃、80 ℃条件下进行反应,反应结果见图8。
由图8可知,环氧基修饰密度随着反应温度的升高有明显的降低,反应温度达到 40 ℃时达到最大值,可能是由于温度升高,使得壳聚糖微球本身发生了降解。

图6 φECH对环氧基修饰密度的影响

图7 反应时间对环氧基修饰密度的影响

图8 反应温度对环氧基修饰密度的影响
综合以上反应条件可知,活化的最佳工艺为:DMSO体积分数为0.4、NaOH浓度为0.6 mol/L、ECH体积分数为10%、反应4 h、反应温度为40 ℃,此时环氧基修饰密度可达到0.15 mmol/g。
2.4 螯合配基反应条件的影响
2.4.1 螯合配基浓度的影响
称取0.5 g活化好的壳聚糖微球,分别加入浓度为0.2 mol/L、0.4 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/L IDA与NaOH(浓度为1.0 mol/L)的混合溶液,置于60 ℃水浴摇床中反应4 h,洗涤、抽滤。测定Cu2+的螯合量,结果见图9。
由图9可知,随着IDA浓度的增加,Cu2+吸附量逐渐增加,当其浓度达到0.6 mol/L之后,Cu2+吸附量趋于稳定,由此可间接反映螯合配基已达到饱和。
2.4.2 NaOH浓度对反应的影响
称取0.5 g活化好的壳聚糖微球,分别加入浓度为0.5 mol/L、1.0 mol/L、1.5 mol/L、2.0 mol/L、2.5 mol/L、3.0 mol/L NaOH与 IDA(浓度为 1.0 mol/L)混合溶液,置于60 ℃水浴摇床中反应4 h,洗涤、抽滤。测定Cu2+的螯合量,结果见图10。
由图10可以看出,随着NaOH浓度的增加,Cu2+螯合量先增加后趋于平稳。
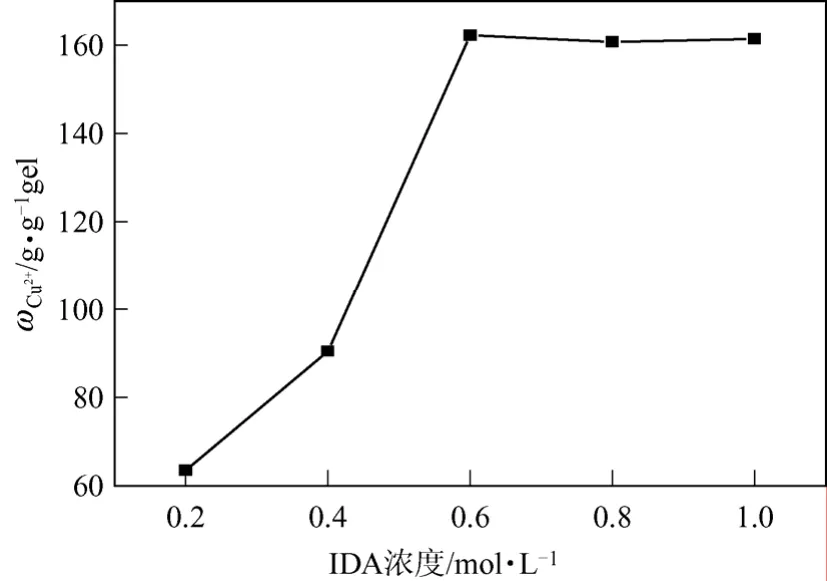
图9 IDA浓度对Cu2+螯合量的影响

图10 NaOH浓度对Cu2+螯合量的影响
2.4.3 时间对反应的影响
称取0.5 g活化好的壳聚糖微球,加入浓度为0.4 mol/L IDA与浓度为1.0 mol/L NaOH混合溶液,置于60 ℃水浴摇床中分别反应2 h、4 h、6 h、8 h、10 h,洗涤、抽滤。测定Cu2+的螯合量,结果见图11。由图11可知,随着反应时间的延长,Cu2+的螯合量先增加后降低。
综上所述,壳聚糖介质最佳的制备工艺为:IDA浓度为0.6 mol/L,NaOH浓度为2.0 mol/L,60 ℃水浴摇床170 r/min,反应6 h,制备的新型壳聚糖分离介质对Cu2+吸附量达到172.787 g/g。
3 结 论
以壳聚糖为载体,环氧氯丙烷为活化剂,亚氨基二乙酸为金属螯合配基制备新型壳聚糖分离介质,对分离介质的制备过程、活化过程以及螯合配基过程的工艺参数进行优化以确定出最优的制备工艺。
(1)采用1.0 mL/g(壳聚糖)戊二醛对壳聚糖在搅拌速度为400 r/min条件下进行交联,可以制得壳聚糖微球呈红棕色,成球率可达到90%以上,球形好、分布窄的壳聚糖微球。其含水率为45.60%、孔隙率为69.45%。

图11 反应时间对Cu2+螯合量的影响
(2)活化工艺:通过引入亲水性溶剂DMSO,可消除壳聚糖微球与环氧氯丙烷的相界面,促进活化试剂的溶解,提高了壳聚糖微球的环氧基修饰密度。DMSO 体积分数为 0.4、NaOH浓度为 0.6 mol/L、ECH体积分数为10%、反应4 h、反应温度为 40 ℃,此时环氧基修饰密度可达到 0.15 mmol/g。
(3)螯合工艺:IDA浓度为0.6 mol/L,NaOH浓度为2.0 mol/L,60 ℃水浴摇床170 r/min,反应6 h,制备的新型壳聚糖分离介质对Cu2+吸附量达到172.787 g/g。
该法制备的新型壳聚糖分离介质可用于固定化金属螯合层析填料。
[1]Porath J,Cadsson J,Olsson I,et al.Metal chelate affinity chromatography:A new approach to protein fractionation[J].Nature,1975,258:598-599.
[2]Vladka Gaberc Porekar,Viktor Menart.Perspectives of immobilizedmetal affinity chromatography[J].Biochemical and Biophysical Methods,2001,49:335-360.
[3]李蓉,陈国亮,赵文明.固定金属离子亲和色谱[J].化学通报,2005(5):352-360.
[4]叶青,王守斌,叶文玉.新型固定金属离子亲和吸附剂的制备及对蛋白质的吸附研究[J].河南大学学报:自然科学版,2007(2):152-156.
[5]Marguerite Rinaudo.Chitin and chitosan:Properties and applications [J].Progress in Polymer Science,2006,31:603-632.
[6]Chen Xiguang,Liu Chengsheng,Liu Chenguang,et al.Preparation and biocompatibility of chitosan microcarriers as biomaterial [J].Biochemical Engineering Journal,2006,27:269-274.
[7]李学斌,祝华.壳聚糖微球的制备方法研究[J].药学进展,2005,29(4):166-169.
[8]李志洲,刘军强.多孔壳聚糖微球的制备研究[J].淮阴师范学院学报:自然科学版,2007,6(3):247-250.
[9]余艺华,孙彦.交联壳聚糖树脂的制备工艺及性能表征[J].天津大学学报,2000,33(1):113-117.
[10]孟范平,易怀昌.壳聚糖微球的制备及其对酸性染料的吸附性能[J].化工进展,2009,28(10):1861-1871
[11]史清洪,彭冠英,孙舒,等.环氧氯丙烷活化琼脂糖凝胶过程强化及性能评价[J].过程工程学报,2007,7(4):743-746.
[12]王永健,孙彦.适于蛋白质吸附的交联壳聚糖树脂的制备[J].天津大学学报,2001,34(6):819-822.
[13]Judith A Scoble,Robert K Scopes. Assay for determining the number of reactive groups on gels used in affinity chromatography and its application to the optimization of the epichlorohydrin and divinylsulfone activation reactions[J].Journal of Chromatography A,1996,752:67-76.
[14]Zhao Fan,Yu Binyu,Yue Zhengrong,et al.Preparation of porous chitosan gel beads for copper(Ⅱ) ion adsorption[J].Journal of Hazardous Materials,2007,147:67-73.
[15]Biróa E,Németha Sz A,Feczkóa T.Three-step experimental design to determine the effect of process parameters on the size of chitosan microspheres[J].Chemical Engineering and Processing,2009,48:771-779.
[16]Dhananjay S K,Mulimani V H.Evaluation of modifed chitosan as matrix for hydrophobic interaction chromatography[J].Process Biochemistry,2008,43:647-653.
Study the preparation of a novel crossl-linked chitosan support
YI Yu1,CUI Guoyan1,WANG Hong1,LI Min1,ZHU Keyin2,YING Guoqing1
(1College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310032,Zhejiang,China;2Hangzhou Bolin Biotechnolgy Co. Ltd.,Hangzhou 310018,Zhejiang,China)
Investigation was carried out to elucidate the infuence of process parameters on the characteristics of chitosan microspheres prepared by reverse phase suspension cross-linked polymerization. The chitosan droplet solidifed and hardened by glutaraldehyde crosslinking agent was dispersed in the oil phase composed of liquid paraffin in the presence of Span 80 surfactant. Iminodiacetic acid(IDA)was attached onto chitosan microspheres activated by epichlorohydrin under basic condition. The results indicated that the optimal epoxy density above 0.15 mmol/g gel was achieved at 10%(φ)epichlorohydrin as activating accelerator in the solution consisting of 0.6 mol/L NaOH and 40% DMSO. The study on linkaging of IDA demonstrated that the support was synthesized in the solution composed of 0.6 mol/L IDA and 2.0 mol/L NaOH at 60 ℃ for 6 h,whose adsorption of Cu2+was up to 172.787 g/g gel. The moisture content of the matrix was up to 45.60% and the porosity was 69.45% under the optimized conditions. The novel matrix could be used in immobilized metal ion affinity chromatography as the solid phase.
chitosan;metal chelate affinity chromatography;epichlorohydrin
O 63
A
1000-6613(2011)09-2049-06
2011-02-25;修改稿日期2011-03-25。
浙江省科技厅项目(2009C33089)。
易喻(1978 —),男,讲师,研究方向为生化分离工程及酶工程。联系人:应国清,教授,博士生导师。E-mail gqying@zjut.edu.cn。

