家蚕蛹油对大鼠肝脏脂质代谢及相关酶活性的影响
黄 静,廖爱美,潘文娟,张海祥,魏兆军
(1.合肥工业大学医院,安徽 合肥 230009;2.合肥工业大学生物与食品工程学院,安徽 合肥 230009;3.合肥师范学院生命科学系,安徽 合肥 230061)
家蚕蛹油对大鼠肝脏脂质代谢及相关酶活性的影响
黄 静1,2,廖爱美2,3,潘文娟2,张海祥2,魏兆军2
(1.合肥工业大学医院,安徽 合肥 230009;2.合肥工业大学生物与食品工程学院,安徽 合肥 230009;3.合肥师范学院生命科学系,安徽 合肥 230061)
以不饱和脂肪酸含量达68%的家蚕蛹油为原料,喂食正常大鼠和高脂模型大鼠,检测大鼠肝脏总胆固醇、甘油三酯、高密度脂蛋白胆固醇、丙二醛浓度及脂蛋白脂酶和肝脂酶活性,研究蚕蛹油对大鼠肝脏脂质代谢及其相关酶活性的影响。结果表明:家蚕蛹油能显著降低大鼠肝脏组织总胆固醇、甘油三酯的含量,增加高密度脂蛋白胆固醇含量,降低肝脏致动脉粥样硬化指数和脂质过氧化产物丙二醛含量;显著提高脂蛋白脂酶和肝脂酶活性。上述结果说明家蚕蛹油具有调节大鼠肝脏脂质代谢、降低血脂的功效。
家蚕蛹油;肝脏;总胆固醇;甘油三酯;脂蛋白脂酶;肝脂酶;脂质代谢
昆虫特别是家蝇、黄粉虫、家蚕等因其种类多、数量大、生命力强等特点、特别是其富含的多种活性成分,自古以来便被人类当作食品、药品的重要资源,具有广阔的开发应用前景[1-3]。蚕蛹是药膳同源传统中药材,化学成分丰富,干蚕蛹蛋白质含量高(约48%~60%),油脂含量丰富(约25%~31%),其中不饱和脂肪酸占油脂的68%以上[4]。此外,还含有糖类、甲壳素、多种微量元素及少量粗纤维、几丁质、 多种维生素、蛹磷脂、抗菌肽、干扰素、溶菌酶、腺嘌呤、次黄嘌呤、去甲肾上腺素、肾上腺素等,具有较高的经济价值和开发价值。现代医学研究表明,蚕蛹的药理作用也相当广泛,具有降低血脂、保护肝脏、提高免疫力、促进生长等功效[5-7]。 鲜家蚕蛹油中游离脂肪酸占8%~10%,人体所必需的油酸、亚油酸和亚麻酸等不饱和脂肪酸占游离脂肪酸的75%以上,其中α-亚麻酸含量高达71.45%[4,8]。α-亚麻酸等不饱和脂肪酸能有效降低体内的低密度胆固醇、甘油三酯、调节脂蛋白含量,防止动脉粥样硬化和动脉血栓的形成,可作为预防和治疗多种疾病的保健品或医药的原料,在医学上有广泛用途[9]。
下脚料蚕蛹是剿丝工业的主要副产物,目前对其增值利用主要集中在蛋白质上[10-11],对其蛹油的功效报道较少。本实验以蚕丝厂的下脚料蚕蛹萃取的家蚕蛹油为原料,研究家蚕蛹油对实验性大鼠的肝脏脂质代谢及相关脂酶活性的影响,为其在保健品、药品原料等领域的进一步开发利用提供参考。
1 材料与方法
1.1 材料、实验动物与试剂
蚕蛹为缫丝后的下脚料,由安徽双龙丝绸有限公司提供。
昆明雄性Wistar大鼠 安徽省肥东长临河动物实验基地;基础饲料 安徽医科大学动物中心购得。
三氯甲烷、氯化钠、正己烷(AR) 无锡市展望化工试剂有限公司;高纯度CO2气体 合肥金旺光源气体科技有限公司;总胆固醇测定试剂盒、甘油三酯测定试剂盒、高密度脂蛋白胆固醇测定试剂盒 长春汇力生物技术有限公司;丙二醛测定试剂盒、脂蛋白脂酶/肝脂酶活性测定试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
电热恒温鼓风干燥箱 上海跃进医疗器械厂;电子天平 上海奥豪公司;SQ2119C多功能食品加工机 生海帅佳电子科技有限公司;HA121-50-O1-C型超临界萃取装置 江苏南通华安超临界萃取有限公司;SHY-2A型恒温水浴摇床 江苏金坛金城国胜仪器厂;岛津GC-2010气相色谱仪、岛津GCMS-QP 2010气相色谱-质谱联用仪 日本岛津公司;全自动生化分析仪 上海康禾光电仪器公司。
1.3 家蚕蛹油的超临界二氧化碳萃取
将从蚕丝厂取回的蚕蛹挑选去杂,于电热恒温鼓风干燥箱中60℃左右烘一定时间,使水分含量达5%左右,粉碎过筛,筛选60~80目的蚕蛹粉末供超临界提取用。每次称取100g蚕蛹粉装入超临界原料提取桶内,在CO2流量25kg/h、萃取温度35℃、萃取时间2h、萃取压力25MPa、分离温度35℃和分离压力5.5MPa条件下萃取,即可得到淡黄色的蚕蛹油[12]。
将萃取的蚕蛹油甲酯化后,采用气质联用技术测定[12],结果表明蚕蛹油富含不饱和脂肪酸,其含量达68%,其中多不饱和脂肪酸(PUFA)占35.11%,α-亚麻酸的含量高达27.99%,蚕蛹油中的主要单不饱和脂肪酸为油酸,其含量为33%,主要的饱和脂肪酸是软脂酸和硬脂酸,含量分别为21.77%和7.02%。
1.4 实验分组及处理
健康的雄性Wistar大鼠适应性喂养1周后将其分成4组,每组7只,第一组为空白对照组,喂以基础饲料(主要成分为玉米31.5%、小麦20%、麸皮10%、豆粕22%、鱼粉8%、骨粉2.5%、酵母粉2%);第二组为实验对照组(记为SPO组),喂以基础饲料同时灌胃给予家蚕蛹油(SPO,1mL/(kg·d));第三组为高脂模型组(记为HFD组),喂以高脂饲料(猪油10%、胆固醇1%、胆盐0.1%、基础饲料88.9%);第四组为实验组(记为HFD+SPO组),喂以高脂饲料的同时灌胃给予家蚕蛹油(SPO,1mL/kg)。家蚕蛹油灌胃剂量均以大鼠体质量计,喂养6周后禁食12h,股动脉取血处死大鼠,离心分离血清,收集肝脏等器官,用于测定相关指标。
1.5 肝组织匀浆液的制备及相关指标测定
肝组织用生理盐水除去血液,滤纸拭干,采用异丙醇制备10g/100mL的肝组织匀浆,3000×g,4℃离心15min取上清液,使用总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)试剂盒,测定肝组织TC、TG、HDL-C的含量。
采用无菌生理盐水制备10g/100mL的肝组织匀浆,3000×g,4℃离心15min取上清液,按照丙二醛(MDA)、脂蛋白脂酶/肝脂酶(lipoprtein lipase/hepatic lipase,LPL/HL)活性测定试剂盒使用说明书测定肝组织MDA含量、LPL及HL活性。
致动脉粥样硬化指数(atherosclerosis index,AI)值,根据TC和HDL-C的浓度,采用下式计算。
AI =[c(TC)-c(HDL-C)]/c(HDL-C)
1.6 数据统计及分析
实验数据以平均值±标准差表示,使用SAS软件包对实验结果进行方差分析,当0.01<P<0.05和P<0.01时分别表示差异显著和极显著。
2 结果与分析
2.1 家蚕蛹油对大鼠肝脏组织胆固醇和甘油三酯的影响
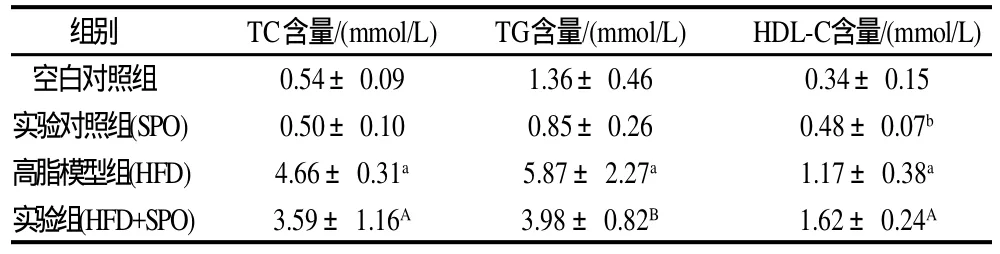
表1 家蚕蛹油对大鼠肝脏组织TC、TG、HDL-C的影响Table 1 Effect of silkworm pupal oil on hepatic TC, TG, and HDL-C levels in rats
从表1可以看出,喂食基础饲料的空白对照组及SPO组大鼠肝脏组织的总胆固醇和甘油三酯含量均无显著差异;与空白对照组大鼠相比,HFD组大鼠肝脏组织的总胆固醇、甘油三酯含量均显著增加,说明高脂大鼠模型建模成功。而与HFD组大鼠相比,HFD+SPO组大鼠肝脏组织的总胆固醇和甘油三酯含量分别极显著(P<0.01)、显著降低(P<0.05),说明家蚕蛹油能有效降低大鼠肝脏组织的TC、TG含量。目前认为,食用高脂饮食特别是富含饱和脂肪酸的脂质饮食,如本实验中制备高脂饲料用到的猪油,不仅会使体内TC、TG含量增加,同时会增加体内游离脂肪酸的含量,体内FFA增高,不仅有很强的细胞毒性,损伤肝细胞质线粒体及溶酶体膜,进而引起生物膜损伤,而且会使抗氧化能力减弱,导致肝细胞变性。家蚕蛹油富含油酸、亚油酸、α-亚麻酸,且n-3和n-6系不饱和脂肪酸比例恰当[5]。医学营养学研究表明,n-3和n-6系不饱和脂肪酸能够在高密度脂蛋白的作用下使胆固醇进入胆汁通过代谢进行排泄,致使肝内胆固醇池的清空,同时可以通过刺激β-氧化和抑制脂肪酸合成来降低肝脏脂质积聚达到降低血脂的目的[13]。
2.2 家蚕蛹油对大鼠肝脏组织高密度脂蛋白的影响
从表1可知,与喂食基础饲料的空白对照组相比,SPO组、HFD组大鼠肝脏组织的高密度脂蛋白含量分别显著(P<0.05)、极显著升高(P<0.01);与HFD组相比,HFD+SPO组大鼠的肝脏高密度脂蛋白胆固醇含量极显著升高(P<0.01)。高密度脂蛋白被认为是一种抗动脉粥样硬化的脂蛋白,它能将周围组织及动脉壁上的胆固醇吸收下来,运输到肝脏中分解,形成胆酸从胆汁中排出,同时也可接受游离胆固醇使其酯化,形成胆固醇酯后再将其转运出去,使其具有明显的抗动脉粥样硬化的作用[14]。
2.3 家蚕蛹油对大鼠肝脏组织AI和MDA含量的影响
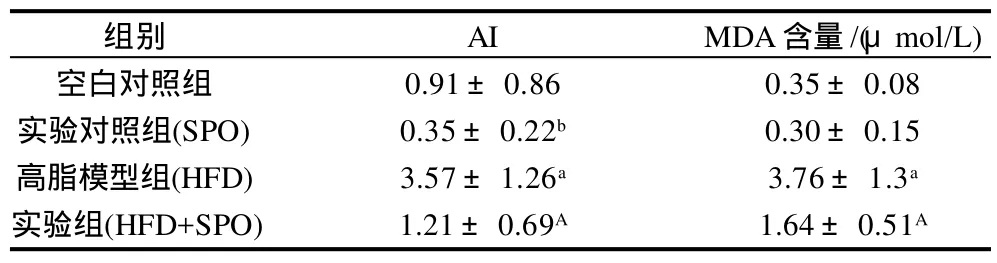
表2 家蚕蛹油对大鼠肝脏组织AI和MDA含量的影响Table 2 Effect of silkworm pupal oil on hepatic AI and MDA content in rats
AI是综合血脂的几项指标来反应机体发生动脉粥样硬化(atherosclerosis,AS)危险性的一个参数。AI值升高提示机体发生AS的可能性增加。从表2可以看出,HFD组大鼠的AI值和MDA含量都极显著高于食用基础饲料的空白对照组,SPO组大鼠的AI值较空白对照组显著降低(P<0.05),但MDA含量无显著差异;与HFD组相比,HFD+SPO组大鼠的AI值和MDA含量都极显著降低(P<0.01)。研究表明,当体内脂质含量过高时,脂质过氧化反应加剧,会致使大量氧自由基产生,产生其代谢产物MDA,而MDA的两个功能基又可与线粒体的膜脂、膜蛋白 NH2交联,形成希呋碱,使线粒体膜的流动性明显降低,影响膜中酶的活性,从而干扰了脂肪酸的β-氧化,导致脂肪在肝内蓄积,使肝细胞结构与功能发生损害,家蚕蛹油富含不饱和脂肪酸,竞争抑制花生四烯酸代谢,使其代谢产物之一MDA形成减少。
2.4 家蚕蛹油对大鼠LPL、HL活性的影响
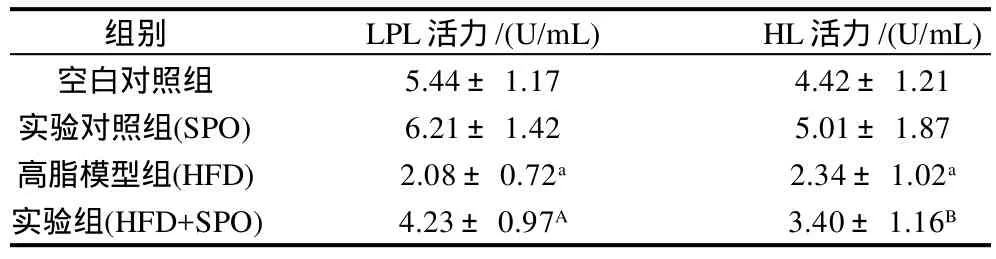
表3 家蚕蛹油对实验性大鼠LPL、HL活性的影响Table 3 Effect of silkworm pupal oil on the activities of LPL and HL in rats
从表3可知,HFD组大鼠的LPL活性和HL活性都极显著低于空白对照组;SPO组大鼠的LPL活性和HL活性都高于空白对照组大鼠,但差异不显著;与HFD组相比,HFD+SPO组大鼠的LPL活性和HL活性分别极显著(P<0.01)、显著(P<0.05)升高。LPL是脂肪细胞、心肌细胞、骨骼肌细胞、乳腺细胞以及巨噬细胞等实质细胞合成和分泌的一种糖蛋白,活性LPL以同源二聚体形式存在,通过静电引力与毛细血管内皮细胞表面的多聚糖结合,其生理功能是催化TG分解为脂肪酸和单酸甘油酯,以供组织氧化供能和贮存,同时参与极低密度脂蛋白(VLDL)和HDL-C之间的载脂蛋白和磷脂的转换,HL与LPL具有高度相似的氨基酸序列,有共同的作用机制[15]。富含α-亚麻酸等不饱和脂肪酸的家蚕蛹油能够提高LPL、HL的活性,通过多途径、多靶点调节机体肝脏脂质代谢紊乱,对动脉粥样硬化和心血管疾病的发生具有很好的预防作用。
3 结 论
本实验以不饱和脂肪酸含量为68%的蚕蛹油为原料,经大鼠体内实验结果表明:家蚕蛹油能显著降低大鼠肝脏组织TC及TG含量,调节脂蛋白含量,显著增加HDL-C含量,降低其AI和脂质过氧化产物MDA含量;同时显著提高LPL和HL的活性,具有调节肝脏脂质代谢,降低血脂的功效。
[1] MANTZIORIS E, JAMES M J, GIBSON R A, et al. Dietary substitution with an ALA rich vegetable oil increases EPA concentrations in tissues[J]. American Journal of Clinical Nutrition, 1994, 59(6): 1304-1307.
[2] WILKINSON P, LEACH C, AH-SING E E, et al. Influence of αlinolenic acid and fish-oil on markers of cardiovascular risk in subjects with atherogenic lipoprotein phenotype[J]. Atherosclerosis, 2005, 181(1): 115-124.
[3] SHAHIDI F, WANASUNDARA U N. Omega 3-fatty acids: nutritional aspects and production technologies[J]. Trends Food Sci Technol, 1998,9(6): 230-240.
[4] 魏兆军, 廖爱美, 胡海梅, 等. 蚕蛹油的成分、营养价值及提取工艺研究进展[J]. 安徽农业科学, 2007, 31(30): 9699-9700.
[5] RAO P U. Chemical composition and nutritional evaluation of spent silkworm pupae[J]. Journal of Agricultural and Food Chemistry, 1994,42(10): 2201-2203.
[6] ZHOU Jun, HAN Dingxian. Proximate, amino acid and mineral composition of pupae of the silkworm Antheraea pernyi in China[J]. Journal of Food Composition and Analysis, 2006, 19(8): 850-853.
[7] DATTA R N, MAJUMDAR S K, KAR R, et al. Pupae waste may be a source for amino acid preparation[J]. India Silk, 1993, 32(1): 4-5.
[8] 魏兆军, 廖爱美, 于力涛. 家蚕蛹油提取工艺优化研究[J]. 食品科学,2007, 28(10): 248-251.
[9] KELLEY D S, BRANCH L B, LOVE J F. Dietary ALA and immunocompetence humans[J]. American Journal of Clinical Nutrition, 1991,53(1): 40-46.
[10] ZHOU Jun, HAN Dingxian. Safety evaluation of protein of silkworm(Antheraea pernyi) pupae[J]. Food and Chemical Toxicology, 2006, 44:1123-1130.
[11] MISHRA N, HAZARIKA N C, NARAIN K, et al. Nutritive value of non-mulberry and mulberry silkworm pupae and consumption pattern in Assam, India[J]. Nutrition Research, 2003, 23(10): 1303-1311.
[12] WEI Z J, LIAO A M, ZHANG H X, et al. Optimization of supercritical carbon dioxide extraction of silkworm pupal oil applying the response surface methodology[J]. Bioresour Technol, 2009, 100(18): 4214-4219.
[13] MURASE T, IOKI M, TOKIMITSU I. Supplementation with alphalinolenic acid rich diacylglycerol suppresses fatty liver formation accompanied by an upregulation of β-oxidation in Zucker fatty rats[J].Biochimica et Biophysica Acta, 2005, 1733(2/3): 224-231.
[14] HOFF H F, NEIL J. Extracts of human atheroscle-rotic lesions can modify low density lipoproteins leading to enhanced uptake by macropages[J]. Atherosclerosis, 1998, 70(1): 29-41.
[15] YOKOTA T, NAGASHIMA M, GHAZIZADEH M, et al. Increased effect of fucoidan on lipoprotein lipase secretion in adipocytes[J]. Life Sciences, 2009, 84(14/15): 523-529.
Effect of Silkworm Pupal Oil on Hepatic Lipid Metabolism and Related Lipase Activity in Rats
HUANG Jing1,2,LIAO Ai-mei2,3,PAN Wen-juan2, ZHANG Hai-xiang2,WEI Zhao-jun2
(1. Affiliate Hospital, Hefei University of Technology, Hefei 230009, China;2. School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China;3. Department of Life Science, Hefei Normal University, Hefei 230061, China)
Silkworm pupae oil extracted from the waste after silk reeling by supercritical carbon dioxide fluid extraction, which was found to contain 68% of unsaturated fatty acids, was administered intragastrically to normal rats and high fat model rats for 6 successive weeks and then fasted for 12 h after the last administration. The levels of hepatic total cholesterol (TC), triglycerides (TG), high-density lipoprotein-cholesterol (HDL-C) and malonyldialdehyde (MDA) and the activities of related lipases such as lipoprotein lipase (LPL) and hepatic lipase (HL) were measured to clarify the effect of silkworm pupae oil on hepatic lipid metabolism and related lipase activity in rats. The results showed that silkworm pupae oil could significantly reduce the levels of hepatic TC and TG, increase HDL-C level, decrease atherosclerotic index and MDA level, and notably improve the activities of LPL and HL. It could be concluded from these results that silkworm pupae oil is capable of regulating lipid metabolism and decreasing blood lipid in rats.
silkworm pupal oil;liver;total cholesterol;triglycerides;lipoprotein lipase;hepatic lipase;lipid metabolism
R284.1
A
1002-6630(2011)05-0273-04
2010-12-09
安徽省“十一五”科技攻关项目(08010302149);江苏省科技支撑计划项目(农业BE2009365);
教育部新世纪优秀人才基金项目(NCET-07-0251)
黄静(1963—),女,中级主管技师,本科,研究方向为营养安全检测。E-mail:huangjing7058@yahoo.com.cn
*通信作者:魏兆军(1970—),男,教授,博士,研究方向为功能食品。E-mail:zjwei@hfut.edu.cn

