贮藏玉米中优势腐败霉菌M13的分离与鉴定
岳晓禹,徐 军,张恒业,孙忠伟,李 欣,刘相东
(1.郑州牧业工程高等专科学校质检系,河南郑州 450011; 2.中国农业大学工学院,北京 100083; 3.苏州国发创业投资控股有限公司,江苏苏州 215128)
贮藏玉米中优势腐败霉菌M13的分离与鉴定
岳晓禹1,2,徐 军1,张恒业1,孙忠伟3,李 欣1,刘相东2
(1.郑州牧业工程高等专科学校质检系,河南郑州 450011; 2.中国农业大学工学院,北京 100083; 3.苏州国发创业投资控股有限公司,江苏苏州 215128)
贮粮的安全关系到国计民生,对其中的腐败微生物进行分析研究具有重要意义。从贮藏玉米中分离到一株优势腐败霉菌M13,通过形态特征观察和ITS序列分析,将该菌株初步鉴定为米曲霉(Aspergillus oryzae),并构建了其系统发育树,更是提供了一种准确可靠且简单易行的粮食真菌鉴定技术。
玉米,形态特征,ITS序列分析,系统发育树
贮粮品质关系到食品生产及饲料加工安全,当环境温湿度满足霉菌生长的条件后,贮藏玉米就有可能发生霉腐现象[1],不仅影响其贮藏稳定性和安全性,而且还会使其食用及加工工艺品质下降。更有甚者会产生黄曲霉毒素等真菌毒素及霉菌的其他有毒代谢产物[2],从而对人类健康和牲畜饲养的安全造成严重威胁[3-5]。霉菌的种类和数量能基本反映粮食的安全状况。对玉米中存在的腐败或病原霉菌进行分离和鉴定,是实现玉米安全贮藏的重要一步。随着分子生物学技术的发展,rDNA内转录间隔区(internal transcribed spacer,ITS)序列分析技术由于稳定性好和测序方便,已广泛地运用到真菌种属水平的分类鉴定研究中[6-9]。本文从贮藏玉米中分离、纯化出其中占优势的霉菌菌株,对其中一株进行了鉴定,以了解贮藏玉米的优势霉菌,为粮食的科学贮藏和食品安全控制提供参考。
1 材料与方法
1.1 材料与仪器
玉米 产于许昌;马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA) 附加抗菌素;查氏培养基(Czapek’s Agar,CA),查氏酵母膏培养基(Czapek Yeast Extract Agar,CYA),10mg/mL链霉素、6×上样缓冲液(Loading buffer)、50×TAE电泳缓冲液、10mg/mL溴化乙锭(EB)贮存液、1mol/L Tris-HCl (pH8.0)、0.5mol/L EDTA(pH8.0)、TE缓冲液、10% CTAB-0.7mol/L NaCl、提取缓冲液、氯仿∶异戊醇(24∶1) 配制上述试剂所用的药品均为分析纯;TaqDAN聚合酶、蛋白酶K、RNase酶 北京天根生物技术公司。

表1 ITS rDNA PCR扩增反应体系
凝胶成像系统Biosens SC 810 上海山富科学仪器有限公司;PCR仪 Primus 96 Advanced 德国Peqlab公司;稳压稳流电泳仪EPS-300 上海天能科技有限公司;显微摄像头DEM 杭州数明科技有限公司。
1.2 实验方法
1.2.1 贮藏玉米中主要霉菌的分离、纯化与保存
取3份供试玉米置于灭菌平板中,加入适量无菌水,使其水分活度达0.97后,在28℃下培养。待其长出霉菌后,挑取形态各异的菌株,划线接种到PDA培养基平板上,28℃培养。之后反复进行平板划线,直至得到形态不同的单菌落。供试菌株于沙土管中长期保存,或PDA斜面上培养后于4℃临时保存备用。
1.2.2 真菌菌株的形态学观察 将不同形态的菌株点接种在PDA培养基、查氏培养基、查氏酵母膏培养基固体平板上,28℃培养12d,观察菌落形态特征。观察菌落在培养基中的颜色、菌落形成是否规则、菌落大小、菌丝体是否发达等。
固体培养基中插片培养3~5d,待菌丝附着在盖玻片上时,取出,于显微镜下观察。镜检孢子形状、菌丝体有否横隔膜,孢子梗形态结构等。
1.2.3 系统发育学方法鉴定
1.2.3.1 菌体的培养与收集 菌株的培养∶将分离得到的菌株,在PDA斜面上活化后,接种到含200mL PDA液体培养基的500mL三角瓶中,28℃、180~200r/min摇床培养至对数生长后期,镜检,验纯。
菌体的收集∶验纯后的菌丝培养液,用2层无菌纱布过滤,然后用无菌去离子水洗涤2~3次,再用TE缓冲液洗涤1次,无菌滤纸尽量挤干水分,置于Ep管中,于-20℃保存备用。
1.2.3.2 丝状真菌总DNA的提取 采用CTAB法,参考文献[10-13]的方法提取总DNA,有改动。对所提取的DNA样品,采用1%琼脂糖平板凝胶电泳,EB染色,5μL上样,紫外检测其提取质量。
1.2.3.3 PCR扩增 引物∶以基因组DNA为模板,根据酵母rDNA保守区段设计引物,扩增待鉴定菌株的ITS区域(ITS1-5.8S rDNA-ITS2)[12]。
ITS区域∶正向引物∶GGA AGT AAA AGT CGT AAC AAG G,反向引物∶TCC TCC GCT TAT TGA TAT GC。引物由“上海生工生物工程技术服务有限公司”合成。
扩增反应体系∶PCR反应体系为30μL,每次反应均设阴性对照(不加模板)。具体组成见表1。
扩增程序∶按下述程序进行扩增ITS rDNA基因。预变性94℃ 5min;变性94℃ 30s;退火55℃30s;延伸72℃ 40s;重复步骤40个循环;最终延伸72℃ 7min。扩增产物于-20℃下保存。
PCR产物检测∶琼脂糖凝胶电泳检测产物,以标准DNA分子量作对照。电泳结束后,用紫外凝胶扫描仪扫描、照相,检测扩增片断长度与产量。
1.2.3.4 ITS rDNA碱基序列分析 将电泳检测后的PCR产物送上海生工生物工程技术服务有限公司测序,测序所用引物与做PCR所用引物为同一对引物。测序结果经校对后采用 BLAST(BasicLocal Alignment Search Tool)程序,在国际生物技术信息中心(NCBI)GenBank数据库(http∶//www.ncbi.nlm. nih.gov)中进行序列相似性比对搜索,查看碱基序列相似性。
1.2.3.5 系统发育树分析 利用BLAST程序,将所测得的ITS序列与GenBank数据库中已知菌株的ITS序列进行比对,依据比对结果,选取同源性适当较高的已知菌株的ITS序列和所测菌株的ITS全序列一起建立系统发育树。用MEGA4.0软件采用邻接法(Neighbor-Joining,NJ法)和最大简约法(Maximum Parsimony,MP法)构建系统发育树[14],自展值为1000。
1.2.4 菌种鉴定 根据菌株的形态学特征,结合系统发育学结果,参考资料对分离纯化后的菌株进行鉴定[15-17]。
2 结果与分析
2.1 贮藏玉米中优势腐败霉菌的分离纯化
贮藏玉米经过适当培养,生长出肉眼清晰可见的霉菌,这些霉菌为腐生型,对贮藏粮食均会带来营养、卫生、安全等方面的危害,必须予以足够重视。
经过在PDA培养基上的划线纯化,可以分离、纯化出形态不同的霉菌。本文对经过适当培养后,以肉眼明显可见,占生长优势的霉菌作为分离纯化对象,分离、纯化出形态各异的霉菌,并对分离得到的M13菌株采取形态学方法,结合系统发育学,进行鉴定。
2.2 M13菌株的鉴定
2.2.1 M13菌株的形态学特征 M13镜检和菌落形态观察,参见图1~图4。

图1 M13菌株插片镜检
M13菌株镜检观察,分生孢子头散生,分生孢子幼时洋梨形或椭圆形,成熟后大多变为球形或近球形。分生孢子梗生自基质或气生菌丝,生于气生菌丝者较短,壁通常粗糙,顶囊近球形或烧瓶形。
M13菌株在PDA培养基上,27℃、7d菌落直径
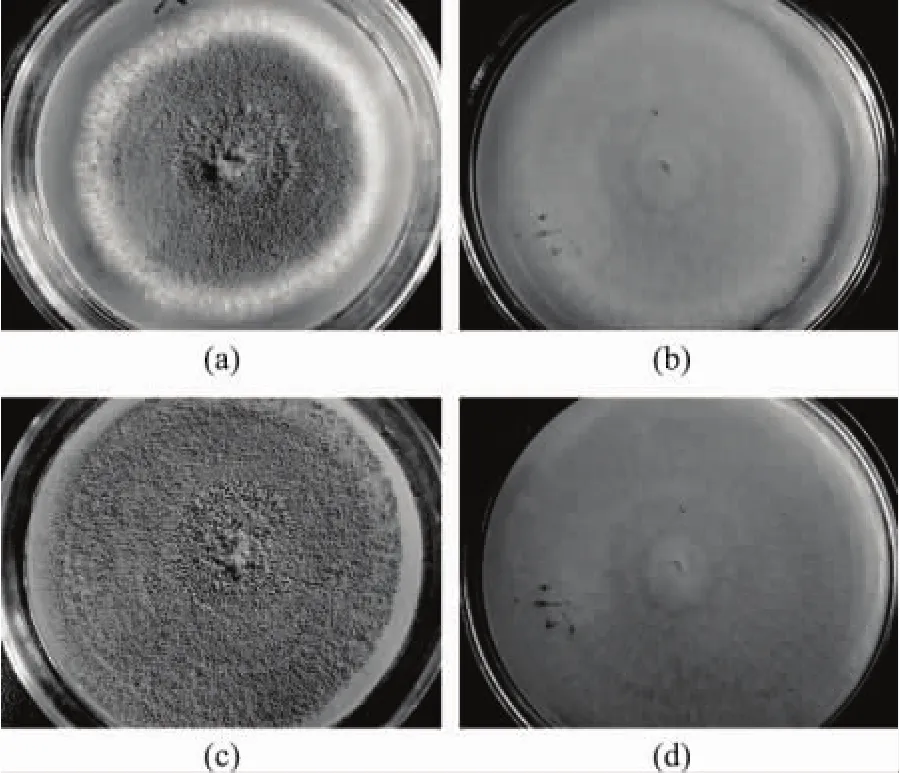
图2 菌株M13在PDA培养基上的菌落形态

图3 菌株M13菌株在查氏培养基上的菌落形态

图4 菌株M13菌株在查氏酵母膏培养基上的菌落形态
M13菌株在查氏培养基上菌落生长较快,27℃、7d直径65mm;质地较厚,具有辐射状沟纹,中央现絮状;初为白色、黄色,继变为淡黄褐色至淡绿褐色,但不呈真正的绿色;菌落反面呈淡粉红色至淡褐色,有辐射状沟纹。
M13菌株菌落在查氏酵母膏琼脂上27℃、7d直径可达80mm;质地较厚,中央呈絮状,具辐射状沟纹,有菌核;菌落呈厚绒毛状;初为白色,青色,淡黄褐色,后变为黄褐色至绿褐色,菌落反面淡粉红色,可见辐射状沟纹。
2.2.2 M13菌株的ITS序列同源性分析
2.2.2.1 DNA的提取 将所培养菌种的菌丝收集后,用CTAB法提取DNA。将提取的DNA进行1%琼脂糖电泳,见图5。由图5中可以看出,其可以用于下一步PCR扩展。

图5DNA琼脂糖电泳
2.2.2.2 PCR检测 采用所选取的引物,对不同霉菌基因组 DNA进行特异性扩增,均可以获得约为590bp的ITS片段的PCR产物,如图6所示。由图6中可以看出,扩增片段约为580bp。
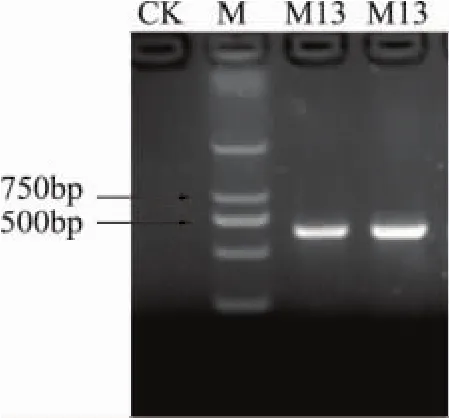
图6 引物PCR扩增产物检测图谱
2.2.2.3 测序结果 M13菌株的ITS测序结果如下(580bp,包含18S rDNA的部分序列;ITS1、5.8S、ITS2处的全部序列;28S rDNA的部分序列)∶

将得到的M13菌株的序列在GenBank中进行同源搜索,运用DNAMAN软件(Version 5.2.2)进行比对。结果表明,M13菌株与米曲霉(A.oryzae,EU409806)的 ITS、5.8S rDAN的序列同源性均为100%。
2.2.3 以ITS序列为基础的系统发育树构建 本研究用距离矩阵法(distance matrix method)中的邻接法(neighbor-joining)以及最大简约法(maximum parsimony,MP)构建系统发育树,用自展法(bootstrap)检验系统树的可靠性,自展次数为1000次,建树选取的参比菌种见表2。利用MEGA 4.0软件构建得到系统发育树,如图7所示。

表2 M13建树选取的参比菌株

图7 以ITS序列为基础构建的M13菌株的系统发育树
NJ法以及 MP法中 M13与米曲霉Aspergillus oryzae(AB000533)、黄 曲 霉Aspergillusflavus(FJ216383)、昆虫曲霉Aspergillus nomius(DQ467976)、寄生曲霉Aspergillus parasiticus(DQ026005)聚为一枝。
2.3 鉴定结果
依据文献[15-17],综合M13菌株的形态特征、序列同源性以及系统发育树结果,根据Renske[18]等认为真菌通过ITS区域比对,序列相似性≥99%可鉴别为相同种,初步鉴定该菌为米曲霉(Aspergillus oryzae)。米曲霉 (A.oryzae)归类于丛梗孢目(Moniliales),丛梗孢科 (Moniliaceae),曲霉属(Aspergillus)。
3 结论
本研究以传统的形态学特征的鉴定为依据,同时采用rDNA ITS序列的比较分析,确定玉米中分离到的一株优势腐败霉菌为米曲霉(A.oryzae),并构建了其系统发育树。米曲霉(A.oryzae)较多地被发现于发酵食品中,它可以酿制酱、酱油和味精,也可用来生产乳酸和糊化淀粉,很多资料中都把米曲霉归为黄曲霉群(A.flavusGroup)。
长期以来真菌主要是依据其形态特征进行鉴定,但是形态性状的生长受生长环境和生长时期的影响,鉴定的结果受主观因素的影响也较大,因而基于形态性状特征对真菌进行分类鉴定有一定的局限性。真菌核糖体DNA内转录间隔区(ITS)在进化上比编码区快,种内的不同菌株之间高度保守,但在种间变化极大,ITS序列分析体现的是碱基差异,可为真菌学的研究提供丰富的遗传信息,对真菌的鉴定有更好的准确性和灵敏性[19-21],同时借助 GenBank等生物数据库的大量信息,从分子水平为真菌的准确分类、鉴定提供科学依据。本实验进行的菌属的鉴定,与传统的真菌分类主要根据真菌菌株的形态特征、生长特性与生理生化指标相比,提升了真菌分类鉴定的可靠性。结果表明,形态特征、结合rDNA ITS序列分析能够有效地进行贮粮中霉菌的鉴定,实验结果也为分析影响贮藏粮食及饲料品质的主要腐败微生物,开展生态贮粮研究提供了一定的参考价值和依据。
[1]黄淑霞,蔡静平,田海娟.主要粮食品种储藏期间霉菌活动特性研究[J].中国粮油学报,2010,25(1):99-102.
[2]Bennett J W,Klich M.Mycotoxins[J].Clinical Microbiology Reviews,2003,16(3):497-516.
[3]Pitt J I.Toxigenic fungi and mycotoxins[J].Br Med Bull,2000,56:184-192.
[4]Creppy E E.Update of survey,regulation and toxic effects of mycotoxins in Europe[J].Toxicol Lett,2002,127:19-28.
[5]蔡静平.粮油食品微生物学[M].北京:中国轻工业出版社,2002.
[6]LI Zihui,FENG Xianmin,LU Siqi,et al.Molecular phylogeny of Pneumocystis based on 5.8S rRNA gene and the internal transcribed spacers of rRNA gene sequences[J].Science in China Series C:Life Sciences,2008,51(5):445-452.
[7]Geml J,Laursen G A,Timling I,et al.Molecular phylogenetic biodiversity assessment of arctic and boreal ectomycorrhizal Lactarius Pers.(Russulales;Basidiomycota)in Alaska,based on soil and sporocarp DNA[J].Molecular Ecology,2009,18(10): 2213-2227.
[8]AlaeiL H,De Backer M,Nuytinck J,et al.Phylogenetic relationships of Puccinia horiana and other rust pathogens of Chrysanthemum× morifolium based on rDNA ITS sequence analysis[J].Mycological Research,2009,113(6/7):668-683.
[9]Tedersoo L,Suvi T,Jairus T,et al.Revisiting ectomycorrhizal fungi of the genus Alnus:differential host specificity,diversity and determinants of the fungal community[J].The New Phytologist,2009,182(3):727-735.
[10]White T J,Bruns T,Lee S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]. New York:Academic Press Inc,1990.
[11]Schabereiter-Gurtner C,Pinar G,Lubitz W,et al.An advanced molecular strategy to identify bacterial communities on art objects[J].Journal of Microbiological Methods,2001,45: 77-87.
[12]魏晓星.葡萄穗霉(Stachybotrys sp.)的分离鉴定及其β-葡萄糖苷酶的性质分析[D].北京:中国农业大学,2005.
[13]谢丽源,张勇,邓科君,等.基于rDNA ITS序列分析的桑黄真菌菌株分子鉴定[J].食品科学,2010,31(9):182-186.
[14]Tamura K,Dudley J,Nei M,et al.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J]. Molecular Biology and Evolution,2007,24(8):1596-1599.
[15]魏景超.真菌鉴定手册[M].上海:上海科技出版社,1979.
[16]中国科学院中国孢子植物志编辑委员会.中国真菌志第五卷.曲霉属及其相关有性型[M].北京:科学出版社,1997.
[17]中国科学院微生物研究所编写组.常见与常用真菌[M].北京:科学出版社,1973.
[18] Renske L,Paul A L,Than W K,et al.Molecular Identification of Ectomycorrhizal Mycelium in Soil Horizons[J]. Applied and Environmental Microbiology,2003,69(1):327-333.
[19]张传博,苏晓庆.几种基于基因组DNA的真菌分类技术研究进展[J].贵州师范大学学报:自然科学版,2006,24(1): 113-118.
[20]苏杨,张政,杨齐,等.纤维素降解真菌A25-2的分离、鉴定及其产纤维素酶的酶学特性[J].基因组学与应用生物学,2010,29(3):427-433.
[21]Agarwal M,Shrivastava N,Padh H.Advances in molecular marker techniques and their applications in plant sciences[J]. Plant Cell Reports,2008,27(4):617-631.
Isolation and identification of predominant spoiling strain M13 of mold in the stored maize
YUE Xiao-yu1,2,XU Jun1,ZHANG Heng-ye1,SUN Zhong-wei3,LI Xin1,LIU Xiang-dong2
(1.Zhengzhou College of Animal Husbandry Engineering,Zhengzhou 450011,China; 2.College of Engineering,China Agricultural University,Beijing 100083,China; 3.Suzhou International Development Venture Capital Holding Co.,Ltd.,Suzhou 215128,China)
It is very significant to research spoilage microorganisms in stored maize.A predominant strain of mold in the stored ice was isolated and identified.According to its morphological observation,phylogenetic analysis of ITS sequence and the reference manual related microbial identification,the strain was preliminary identified as Aspergillus oryzae.The measurement can be used as an accurate,reliable and straightforward method to identify the original species of the stored maize and explore genetic diversity.
maize;morphological characteristics;analysis of ITS sequence;phylogenetic tree
TS201.3
A
1002-0306(2011)11-0183-05
2011-08-04
岳晓禹(1974-),男,博士研究生,讲师,研究方向:食品微生物。
2011年河南省重点科技发展计划(112102110034);2011年度河南省教育厅自然科学研究计划项目(2011A550014);郑州牧专博士科研启动资金项目(5040190)。

