以甘油为原料合成2,3-环氧丙醇
吕学功,王赤炎,王丽红
(1.唐山市燃气集团有限公司,河北 唐山 063000;2.唐山师范学院 化学系,河北 唐山 063000)
近年来,在石化能源紧张情况下,生物柴油作为一种极有发展前景的生物能源得到了迅速发展[1-2]。在生物柴油的生产过程中会产生10%左右的副产甘油,因此生物柴油生产的大量增长,带来了其副产甘油的过剩,甘油价格骤降,据估计,2009~2010年甘油产量将超过45.4万t/ a,远大于甘油的传统市场规模[3]。由此,利用甘油生产高附加值化工产品,开发甘油新的利用途径,成了近期化工行业的研究热点之一。
粗甘油可以通过各种工艺路线转化为1,3-丙二醇、环氧氯丙烷、乳酸、聚羟基脂肪酸酯、氢、二羟基丙酮和1,2-丙二醇等高附加值产品[4],但现在的研究主要集中在1,3-丙二醇和环氧氯丙烷上[5-7],其他方面的报道甚少,为进一步拓宽甘油的利用途径,本文对以甘油为原料合成2,3-环氧丙醇的方法进行了探索。
2,3-环氧丙醇又名缩水甘油(以下简称环氧丙醇),主要用作环氧树脂稀释剂、塑料和纤维改性剂、卤代烃类的稳定剂、食品保藏剂、杀菌剂、制冷系统干燥剂和芳烃萃取剂等,其衍生物是树脂、塑料、医药、农药和助剂等的工业原料。目前工业上是以烯丙醇为原料,在催化剂存在下用过氧化氢作环氧化剂制得,如采用甘油为原料,不仅可以降低成本,还可摆脱对石油资源的依赖。
本文以甘油为原料,两步法合成了2,3-环氧丙醇,首先以甘油为原料制备了3-氯-1,2-丙二醇,然后3-氯-1,2-丙二醇在氢氧化钠存在下环化为环氧丙醇,制备反应式如下:
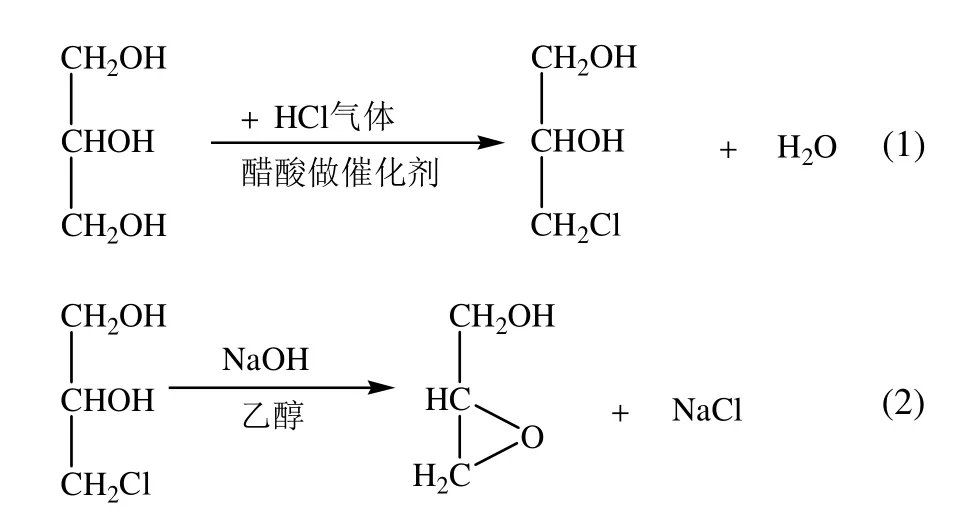
1 实验部分
1.1 试剂与仪器
试剂:HCl气体按照文献[8]中的盐酸滴入浓硫酸的方法制备,产气速度通过盐酸的滴加速度控制。甘油,冰醋酸,氢氧化钠,无水乙醇,均为AR。3-氯-1,2-丙二醇,环氧丙醇的标样均购自百灵威。
仪器:Agient6890N气相色谱仪,SHZ-D(Ⅲ)循环水式真空泵,ZXZ-2型旋片式真空泵。
1.2 合成
1.2.1 3-氯-1,2-丙二醇的制备
在三口瓶内加入一定量的甘油和冰醋酸,加热至 70℃保温,通入氯化氢气体,氯化氢气体通过一个特制的玻璃气体分布头以鼓泡的方式与甘油接触反应,未反应的尾气用碱液吸收,产气装置中浓硫酸温度控制在 60℃,盐酸滴加速度控制在40滴/min。控制反应温度100℃-105℃,当反应液的重量增加至初始液重量的150%,停止通气,结束反应。
将反应装置改为减压蒸馏装置,用循环水式真空泵对反应液进行减压蒸馏(真空度0.1MPa),收集 40-65℃之间的馏出液,以除去其中的盐酸、醋酸、以及生成的水;然后再用旋片式真空油泵对反应液进行减压蒸馏(真空度在101Kpa),收集 80-85℃之间馏分,即为 3-氯-1,2-丙二醇。产品外观为无色略粘稠的液体。
产品经气相色谱分析质量分数大于 99.0%,测定条件为毛细管柱(30m×0.319mm×0.25μm),FID检测器,载气为N2;分流比为80:1;检测器温度250℃;进样口温度260℃;柱温程序升温,初始温度为70℃,保持1min,15℃/ min升至110℃,保持1 min,25℃/ min升至200℃,保持1min;进样量1μl。采用面积归一法定量。
1.2.2 环氧丙醇的制备
0.5 mol的NaOH溶于200ml的无水乙醇中配成溶液,0.5mol的3-氯-1,2-丙二醇溶于100ml无水乙醇配成溶液,冰浴冷却。冷却后的NaOH乙醇溶液加入三口瓶中,冰浴,开动搅拌,滴加3-氯-1,2-丙二醇乙醇溶液,10min内滴完,再继续反应20min。过滤反应液,除去固体,滤液用循环水式真空泵减压蒸馏(真空度 0.1MPa),64-66℃之间馏分为环氧丙醇,64℃以前为乙醇和生成的水。产品外观为无色液体,比重1.12。产品经气相色谱分析质量分数大于99.0%,测定条件同1.2.1。
2 结果与讨论
2.1 甘油氯化的催化剂
反应式(1)所示的甘油氯化制备 3-氯-1,2-丙二醇的反应常采用羧酸做催化剂,为比较不同种类羧酸的催化效果,分别以冰醋酸、正丁酸、乙二酸、丁二酸、己二酸做催化剂,测定了不同催化剂下反应液的增重速率,结果如表1所示。反应液的增重速率越快,反应速度越快,催化剂的催化效果越好,由表1可见,冰醋酸、丁二酸、己二酸的催化效果较好,正丁酸、乙二酸的催化效果较差。考虑到冰醋酸的沸点(118.1℃)远低于丁二酸(235℃)和己二酸(337.5℃),在反应液的蒸馏过程中先于 3-氯-1,2-丙二醇和生成的水份一起蒸出,降低了3-氯-1,2-丙二醇的提纯难度,所以冰醋酸为最优的催化剂。
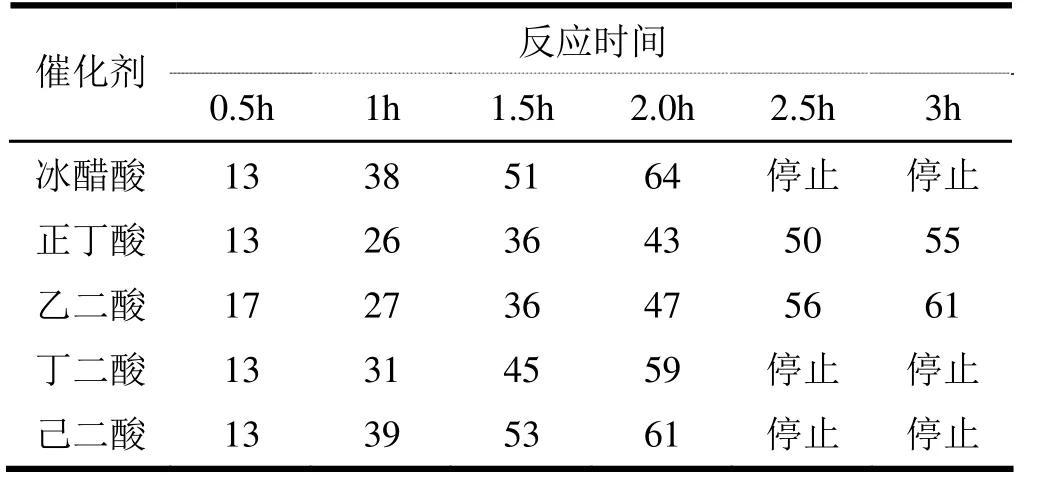
表1 不同催化剂催化时反应液增重速率
2.2 催化剂的用量
不同冰醋酸用量下反应达到终点时所需的时间见表2。当冰醋酸和甘油的摩尔比大于0.2:1时,反应时间明显缩短,所以冰醋酸的最佳用量为甘油摩尔数的0.2倍。此反应中,反应终点的控制尤其重要,到达反应终点时应及时停止通气,否则3-氯-1,2-丙二醇中的羟基将进一步被氯原子取代生成二氯丙醇。本实验中用反应液的增重来控制反应终点,当反应液增重至初始液重量的150%时,恰好是甘油中的羟基被一个氯原子取代。

表2 冰醋酸用量的影响
2.3 3-氯-1,2-丙二醇的环化
反应式(2)所示的反应为3-氯-1,2-丙二醇在碱性条件下脱掉一分子的HCl生成环氧丙醇。实验表明,3-氯-1,2-丙二醇在NaOH水溶液的碱性条件下并不能发生上述的环化反应,这可能是因为环化反应产物里有水生成,NaOH水溶液中大量水的存在抑制了环化反应向右进行,为使反应向生成环氧丙醇的方向进行,反应需在无水的环境下进行,因此选用NaOH的乙醇溶液作为3-氯-1,2-丙二醇环化的碱性条件。其次,通过热力学计算得知环化反应为放热反应,为及时移出反应热,促进反应向右进行,环化反应过程中用冰浴冷却。
实验结果表明,在NaOH的乙醇溶液中环化反应速率很快,30min内反应进行已很彻底,不同 3-氯-1,2-丙二醇和NaOH配比下的反应结果如表3所示。由表3可见,环化反应中3-氯-1,2-丙二醇和NaOH最佳摩尔比为1: 1,最佳环化时间为30min。环化反应中NaOH不宜过量,NaOH过量会导致后续的蒸馏过程中随着乙醇的蒸出,NaOH从蒸馏液中以固体形式析出,影响3-氯-1,2-丙二醇馏分的收集和蒸馏过程,增加了蒸馏操作的难度。

表3 NaOH用量的影响
3 结论
(1)以廉价的甘油为原料,采用两步反应制备了环氧丙醇:第一步,甘油和氯化氢气体在冰醋酸的催化下发生一氯取代反应,生成3-氯-1,2-丙二醇;第二步:3-氯-1,2-丙二醇在NaOH乙醇溶液中发生环化反应,生成环氧丙醇。
(2)甘油氯化为 3-氯-1,2-丙二醇的反应可以用羧酸类物质做为催化剂,最佳催化剂为冰醋酸,在蒸馏纯化的过程中随生成的水蒸出,降低了提纯的难度。冰醋酸的最佳用量为甘油摩尔数的0.2倍。
(3)环化反应需在无水的碱性条件下进行,在NaOH的乙醇溶液中环化时,3-氯-1,2-丙二醇和 NaOH最佳摩尔比为1: 1,最佳环化时间为30min。环化反应中NaOH不宜过量。

