婴幼儿奶粉和米粉中金黄色葡萄球菌的分离鉴定及其毒素基因检测
张 静,于三科,王 新*,乔明宇,周 婷,夏效东,杨保伟,席美丽,孟江洪
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.西北农林科技大学动物医学院,陕西 杨凌 712100)
婴幼儿奶粉和米粉中金黄色葡萄球菌的分离鉴定及其毒素基因检测
张 静1,2,于三科2,王 新1,*,乔明宇1,周 婷2,夏效东1,杨保伟1,席美丽1,孟江洪1
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.西北农林科技大学动物医学院,陕西 杨凌 712100)
目的:了解婴幼儿奶粉和米粉中金黄色葡萄球菌的污染及其毒素基因的携带情况。方法:采集陕西省18个地区不同品牌的婴幼儿奶粉143份和米粉224份,按国标法和PCR方法进行金黄色葡萄球菌分离鉴定;采用PCR方法检测ses基因、ets基因、tsst-1基因和pvl基因。结果:367份样品中检测出30个金黄色葡萄球菌污染样品,检出率为8.17%,其中奶粉11.19%(16/143)、米粉6.25%(14/224),分别从中分离鉴定出29株和25株金黄色葡萄球菌;从54株金黄色葡萄球菌中共检测到有64.8%(35/54)的菌株携带有毒素基因,其中奶粉72.4%(21/29)、米粉56.0%(14/25);奶粉分离株中检测到的毒素基因型有pvl、sea、seb、sed、seg、sea+pvl、seb+seg、seb+sed+seg、sec+pvl、sec+seg+pvl和seg+pvl,其检出率分别为10.3%(3/29)、3.4%(1/29)、3.4%(1/29)、3.4%(1/29)、6.9%(2/29)、6.9%(2/29)、6.9%(2/29)、3.4%(1/29)、3.4%(1/29)、13.8%(4/29)和 10.3%(3/29);米粉分离株中检测到的毒素基因型有pvl、sed、seg、sea+seg+pvl、sec+pvl、sec+seg、sec+see+seg、sec+see+seg+pvl、see+pvl和seg+pvl,其检出率分别为8%(2/25)、4%(1/25)、4%(1/25)、4%(1/25)、4%(1/25)、8%(2/25)、4%(1/25)、4%(1/25)、4%(1/25)和12%(3/25)。奶粉和米粉中都没有检测到ets、tsst-1和seh、sei、sej基因。结论:婴幼儿奶粉和米粉中均存在一定程度的金黄色葡萄球菌的污染,且多数菌株都携带一定的毒素基因,这对消费这些产品的婴幼儿身体健康构成潜在的危险。
奶粉;米粉;金黄色葡萄球菌;毒素基因
金黄色葡萄球菌(Staphylococcus aureus,S. aureus)是一种重要的食源性致病菌,在很多国家,它被认为是第二大食源性致病菌,仅次于沙门氏菌,占细菌性食物中毒的33%[1];该菌在加拿大引起食物中毒的发生率更高,占45%[2]。金黄色葡萄球菌在自然界很常见,在土壤、空气、动物及健康人群等均可存在。食品从农田到餐桌过程中均可能受到污染。婴儿食品如奶粉、米粉等食品的加工过程虽受到严格的控制,但还是可能会受到不同程度的污染,这些被金黄色葡萄球菌污染的食物,可能会引起婴儿对该菌的感染或食物中毒。
金黄色葡萄球菌产生多种外毒素,主要有肠毒素(staphylococcal enterotoxins,Ses),剥脱毒素(exfoliative toxins,Ets),中毒休克毒素-1(toxic-shock syndrome toxin-1,Tsst-1)和杀白细胞素(paton-valentine leukocidin,Pvl)等[3-7]。肠毒素是引起食物中毒的主要致病因子,除Sea、Seb、Sec和Sed这4种早已被鉴定的血清型外,近几年还发现了See、Seg、Seh、Sei、Sej等新型肠毒素[8-10]。剥脱毒素大约5%的金黄色葡萄球菌产生,该毒素主要引起皮散热功能失调,最严重的是引起金黄色葡萄球菌散热性皮肤灼伤综合症,对婴幼儿和儿童危害严重[11-12]。中毒休克毒素-1是中毒休克毒素中最重要的一种,它对女性危害严重,可产生高水平的抗体,从而引起局部或全身的中毒休克综合症[13]。大约5%的金黄色葡萄球菌存在杀白细胞素,该毒素可引起皮肤、软组织感染和严重的坏死性肺炎[14]。
近年来,国内外对鸡肉、猪肉、冰激凌、凉拌菜等各种食品中金黄色葡萄球菌污染状况和毒素基因携带情况有较多的调查报道,但国内外对婴幼儿奶粉和米粉中金黄色葡萄球菌的报道较少。奶粉和米粉已成为婴幼儿必备的辅助食物或主要食物,鉴于其原料的易污染性,婴幼儿食品中可能存在被金黄色葡萄球菌污染。本研究采用国标培养法和PCR方法进行分离鉴定S. aureus及其毒素基因检测,初步了解婴幼儿奶粉和米粉中S.aureus的流行状况及毒素基因分布情况,为婴幼儿食品的安全评估提供理论依据。
1 材料与方法
1.1 培养基和主要试剂
缓冲蛋白胨水(BPW)、胰蛋白胨大豆肉汤(TSB)、Barid-Parker培养基(BP)、LB营养琼脂 北京陆桥技术有限责任公司;TaqDNA聚合酶、dNTPs、2000bp DNA marker、引物 大连宝生物公司;琼脂糖(agarose)美国Sigma公司;甘油、氯化钠 西安化学试剂厂。
1.2 样品采集及S. aureus分离
2010年7、8月采集陕西省18个地区不同品牌的婴幼儿奶粉和米粉样品共计367份,其中奶粉143份、米粉224份。依据GB/T 4789.10—2008《金黄色葡萄球菌检验》方法,取25g奶粉或米粉样品接种于225mL的BPW培养基中,37℃培养24h,取增菌培养液3mL接种于30mL 7.5% NaCl TSB肉汤中,37℃培养24h。用棉签从增菌液中划到Baird-Parker Agar平板中,37℃培养24h,每个可疑样品挑取1~2个菌落,进行纯化培养。nuc基因的PCR反应条件,参照文献[12]执行,最后取5μL PCR产物进行电泳检测,进行S. aureus确证。
1.3 基因组 DNA的提取
用棉签蘸取纯培养细菌,置入装有500μL蒸馏水的离心管中,混匀。加热煮沸30min后,13000r/min离心5min,取上清液。于-30℃冰箱中保存备用。
1.4 PCR扩增及引物设计
按照Brakstad等[15]的报道,执行nuc基因的引物合成和扩增条件,以确定金黄色葡萄球菌。按照王琴等[16]报道执行pvl基因引物合成和扩增条件。按照Peles等[6]的报道执行ses和tsst-1引物合成和扩增条件。按照Noguchi等[17]的报道执行剥落毒素基因(eta、etb基因)引物合成和扩增条件。以上引物均由大连宝生物公司合成,引物序列及片段长度见表1。
1.5 电泳
PCR产物进行琼脂糖凝胶电泳,凝胶量为1%,利用标准大小的DNA Marker,观察电泳完成后的凝胶,并记录PCR扩增的结果。
2 结果与分析
2.1S. aureus分离鉴定
367份样品中检测出30个金黄色葡萄球菌污染样品,检出率为8.17%,其中奶粉143份当中有16份(11.19%)金黄色葡萄球菌阳性,并从中分离鉴定出29株金黄色葡萄球菌;米粉224份当中有14份(6.25%)金黄色葡萄球菌阳性,从中分离鉴定出25株金黄色葡萄球菌,结果如表2所示。

表1 PCR扩增引物Table 1 Oligonucleotide primers used in PCR

表2 婴幼儿奶粉和米粉中金黄色葡萄球菌分离情况Table 2 Prevalence of S.aureus in infant milk powder and rice cereal
2.2 毒素基因的检测
本研究对54株金黄色葡萄球菌菌株进行毒素基因检测,结果如表3所示。共检测到35株(64.8%)细菌携带有毒素基因,其中奶粉21株(72.4%)、米粉14株(56.0%);pvl的检出率为40.57%(22/54),奶粉和米粉分离株的检出率分别为44.83%(13/29)和36%(9/25)。奶粉分离株中携带的毒素基因型有pvl、sea、seb、sed、seg、sea+pvl、seb+seg、seb+sed+seg、sec+pvl、sec+seg+pvl基因和seg+pvl基因,其检出率分别为10.3%(3/29)、3.4%(1/29)、3.4%(1/29)、3.4%(1/29)、6.9%(2/29)、6.9%(2/29)、6.9%(2/29)、3.4%(1/29)、3.4%(1/29)、13.8%(4/29)和10.3%(3/29)。奶粉分离株肠毒素基因携带率最高的是seg基因占41.4%(12/29);米粉分离株中携带的毒素基因型分别为p v l、s e d、seg、se a+se g+pv l、sec+pv l、se c+se g、sec+see+seg、sec+see+seg+pvl、see+pvl基因和seg+pvl基因,检出率分别为8%(2/25)、4%(1/25)、4%(1/25)、4%(1/25)、4%(1/25)、8%(2/25)、4%(1/25)、4%(1/25)、4%(1/25)和 12%(3/25);米粉分离株肠毒素基因携带率最高的是seg基因,占41.4%(12/29)。奶粉和米粉中都没有检测到ets、tsst-1、seh、sei基因和sej基因。
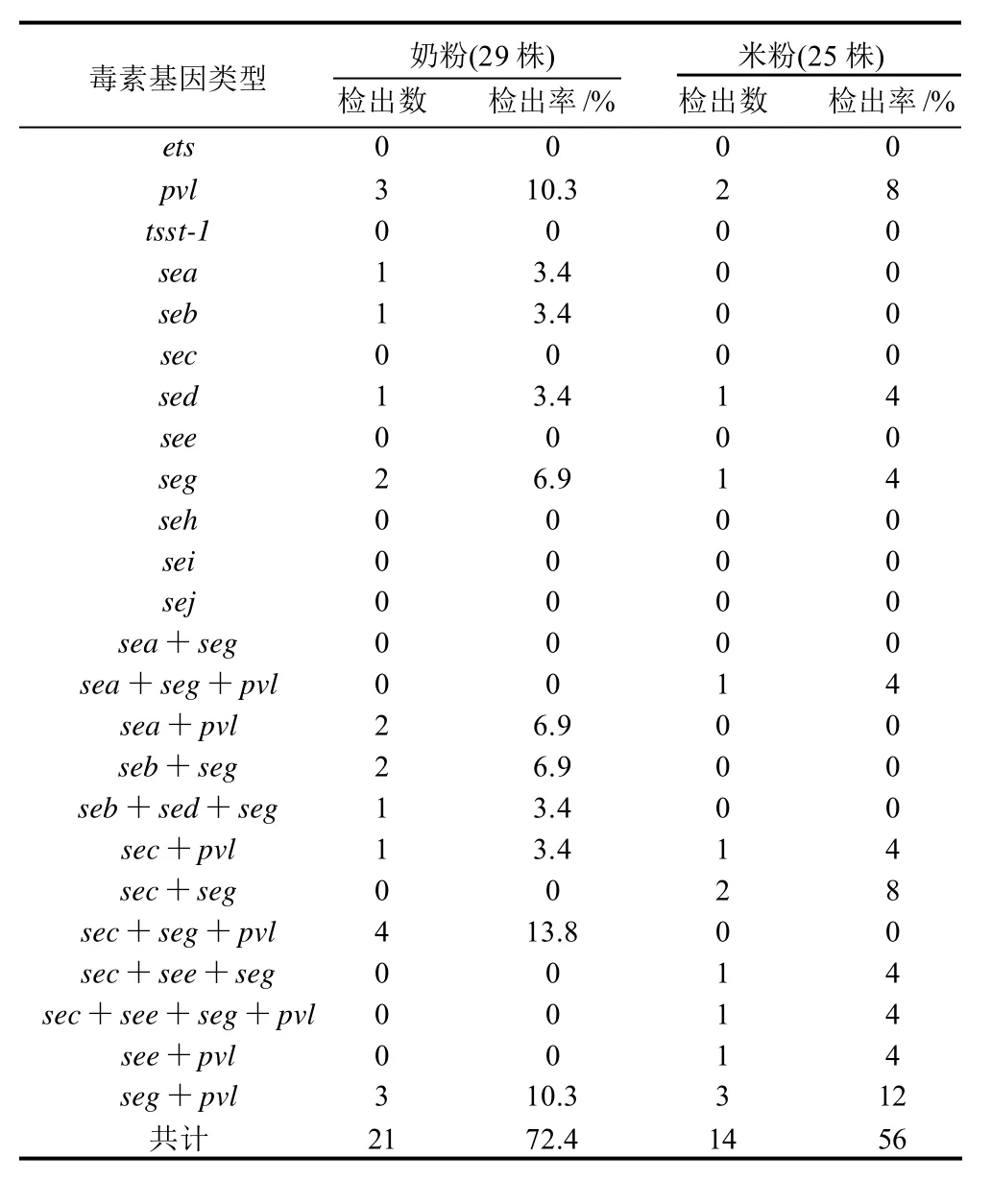
表3 54株金黄色葡萄球菌ets、tsst-1、pvl和ses毒素基因检测结果Table 3 PCR detection of ets, tsst-1,pvl and ses genes from 54 Staphylococcus aureus isolates
3 讨 论
金黄色葡萄球菌是重点监测的人畜共患致病菌,原则上不允许在食品中检出。但从本研究结果可以看出,婴幼儿奶粉和米粉中均存在金黄色葡萄球菌的污染,污染率分别是11.19%和6.25%。与印伯星等[18]报道的从生牛奶中金黄色葡萄球菌的污染率为16.27%基本一致;而与雷云瑞等[19]报道食品中的金黄色葡萄球菌的污染率66.7%存在较大差异,这可能与采集的样品种类、采样地点及包装方式等有关。此外,近年来,由于“劣质奶粉”事件的频发,使政府加强了对婴幼儿食品的监管,这可能也是此次检出率较低的原因之一。
从表3可以看出,婴幼儿奶粉和米粉中金黄色葡萄球菌携带毒素基因型存在的种类众多,但两者菌株所携带的毒素基因的类型不同,其中奶粉和米粉的毒素基因的阳性率分别为72.4%(21/29)和56%(14/25),表示同一地区不同食品中可能污染的来源及途径可能不同,流行株也有可能不同,因此,毒素基因的检出率和菌株携带毒素基因的类型也不同。pvl的检出率为40.57%(22/54),奶粉和米粉分离株的检出率分别为44.83%(13/29)和36%(9/25),这都与Gillet等[14]报道的检出率小于4.5%有较大差异,说明不同国家和地区pvl的检出率不同,提示食品中pvl毒素基因的流行可能具有地域性,也说明了陕西省市售婴幼儿奶粉和米粉中S. aureus菌株携带pvl毒素基因较高,应加强该毒素的检测。
章乐怡等[8]通过用PCR法测定食物中毒及食品中金黄色葡萄球菌的肠毒素基因(sea-sej)研究表明,肠毒素基因检测率84.41%,其中在食品样品分离株中,肠毒素基因携带率最高的是seh基因,而食物中毒标本分离株中,肠毒素基因携带率最高的是sea基因。李婉芬报道[9]生牛奶中金黄色葡萄球菌肠毒素基因(sea-seq)检测率为56.36%,肠毒素基因携带率最高的是50.9%sej,其次为seg和sem,分别为23.63%和18.8%。本研究中肠毒素基因(sea-sej)的检出率为55.6%(30/54),其中在奶粉样品分离株中,肠毒素基因携带率最高的是seg基因占41.4%(12/29),而米粉分离株中肠毒素基因携带率最高的也是seg基因占36%(9/25)。这可能与菌株来源不同、不同食品加工处理过程中程序不同,以及操作人员的携带情况不同等有关,也进一步说明了不同地区,不同食品中金黄色葡萄球菌肠毒素基因流行情况不同。
本实验通过PCR方法检测到这些肠毒素基因的存在,可能存在这些肠毒素基因不表达[20],但是现在肠毒素的检测仅限制在传统肠毒素Sea、Seb、Sec、Sed和See上,现在越来越多的报道证实除Sea-See以外的新型肠毒素也可以引起食物中毒[10]。而PCR方法不仅可以检测传统肠毒素基因还可以检测许多新型肠毒素基因[8-10],这样可以快速检测到这些肠毒素基因的存在,可以快速判定这些肠毒素可能存在,降低由金黄色葡萄球菌肠毒素引起食物中毒的风险。
有人认为传统肠毒素Sea、Seb、Sec、Sed和See占金黄色葡萄球菌引起食物中毒的95%,而新型肠毒素仅占5%[8]。本次研究发现,新型肠毒素seg基因也广泛存在于金黄色葡萄球菌中,并且比较有趣的是在本次检验的样品中新型肠毒素seg基因最多,占38.9%(21/54)。国内王赞信等[10]对一起食物中毒金黄色葡萄球菌肠毒素基因(sea-sej基因)进行检测,仅检测到了seg基因和sei基因,说明seg基因和sei基因的存在可能与中毒有关。在本研究中也检测到了传统肠毒素sea、seb、sed基因和see基因的存在,进一步说明陕西省市售婴幼儿奶粉和米粉中存在一定的安全隐患。婴幼儿作为一个特殊的抵抗力弱的群体,对于其食品的安全性,更应时刻引起注意。相关企业应严格按照国家有关的规定进行生产,确保婴幼儿的身体健康提供良好的保证。同时相关部门也应加强监管的力度,确保婴幼儿食品的安全。
[1] ATANASSOVA V, MEINDL A, RING C. Prevalence ofStaphylococcus aureusandStaphylococcal enterotoxinsin raw pork and uncooked smoked ham: a comparison of classical culturing detection and RFLPPCR[J]. Int J Food Microbiol, 2001, 68(1/2):105-113.
[2] 张严峻, 张俊彦, 梅玲玲, 等. 金黄色葡萄球菌肠毒素基因的分型和分布[J]. 中国卫生检验杂志, 2005, 15(6): 682-684.
[3] FRANCIS J S, DOHERTY M C, LOPATIN U, et al. Severe community-onset pneumonia in healthy adults caused by methicillin-resistantStaphylococcus aureuscarrying the Panton-Valentine leukocidin genes[J]. Clin Infect Dis, 2005, 40(1):100-107.
[4] MORONEY S M, HELLER L C, ARBUCKLE J, et al. Staphylococcal cassette chromosome mec and Panton-Valentine leukocidin characterization of methicillin-resistantStaphylococcus aureusclones[J]. J Clin Microbiol, 2007, 45(3): 1019-1021.
[5] DINGES M M, ORWIN P M, SCHLIEVERT P M. Exotoxins ofStaphylococcus aureus[J]. Clin Microbiol Rev, 2000, 13(1): 16-34.
[6] PELES F, WAGNER M, VARGA L, et al. Characterization ofStaphylococcus aureusstrains isolated from bovine milk in Hungary[J]. Int J Food Microbiol, 2007, 118(2): 186-193.
[7] SUDAGIDAN M, AYDIN A. Virulence properties of methicillin-susceptibleStaphylococcus aureusfood isolates encoding Panton-Valentine Leukocidin gene[J]. Int J Food Microbio, 2010, 138(3): 287-291.
[8] 章乐怡, 李毅, 马雪莲. 食物中毒及食品中金黄色葡萄球菌的肠毒素及基因的研究[J]. 中国卫生检验杂志, 2009, 19(12): 2851-2853.
[9] 李婉芬. 生牛奶中金黄色葡萄球菌肠毒素基因的检测与分布[J]. 中国卫生检验杂志, 2008, 18(5): 843- 844; 849.
[10] 王赞信, 张俊彦, 朱敏, 等. 一起食物中毒金黄色葡萄球菌肠毒素基因的检测[J]. 中国卫生验杂志, 2006, 16(6): 665-666; 668.
[12] SHAMEZ L, CHRISTOPHER L J, DENISE P L, et al. Clinical,microbial, and biochemical aspects of the exfoliative toxins causing staphylococcal scalded-skin syndrome[J]. Clin Microbiol Rev, 1999, 12(2): 224-242.
[13] RAUMANNS J, KAUFHOLD A, BEHRENDT W, et al. Verlaufendes nicht-menstruelles Toxic-shock-syndrom beiStaphylococcus aureussepsis[J]. Anaesthesist, 1995, 44(12): 869-874.
[14] GILLET Y, ISSARTEL B, VANHEMS P, et al. Association betweenStaphylococcus aureusstrains carrying gene for Panton-Valentine leukocidin and highly lethal necrotising pneumonia in young immunocompetent patients[J]. Lancet, 2002, 359: 753-759.
[15] BRAKSTAD O G, AASBAKK K, MAELAND J A. Detection ofStaphylococcus aureusby polymerase chain reaction amplification of thenucgene[J]. J Clin Microbiol, 1992, 30(7): 1654-1660.
[16] 王琴, 杨丽美, 骆方军, 等. 金黄色葡萄球菌耐药性及mecA、qacA/B和pvl基因检测[J]. 中华临床感染病杂志, 2009, 2(2): 102-105.
[17] NOGUCHI N, NAKAMINAMI H, NISHIJIMA S, et al. Antimicrobial agent of susceptibilities and antiseptic resistance gene distribution among methicillin-resistantStaphylococcus aureusisolates from patients with impetigo and staphylococcal scalded skin syndrome[J]. J Clin Microbiol,2006, 44(6): 2119-2125.
[18] 印伯星, 巢国祥, 顾瑞霞. 生乳中金黄色葡萄球菌产肠毒素特性及耐药性分析[J]. 食品研究与开发, 2006, 27(11): 43-46.
[19] 雷云瑞, 柴文平, 解立满. 廊坊市食品中金黄色葡萄球菌的检测及污染状况分析[J]. 食品与发酵科技, 2010, 46(1): 100-104.
[20] OMOE K, ISHIKAWA M, SHIMODA Y, et al. Detection ofseg,seh,andseigenes inStaphylococcus aureusisolates and determination of the enterotoxin productivities ofS. aureusisolates harboringseg,seh, orseigenes[J]. Journal of Clinical Microbiology, 2002, 40(3): 857-862.
Isolation, Identification and Toxin Genes Detection ofStaphylococcus aureusStrains from Infant Milk Powder and Infant Rice Cereal
ZHANG Jing1,2,YU San-ke2,WANG Xin1,*,QIAO Ming-yu1,ZHOU Ting2,XIA Xiao-dong1,YANG Bao-wei1,XI Mei-li1, MENG Jiang-hong1
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China;2. College of Veterinary Medicine, Northwest A&F University, Yangling 712100, China)
Objective: To investigate the prevalence and toxin genes profile ofStaphylococcus aureusin infant milk powder and infant rice cereal marketed in Shaanxi province, China. Methods: Totally 367 various samples from 18 regions in Shaanxi province were tested by the national standard method to isolateStaphylococcus aureus; the nuc genes were examined to confirmStaphylococcus aureusstatus;Staphylococcus aureusenterotoxin genes, exfoliative toxins genes, toxic-shock syndrome toxin-1 gene and Panton-Valentine Leukocidin gene were detected by PCR. Results: Of 367 samples examined, 30 were positive forStaphylococcus aureus, result in a positive rate of 8.17% (30/367), including 11.19% (16/143) milk powder samples and 6.25%(14/224) rice cereal samples. From these positive samples, 29 and 25 strains were isolated from milk powder and rice cereal samples respectively. Among all identifiedStaphylococcus aureusisolates, 34 strains harbored at least one of the tested toxin genes.The toxins gene profiles detected inS. aureusfrom infant milk powder samples werepvl,sea,seb,sec,sed,seg,seb+seg,sec+segandseb+sed+seg, and their positive rates were 44.82% (13/29), 10.34% (3/29), 13.79% (4/29), 17.24% (5/29), 6.89% (2/29),41.38% (12/29), 10.34% (3/29), 10.34%(3/29) and 3.45% (1/29) respectively; The toxin gene profiles inS. aureusfrom infant rice cereal samples werepvl,sea,sec,sed,see,seg,sea+seg,sec+segandsec+see+seg, and the positive rates were36% (9/25), 4% (1/25), 20% (5/25), 4% (1/25), 12% (3/25), 36% (9/25), 4%(1/25), 16% (4/25) and 8% (2/25), respectively. Neitherets,tsst-1,seh,seinorsejgenes were detected in infant milk powder or infant rice cereal. Conclusion: Infant milk powder and infant rice cereal in Shaanxi province were contaminated withS. aureus, some of which contained various toxin genes. The existence of the pathogen in these food products may constitute a potential risk for infants,health.
infant milk powder;infant rice cereal;Staphylococcus aureus;toxins genes
2010-12-22
张静(1987—),女,硕士研究生,研究方向为动物疾病防治。E-mail:0503108029@163.com
*通信作者:王新(1973—),男,讲师,博士,研究方向为食源性病原及分子生物学。E-mail:xinwang7516@yahoo.com.cn
X172
A
1002-6630(2011)20-0167-04

