头孢克肟固体分散体的制备及溶出度测定
(1.武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北 武汉 430074;
2.湖北省襄樊市中心医院,湖北 襄樊 441021)
头孢克肟固体分散体的制备及溶出度测定

(1.武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北 武汉 430074;
2.湖北省襄樊市中心医院,湖北 襄樊 441021)
采用固体分散体技术提高头孢克肟在水中的溶解度,以提高生物利用度.以A为载体,采用溶剂-熔融法制备头孢克肟固体分散体.用正交设计方法优选制剂工艺,确定出最优处方为:头孢克肟∶载体A∶乙醇=l∶4∶8(g/g/g).选用红外光谱法对头孢克肟固体分散体进行物相鉴定,并测定其溶出度.结果表明:头孢克肟-载体A(1∶4)固体分散体在水中(20℃)的溶出度为95.2%,明显高于原料药(24.8%)及物理混合物(28.6%);红外光谱法检测出头孢克肟固体分散体在1 780 cm-1附近处的羰基吸收峰的强度大幅度降低.说明采用溶剂-熔融法形成了头孢克肟固体分散体.头孢克肟形成稳定的固体分散体后,溶出度显著提高.
头孢克肟;固体分散体;制备;溶出度;红外光谱
0 引 言
头孢克肟(Cefixime、Cefspan,Cef)是第三代口服头孢菌素[1],由日本藤泽(Fujisawa)公司开发,具有抗菌谱广,口服后吸收良好,组织分布广泛等特点,因此将其拓展制成兽药,可用于治疗一些人畜共患细菌感染疾病[2-3].然而,考虑到动物给药的局限性及头孢克肟难溶于水[4]的特性,故考虑将其制成易溶于水的固体粉剂[5-6],大大提高其水溶性,同时克服溶液剂运输、携带、贮存不便的缺点,待使用时将固体分散体投入水中,形成均相溶液,方便动物给药,提高生物利用度.
1 实验部分
1.1 仪器
电子天平(AB204-N 型,上海 Mettler-toledo公司);集热式恒温加热磁力搅拌器(DF-101S型,上海东玺制冷仪器设备有限公司);旋转蒸发仪(RE-52型,上海玻璃仪器厂);循环水式真空泵(SHZ-D(Ⅲ)型,巩义市英峪予华仪器厂);高效液相色谱仪(戴安P680 HPLC PUMP);数控超声波清洗器(KQ5200DB型,昆山市超声仪器有限公司);红外光谱仪(FTIR-650,天津天光光学仪器有限公司);溶出度测定仪(RC-8D,天津天光光学仪器有限公司);自动双重纯水蒸馏器(SZ-93型,上海亚荣生化仪器厂);电热鼓风干燥箱(CS101-1 AB型,重庆银河试验仪器有限公司);真空干燥箱(WG2003型,重庆四达实验仪器有限公司).
1.2 材料与试剂
Cef对照品[湖北赛博药业有限公司实验室精制质量分数99.97%(HPLC)];Cef原料药(湖北赛博药业有限公司,质量分数98.50%);乙醇(天津市博迪化工有限公司,质量分数95%);载体A(国药集团化学试剂有限公司,化学纯);磷酸二氢钾(北京亚太龙兴化工有限公司,化学纯);氢氧化钠(国药集团化学试剂有限公司,化学纯);溴化钾(北京康普汇维科技有限公司,分析纯);Cef固体分 散 体 (自 制,批 号:20100511、20100512、20100513);复合膜软包装(上海宏利药用包装材料有限公司,药用级);微孔滤膜(0.45μm,上海兴亚净化材料厂);蒸馏水(自制);娃哈哈纯净水(市售).
2 实验方法
2.1 Cef固体分散体的制备
本试验采用溶剂-熔融法法制备Cef固体分散物[7].按处方量称Cef原料药,载体A,溶剂乙醇.先将Cef置于乙醇中,震荡使其溶解,备用,再将载体A在水浴(70℃)水浴上加热熔融,在剧烈搅拌下分批加入Cef溶液,保持一定的搅拌速度搅拌10 min,待溶剂蒸发完全得到浅黄色粘稠液体,骤降温度,使之固化,真空干燥,粉碎过筛即得.
2.2 Cef固体分散体的溶出度测定
色谱条件:色谱柱为 Dionex C18(5μm,250 mm×4.6 mm);流动相为四丁基氢氧化铵溶液(取质量分数为10%四丁基氢氧化铵溶液25 m L,加水1 000 m L,摇匀,用1.5 mol·L-1磷酸溶液调节p H 值至7.0);乙腈(775:225);流速:1.5 m L/min;检测波长:239 nm;进样量20μL;柱温:30℃.
2.2.1 标准曲线的制备[8]精密称取适量的Cef标准品,以p H7.0的磷酸盐缓冲液为溶剂,配成系列质量浓度的标准品溶液(20、40、60、100、160、200、300、400μg/m L),分别进样20μL,每个样品重复测定5次,以质量浓度(C)为横坐标,峰面积(A)为纵坐标进行线性回归,得回归方程:A=0.576 4C+0.294 4(R2=0.999 9).结果表明,标准曲线在20~400μg/m L的范围,线性关系良好.
2.2.2 溶出度的测定[9]取经过脱气处理的蒸馏水注入溶出杯中,体积为V(1 000 m L),取含Cef标示量为a(%)的样品,放入溶出杯中,投入的质量为m(mg),将搅拌桨降至容器中,温度为37℃,保持转速为100 r/min,以药物接触溶出介质开始计时,至5、10、15、20、30、40、50 min时取样10 m L,同时立即补充蒸馏水10 m L,取出的液体经0.45μm的微孔滤膜过滤后,弃去初滤液,精密移取续滤液2 m L置10 m L容量瓶中,加溶剂定容,取20μL注入液相色谱仪,测出峰面积(A),由标准曲线得到样品溶液中头孢克肟的质量浓度C(μg/m L),按照下式计算 Cef的累积溶出度Y(%):

2.3 正交实验
选择影响药物溶出度的4个因素:A为Cef与载体 A 的比例(g/g),B为溶剂乙醇的用量(g),C为温度(℃),D 为时间(min).在Cef的用量为1 g的情况下,采用正交设计的方法进行制备工艺条件的优化,选取L9(34)正交表(见表1),以制备的固体分散体在水中的溶出度为考察指标,以极差法对结果进行分析,选出最优条件.
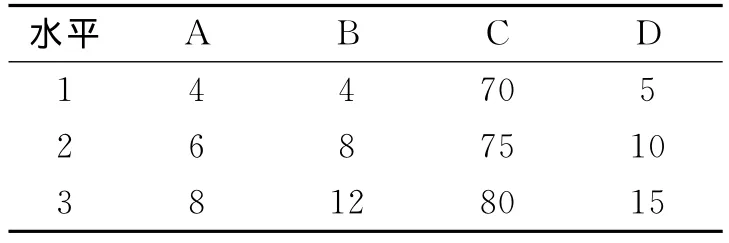
表1 因素水平表Table 1 Factors level table
2.4 固体分散物的验证
2.4.1 红外光谱测定 用溴化钾将Cef固体分散体(1∶4,批号20100511)、Cef原料药、载体A、物理混合物(1∶4,物混物)分别压片,在500~4 000 cm-1范围内分别测定红外吸收光谱.
2.4.2 溶出度的测定 取适量的Cef原料药、Cef固体分散体(1∶4,批号20100511)、物理混合物(1∶4,物混物)分别按2.2.2项下操作,并计算其累计溶出度.
2.5 固体分散物的质量考察
2.5.1 固体分散物在水溶液中稳定性考察 取Cef固体分散物(1∶4,批号20100511)适量撒于水中,分别在5 min、30 min时,1 h、2 h、4 h、6 h、8 h取样,样品溶液经0.45μm的微孔滤膜过滤后,弃去初滤液,精密移取续滤液2 m L置10 m L容量瓶中,加溶剂定容,取20μL注入液相色谱仪,测出峰面积(A),由标准曲线得到样品溶液中Cef的质量浓度C(μg/m L),计算Cef的标示百分含量(%),同时观察HPLC图谱中是否有新的吸收峰产生.
2.5.2 加速实验的稳定性 在超长的条件下进行的.其目的是通过加速药物的化学或物理变化,探讨药物的稳定性,为处方设计、工艺改进、质量研究、包装改进、运输、贮存提供必要的资料.将按正交设计最优处方制备的3批样品(批号20100511、20100512、20100513),按照按市售包装,在温度(40±2)℃,相对湿度(75±5)%的条件下放置6个月.所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度与湿度进行监测.在试验期间第1个月、2个月、3个月、6个月末分别取样一次,按稳定性重点考察项目检测.以确定其稳定性.
3 结果与分析
3.1 正交优化结果
正交试验极差分析结果见表2.
分析可知,试验号为2,3,8的工艺制备的Cef固体分散体水溶性较好,其溶出百分率分别为96.16%,95.13%,96.11%,综合考虑载药量、制备成本及操作可行性,2号试验溶剂用量小,搅拌时间较短,制备温度要求低,且溶解性最好.故初步选定2号为最佳制备工艺.

表2 正交优化实验表Table 2 The date of orthogonal experiment
极差分析结果表明,影响Cef固体分散体的溶出度的因素分别为:溶剂用量﹥搅拌时间﹥药物与载体的比例﹥温度.溶剂用量对Cef固体分散体的溶解度的影响最大,故在制备时要严格控制溶剂用量.其次为搅拌时间,而药物与载体的比例和制备温度对Cef的溶解度影响不是非常显著.确定最佳处方比例为Cef:载体 A∶乙醇=1∶4∶8(g/g/g);最佳制备工艺为温度75℃,搅拌时间15 min.
采用最优方案(2号)进行3批的验证实验,结果 3 批 样 品 (批 号:20100511、20100512、20100513)的溶出度分别达到96.11%、96.25%和96.17%,表明该处方和制备工艺具有较强的可重复性和可信性.
3.2 固体分散物的验证
3.2.1 红外光谱图 红外光谱测定结果表明,Cef原料药及物理混合物均于1 780 cm-1附近有强吸收峰(羰基吸收峰),而Cef固体分散体在1 780 cm-1附近处的羰基吸收峰的强度大幅度降低,说明原料药已经形成固体分散体.固体分散体中Cef的羰基吸收峰强度降低,可认为是Cef与载体在固体分散体中以氢键缔合所致.
3.2.2 溶出度 测定结果如图1所示.

图1 溶出度曲线Fig.1 The dissolved curve
由图1可见,Cef制备成固体分散体后,常温(20℃)条件下的溶出速率大大增加,其5 min内的溶出度即可高达88%.比较Cef原料、Cef物混物和Cef固体分散物的溶出率曲线,三者在50 min时溶出度接近最大值,分别为24.8%、28.6%和95.2%.因此,将头孢克肟制备成固体分散体,其溶出度有很大的提高,约为原料药、物理混合物溶出度的4倍.
3.3 固体分散体的质量考察
3.3.1 固体分散体在水溶液中稳定性考察
固体分散体在水溶液中稳定性考察固体分散体在水溶液中稳定性考察结果见图2.

图2 Cef固体分散体在水溶液中随时间变化而引起的含量变化Fig.2 The concentration change of solid dispersion in water as time changed
由图2可见,固体分散物在水溶液中的溶解速率极快,30 min时溶出度达到93.2%,之后Cef在水中的浓度保持恒定.结果表明:头孢克肟固体分散体在水溶液中稳定性好.观察测定Cef含量时的HPLC图谱可知,样品溶液随着时间的延长,图谱中无新的吸收峰产生,表明未产生其他杂质.3.3.2 初步稳定性考察 加速实验结果表明:市售包装的头孢克肟固体分散体在温度(40±2)℃,相对湿度(75±5)%的实验条件下放置6个月,样品的各项检测指标均无明显变化,该结果表明本品质量稳定.
4 结 语
a.以A为载体,采用溶剂一熔融法制备的固体分散体能显著提高Cef的溶解度和溶出度,Cef固体分散物的溶解度是原料药的4倍,较好的促进其溶解.
b.通过单因素考察以及正交设计的方法,对影响Cef固体分散体溶出度的因素进行筛选,得到最优工艺为Cef∶载体A∶溶剂=1∶4∶8(g/g/g).
c.对固体分散体进行验证,红外光谱和溶出度测定结果证明头孢克肟固体分散体形成.
d.通过对其在水溶液中的稳定性和初步稳定性的考察,表明制备的Cef固体分散物稳定性良好.
[1]崔福德.药剂学[M].5版.北京:人民卫生出版社,2005.
[2]Meir B,John A, Morrison B.Dose-Dependent Pharmacokinetics of a New Oral Cephalosporin,Cefixime,in the Dog[J].Pharmaceutical Research,1987,4(1):33-37.
[3]丁金富.头孢克肟原料药的生产、应用与市场[J].精细与专用化学品,2003,12:10-13.
[4]黎璐平,刘永红.头孢克肟在纯水和人工肠液中溶解度关联[J].武汉工程大学学报,2011,33(8):60-63.
[5]何国熙.固体分散体技术在药剂学上的应用[J].广东药学院学报,1995,15(1):33-35.
[6]卢胜明.固体分散技术-一种新型兽药制剂技术[J].兽药与饲料添加剂,2003(2):16-17.
[7]祁雯雯,李俊杰,刘永琼,等.妥曲珠利固体分散物的制备[J].中国兽药杂志,2009,43(4):34-37.
[8]刘文英.药物分析[M].北京:人民卫生出版社,2004:77-78,304.
[9]中国兽药典委员会.中华人民共和国兽药典[M].北京:中国农业出版社,2005.
Preparation and dissolution of cefixime solid dispersion
YAN Shao-kang1,LIU Yong-hong2,LI Lu-ping1,XIAO Fang1,LIU Yong-qiong1
(1.Key laboratory for Green Chemical Process of Ministry of Education,Hubei key Laboratory of Novel Chemical reacfor&Green Chemical Technotogy,School of Chemical Engineering&Pharmacy,Whan Institute of Technotogy,Wuhan 430074,China;
2.Xiangfan Central Hospital,Xiangfan 441021,China)
The technology of solid dispersion to improve the dissolution of cefixime and its bioavailability was used.Taking A as the carrier,using solvent-melting method to prepare the cefixime solid diapersion and using orthogonal design to perfect preparation technology,the best prescription was cefixime∶carrier A∶alcohol=1∶4∶8(g/g/g).Choosing the technology of infrared spectrum to identify the phase of cefixime solid diapersion and determine its dissolution,the result shows that the dissolution of cefiximecarrier A(1∶4)solid dispersion 95.2%is obviousiy exceeding the active pharmaceutical ingredient 24.8%and physics mixture 28.6%.Using solvent-melting method can shape solid diapersion better which was explained by the detection of infrared spectrum.The strength of Cefixime and carrier's crystalloid absorption peak dropped drastically at 1 780 cm-1.The conclusion is that the dissolution can be improved when cefixime formed solid diapersion.
cefixime;solid diapersion;preparation;dissolution;infrared spectrum
张 瑞
TQ460.4
A
10.3969/j.issn.1674-2869.2011.11.007
1674-2869(2011)11-0027-04
2011-09-22
严少康(1987-),男,湖北荆门人,硕士研究生.研究方向:药物合成与制剂.
指导老师:刘永琼,女,教授,硕士研究生导师.研究方向:药物合成、药物制剂与天然药物.*通信联系人

