蓝莓多糖BBP3-1的分离及结构分析
孙希云,刘 宁,孟宪军*,李 斌,张 琦
1沈阳农业大学食品学院;2沈阳农业大学土地与环境学院,沈阳110161
蓝莓多糖BBP3-1的分离及结构分析
孙希云1,刘 宁2,孟宪军1*,李 斌1,张 琦1
1沈阳农业大学食品学院;2沈阳农业大学土地与环境学院,沈阳110161
采用酶法优化进行水提醇沉得到蓝莓粗多糖。经双氧水脱色、酶解和三氯乙酸正丁醇结合法脱蛋白后通过DEAE Sepharose Fast Flow离子交换层析和sephacryl s-300 HR凝胶过滤层析得到蓝莓多糖(BBP3-1)。经紫外扫描显示无蛋白、核酸杂质。经高效液相色谱分析,BBP3-1的重均分子量Mw为18643 Da,数均分子量Mn为9658 Da,峰位分子量Mp为3554 Da,分子量分布宽度(Mw/Mn)为3.186。气相色谱分析确定单糖组成为:鼠李糖、半乳糖和葡萄糖,其摩尔比为1∶1.5∶2。经红外色谱和核磁共振分析,可推测多糖BBP3-1是以1,6连接的吡喃葡萄糖链为主链,含有鼠李糖、半乳糖、葡萄糖和糖醛酸,不含甘露糖的β构型酸性多糖。
蓝莓;多糖;分离;结构
蓝莓(Blueberry),学名越桔,为杜鹃花科(Ericaceae)越桔属(Vaccinium spp.)多年生落叶或常绿果树,呈灌木。该属植物在全世界有450种,中国已知有91种,南北方均有野生资源分布,但主要分布在西南、华南及东北地区[1]。近年来,加拿大、日本和欧洲的很多国家都把蓝莓视为保健与功能食品,倍受人们青睐。在英国权威营养学家列出的全球l5种健康食品中蓝莓食品居首位,在联合国粮农组织列出的人类五大健康食品中蓝莓食品是其中之一。因此,20世纪后期,蓝莓(blueberry)正是以其独特的保健营养价值在国外市场上引起广泛的重视和应用,成为目前热门的开发产品之一。我国对于蓝莓的研究目前还主要集中在引种栽培和产品的初加工方面[1,2]。
近几十年来,人们发现从植物中提取的多糖具有非常重要与特殊的生理活性,具有抗肿瘤和免疫促进,抗炎、抗病毒、抗凝血、降血糖、降血脂、抗疲劳、抗衰老等作用。目前国内外对于浆果类果实中活性多糖构效关系方面的研究还相对还较少[3],特别是对于蓝莓果中多糖结构及功能性方面的研究还未见报道。本文对蓝莓中多糖的分离、结构进行了初步研究,为进一步研究其生理活性和产品开发奠定基础,同时也为浆果类资源的综合开发利用提供了新的思路和途径。
1 材料与方法
1.1 主要材料与试剂
蓝莓,购于辽宁蓝金实业有限公司,品种为北蓝;果胶酶(分析纯),木瓜蛋白酶(分析纯),为国药集团化学试剂有限公司;DEAE-52纤维素,购于Whatman公司;Sephacryl S-300,购于GE Healthcare公司;牛血清蛋白(生化试剂),购于北京奥博星生物试剂公司;考马斯亮蓝G-250(Fluka)购于上海化学试剂公司;蓝色葡聚糖,葡聚糖-90,葡聚糖-70,葡聚糖-40,葡聚糖-10,色谱级,购于瑞典PHarmacia公司;透析袋(分子截流量为14000 Dal,美国);化学试剂均为分析纯。
1.2 主要仪器与设备
UV-1100紫外可见分光光度计,上海分析仪器厂;高效液相色谱仪,RID-10A视差折射鉴定器,CLASS-Vp(软件)工作站,均为日本Shimadzu公司; Tensor 27傅立叶红外光谱仪,德国布鲁克公司; BrukerAV-600超导核磁共振仪,瑞士Bruker;Agilent 6890N GC,美国安捷伦科技有限公司。
1.3 样品制备方法
1.3.1 粗多糖提取工艺
称取干燥至恒重的一定条件下粉碎的蓝莓10 g,溶于一定体积的蒸馏水中,加入0.6%果胶酶,在一定温度的水浴中浸提并不断搅拌,取出后再以3000 r/min离心10 min,弃去下层不溶物,取上清液,加入无水乙醇至乙醇浓度为80%,冰箱中静置过夜,取出,以3000 r/min离心10 min,取沉淀,先后用丙酮、乙醚和乙醇冲洗抽滤,真空干燥得粗多糖。
1.3.2 多糖分离纯化的路线
粗多糖→双氧水脱色→酶解和三氯乙酸正丁醇结合法脱蛋白→透析→冷冻干燥→乙醇沉淀→离心分离→乙醚,丙酮洗涤→DEAE-52纤维素柱层析→0.3 mol/L氯化钠洗脱→Sephacryl S-300柱层析→纯度鉴定。
1.3.3 样品制备
脱色脱蛋白后的多糖通过DEAE-52纤维素柱层析,得到BBP1和BBP2、BBP3和BBP4、BBP5和BBP6六组分,BBP3含量最高,BBP3经Sephacryl S-300葡聚糖凝胶层析进一步分离纯化两个组分BBP3-1和BBP3-2,因BBP3-2含量很低,故先未做研究,BBP3-1经过Sephacryl S-300葡聚糖凝胶层析柱检测验证为均一多糖。
1.4 纯度鉴定
1.4.1 多糖的紫外光谱(UV)分析
将多糖配成1 mg/mL的水溶液在紫外分光光度计上400~200 nm扫描。
1.4.2 Sephacryl S-300葡聚糖凝胶过滤法
将少量纯品多糖溶于少量蒸馏水中,上Sephacryl S-300葡聚糖凝胶柱(Φ1.6×50 cm)。以蒸馏水洗脱,控制流速为1 mL/min,部分收集体积为4 mL/tub,以苯酚—硫酸法测OD490,做出其单一组分的鉴定洗脱曲线。
1.5 分子量的测定
高效液相色谱(HPLC)法测定多糖组分的分子量。
色谱条件:色谱柱:不锈钢色谱柱TSK-G3000 7.8 mm(ID)×30.0 cm(L);柱温:35℃;柱操作压力:1.6 Mpa;流动相:超纯净水;流速:0.5 mL/min;进样量:20 μL。
将相对分子质量分别为 133800、410000、21400、10000和2500的Dextran系列标准葡聚糖相继进样,记录各自的保留时间tR,在相同色谱条件,将浓度约为2.5 mg/mL多糖进样,记录色谱曲线。用Shimadzu CLASS-Vp色谱工作站系统进行数据处理,测得蓝莓多糖各组分的相对分子质量。
用HPLC测定T系列标准品各自的保留时间tR,以tR为横坐标,IgM(分子量对数值)为纵坐标绘制标准曲线(图1)。待测BBP3-1按上述相同条件进样,测得tR,查标准曲线得待测样品分子量。
图1 标准葡聚糖的保留时间—IgM曲线Fig.1 The tR-IgM curve of standard dextrans
1.6 单糖组成
样品处理:将20 mg糖样加入到1 mL的2 mol/ L三氟乙酸放入水解管中于120℃水解3 h;放入60~80℃水汽条件下,滴加乙醇以除去剩余三氟乙酸,用pH试纸检测中性后抽干;加0.12 mol/L碳酸钠1 mL,1 mg肌醇,30℃处理50 min,加50 mg硼氰化钾室温下处理1.5 h;滴加25%乙酸中和至不产生气泡(pH=6),加入阳性离子交换树脂除盐2 h,用蒸馏水5~6 mL冲洗过滤,滴加甲醇除酸至中性; 85℃条件下真空除去水分;加1 mL正丙胺与1 mL无水吡啶,55℃条件下处理30 min,抽干后加入0.5 mL无水吡啶与0.5 mL乙酸酐,90℃处理1 h,抽干后用1 mL无水二氯甲烷,离心后取上清液进行气相检测。
色谱条件:GC-16A,色谱柱(3.2 mm×3 m);柱温180℃,氢气流速45 mL/min,氮气40 mL/min,FID检测器,温度240℃,进样量0.8 μL。
根据BBP3-1水解样品的GC图与各单糖标准品的GC图对比,可判断单糖组成及摩尔比。
1.7 糖苷键及糖环构型确定
1.7.1 蓝莓多糖BBP3-1红外光谱分析
取经真空干燥的多糖各1~2 mg进行溴化钾压片,测定其红外光谱。
1.7.2 蓝莓多糖BBP3-1的核磁分析
将BBP3-1 20 mg分别溶于0.5 mL D2O中,在600兆超导核磁共振仪上分别测其1H NMR和13C NMR谱。
2 结果与分析
2.1 纯度鉴定
2.1.1 紫外扫描检测
将多糖配成1 mg/mL的水溶液在紫外分光光度计上400~200 nm扫描。由紫外光谱图2可见,BBP3-1在280和260 nm处无吸收,表明它不含蛋白、多肽及核酸。
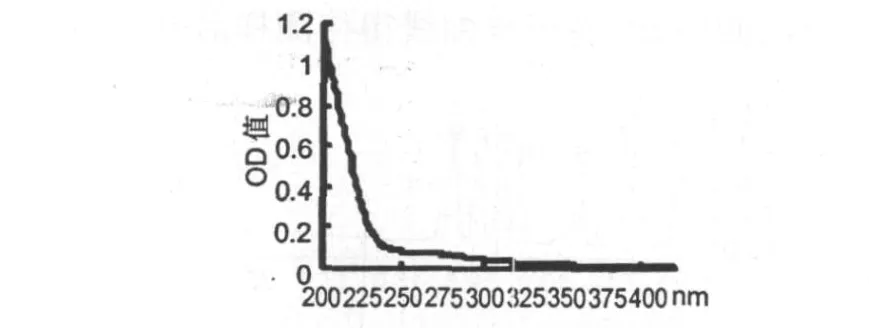
图2 蓝莓多糖BBP3-1的紫外吸收光谱图Fig.2 UV-scanning pattern of pure polysaccharide BBP3-1 from blueberry
2.1.2 Sephacryl S-300交联葡聚糖凝胶柱洗脱
根据凝胶的理论知识可知,样品中分子大的先流出凝胶柱,中等分子的后流出,分子最小的最后流出,这种现象叫分子筛效应。多糖是大分子,它的纯度标准不能用通常小分子的标准来衡量。因为即使是多糖纯品也存在微观不均一的问题,它的纯度只代表某一多糖相似链长的平均配布。通常所说的多糖纯品实质上是一定分子量范围内的均一组分。多糖分子的大小和形状不同,在层析柱中移动速度也不同,从分部收集中出现的峰的多少和形状可以判断多糖的纯度。
将少量纯品多糖溶于少量蒸馏水中,上Sephacryl S-300葡聚糖凝胶柱(Φ1.6×50 cm)。以蒸馏水洗脱,控制流速为1 mL/min,部分收集体积为4 mL/tub,以苯酚-硫酸法测OD490,做出其单一组分的鉴定洗脱曲线。

图3 BBP3-1凝胶层析曲线Fig.3 Elution pattern of BBP3-1 on SepHacryl S-300
从图3可以看出,蓝莓多糖BBP3-1经过凝胶柱纯化后,多糖的Sephacryl S-300交联葡聚糖凝胶柱的洗脱曲线均为单一洗脱峰,且峰形对称,结合紫外吸收光谱,证明他们均为单一组分。
2.2 分子量的测定
BBP3-1的分子质量分布见图4。
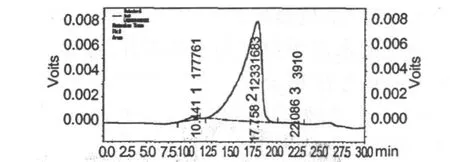
图4 蓝莓多糖BBP3-1的HPLC图谱Fig.4 The HPLC atlas of blueberry polysccharide BBP3-1
由图4分析得到:BBP3-1的重均分子量Mw为18643 Da,数均分子量Mn为9658 Da,峰位分子量Mp为 3554 Da,分子量分布宽度(Mw/Mn)为3.186。多糖BBP3-1最佳峰面积为98.271%,其他杂峰面积为0.312%和1.417%,含量非常少,也进一步说明多糖BBP3-1的为纯度较高的多糖。
2.3 单糖组成
气相色谱分析结果见图5,试验结果表明BBP3-1的单糖组成为 GalUA,Xyl和 Glu,其摩尔比为1∶1.5∶2。
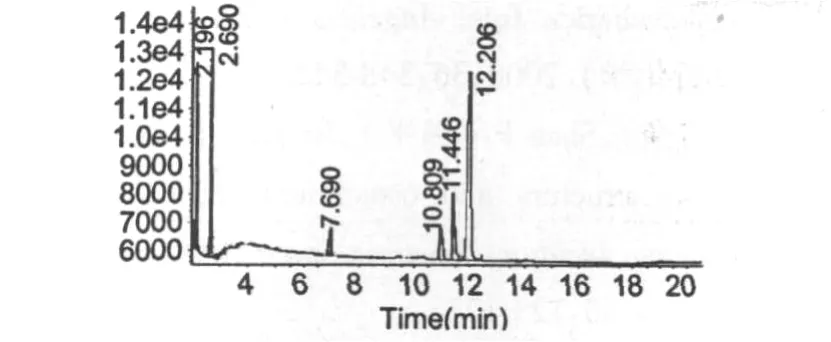
图5 蓝莓多糖BBP3-1水解液的气相色谱图谱Fig.5 GC chromatogram spectrum of blueberry polysaccharide BBP3-1 hydrolysate
2.4 糖苷键及糖环构型确定
2.4.1 蓝莓多糖BBP3-1红外光谱分析
蓝莓纯品多糖BBP3-1的红外光谱见图6,由图6可推知,图中3421.96 cm-1的吸收峰为O-H的伸缩振动,2928.26、2360.28 cm-1和2340.70 cm-1为CH的伸缩振动和变角振动,由以上三个特征峰至少可以判断出该物质为多糖。1558.65 cm-1的吸收峰为COOH中的-COO的伸缩振动,1398.26 cm-1的吸收峰为C=O对称伸缩振动,可以推测该物质为含有糖醛酸的酸性多糖。1102.43 cm-1的吸收峰为-OH的变角振动,958.59 cm-1的吸收峰为直立端基C-H变角振动,可推测该物质含有β-D-吡喃葡萄糖或半乳糖,在810 cm-1和870 cm-1处均无明显吸收峰,说明它们均不含甘露糖,这与气相色谱的分析结果相一致。624.64 cm-1的吸收峰为O-H外向弯曲振动。
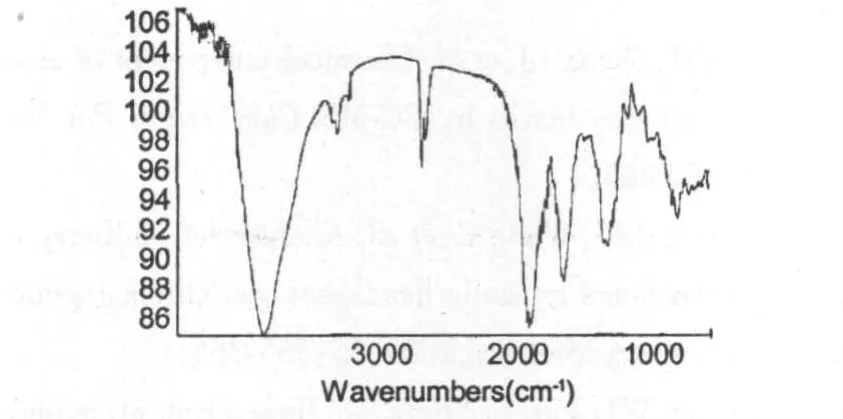
图6 蓝莓多糖BBP3-1的红外吸收光谱图Fig.6 IR spectrum of blueberry polysaccharide BBP3-1
2.4.2 蓝莓多糖BBP3-1的核磁分析
2.4.2.1 BBP3-1的1H NMR分析
BBP3-1的1H NMR的化学位移大部分处于δ5.0 ppm以下,说明β构型居多。1H NMR化学位移出现在δ2.01,表明有O-乙酰基存在。δ3.40 ppm处是6-O-甲基-β-D-半乳糖的6位甲基的信号。
2.4.2.2 BBP3-1的13C NMR分析
从图7中可以看出,多糖BBP3-113C NMR的化学位移高场区中δ19.0为鼠李糖C-6位甲基的信号。13C NMR谱中,δ62.91为C-6位的吸收峰,在δ60.01处是葡萄糖的6位发生取代的共振峰,说明此组分含6位取代的残基,即该多糖糖链是以1,6连接的吡喃葡萄糖链,这与红外分析结构相一致。

图7 蓝莓多糖BBP3-1的核磁共振图谱Fig.7 NMR spectrum of blueberry polysaccharide BBP3-1
3 结论
蓝莓多糖BBP3-1重均分子量Mw为18643 Da,数均分子量Mn为9658 Da,峰位分子量Mp为3554 Da,分子量分布宽度(Mw/Mn)为3.186。蓝莓多糖BBP3-1的气相色谱分析确定单糖组成为:鼠李糖、半乳糖和葡萄糖,其摩尔比为:1∶1.5∶2。红外光谱显示多糖BBP3-1具有多糖的特征吸收峰,可推测多糖BBP3-1是含有β-D-吡喃葡萄糖或半乳糖,不含甘露糖,含有糖醛酸的酸性多糖。核磁共振分析,可推测多糖BBP3-1是以1,6连接的吡喃葡萄糖链为主链,含有鼠李糖、半乳糖和葡萄糖的β构型多糖。
1Wang H(王辉),Wang PY(王鹏云),Wang S(王蜀),et al.Development status and prospect of blueberry in China.Res Agric Mod(农业现代化研究),2008,29:250-253.
2Li LM(李丽敏),Hao QS(郝庆生),Li YD(李亚东).Consideration on the blueberry industry development in China.J Anhui Agr Sci(安徽农业科学),2008,36:8546-8548.
3 Yang L(杨磊),Sun GJ(孙桂菊).Research progress of berry and berry juice.Food Res Dev(食品研究与开发),2008,29:183-188.
4 Yang FS(阳佛送),Li XH(李雪华).Advances and methods in study on structure analysis of polysaccharides.Food Sci Technol(食品科技).2008,33:200-203.
5 Li J(李俊),Huang Y(黄艳),He XC(何星存),et al.Study on the structure of polysaccharide from the fruits of Siraitia grosvenorii.Sci Technol Food Ind(食品工业科技).2008,29:169-172.
6 Zhang FH(张凡华),Shi BX(石宝霞),Zhang SM(张树明),et al.Study on extraction,purification and structure of low molecular weight polysaccharides from pumpkin.Sci Technol Food Ind(食品工业科技).2008,29(3):93-95.
7 Song XW(宋学伟),Ren L(任磊),Han YP(韩泳平),et al.Purification and composition analysis of polysaccharide RCPS from Rhodiola crenulata.Spectrsc Spectr Anal(光谱学与光谱分析),2008,28:642-644.
8 Han CR(韩春然),Tang J(唐娟),Ma YQ(马永强).Study on isolation,purification and characteristics of polysaccharides from Auricularia auricula.Food Sci(食品科学),2007,28(2):53-55.
9 Wu CL(武翠玲),Deng YK(邓永康),Meng YF(孟延发).Isolation,purification and structural investigation of polysaccharide from Calvatia geigantea.Nat Prod Res Dev(天然产物研究与开发),2008,20:1027-1030.
10 Kang XJ(康学军),Qu JS(曲见松),Gu ZZ(顾忠泽).A-nalysis of Angelica dahurica polysaccharide.Chin J Anal Chem(分析化学).2006,34:533-535.
11 Sun YL(孙元琳),Shen RL(申瑞玲),Tang J(汤坚),et al.Hydrolytic characteristics and analysis of hydrolysis product of polysaccharide from Angelica sinensis.Chin J Anal Chem(分析化学).2008,36:348-352.
12 He JZ(何晋浙),Shao P(邵平),Ni HD(倪慧东),et al.Study on the structure and constituents of polysaccharide from Ganoderma lucidum.Spectrosc Spectr Anal(光谱学与光谱分析),2010,30:123-127.
13 Huang F(黄芳),Meng YW(蒙义文).Studies on polysaccharides wth biological activity.Nat Prod Res Dev(天然产物研究与开发),1999,11(5):90-98.
14 Anderson JW.Dietary fiber and human health.Hortscience,1990,25:1488-1495.
15 Kay CD,Holub BJ.The effect of wild blueberry(Vaccinium angustifolium)consumption on postprandial serum antioxidant status in human subjects.Br J Nutr,2002,88:389-397.
16 Hilz H,Bakx EJ,et al.Cell wall polysaccharides in black currants and bilberries-characterisation in berries,juice,and press cake.Carbohy Polym,2005,59:477-488.
17 Yamada H.Pectic polysaccharides from Chinese herbs:Structure and biological activity.Carbohy Polym,1994,25:269-276.
18 Zhu Y,Pettolino F,Mau SL,et al.Characterization of cell wall polysaccharides from the medicinal plant Panax notoginseng.Phytochemistry,2005,66:1067-1076.
Separation and Structural Analysis of Polysaccharides BBP3-1 from Blueberry
SUN Xi-yun1,LIU Ning2,MENG Xian-jun1*,LI Bin1,ZHANG Qi11Shenyang Agriculture University,College of Food;2Shenyang Agriculture University,College of Land and Environmental Science,Shenyang 110161,China
In this study the raw polysaccharide was obtained from Blueberry by hot water extraction and ethanol precipitation method coupled with pectinase optimum.Then it was discolored by H2O2,enzymatic hydrolyzed and then removed of protein by combining trichloroacetic acid and n-butanol.Polysaccharide(BBP3-1)was purified using DEAE Sepharose Fast Flow ion exchange echromatography and Sephacryl S-300 HR gel filtration chromatography(GFC).UV spectra measurements confirmed there was no protein and nucleic acid.HPLC analysis showed that the average molecular weight (Mw)was 18643Da,the numerical average weight(Mn)was 5851 Da,the peak molecular weight(Mp)was 3554 Da,the width of molecular weight(Mw/Mn)was 3.186.GC analysis showed that the polysccharide BBP3-1 was composed of GalUA,Xyl and Glu with a molar proportion of 1∶1.5∶2.The IR and NMR spectrum analysis indicated the chain of the polysccharide BBP3-1 was dominant by 1,6-glucopyranose chain.It was an acidic β polysaccharide containing GalUA,Xyl,Glu and Rha but without Man.
blueberry;polysaccharide;isolation;structure
1001-6880(2011)06-1080-05
2010-03-30 接受日期:2010-09-10
辽宁省主要浆果深加工项目(辽宁省科技厅项目) (1102-01082609001);特色小浆果精加工关键技术研究(辽宁省科技厅科技攻关项目)(2011205001)
*通讯作者 Tel:86-24-88488277;E-mail:mengxjsy@126.com
R28412;Q946191
A

