香水莲花提取物抑制酪氨酸酶活性的研究
任红荣,单承莺,姜洪芳,张卫明*
1南京师范大学生命科学学院,南京210097;2南京野生植物综合利用研究院,南京210042
香水莲花提取物抑制酪氨酸酶活性的研究
任红荣1,2,单承莺2,姜洪芳1,2,张卫明1,2*
1南京师范大学生命科学学院,南京210097;2南京野生植物综合利用研究院,南京210042
本实验以L-酪氨酸为底物,从马铃薯中提取酪氨酸酶,以熊果苷为阳性对照,采用比色法测定了香水莲花醇提物、水提物及总黄酮提取物对酪氨酸酶的抑制率,以探讨香水莲花醇提物、水提物及总黄酮提取物对酪氨酸酶的活性的抑制作用。结果表明,三种提取物对酪氨酸酶活性的抑制效果从高到低依次为总黄酮提取物、醇提物、水提物,说明其有效成分为醇溶性物质;总黄酮提取物对酪氨酸酶活性的抑制效果明显高于醇提物和水提物对酪氨酸酶活性的抑制效果,可以考虑将其作为一种新型的植物源美白剂,应用于化妆品行业。
香水莲花;醇提物;水提物;总黄酮;酪氨酸酶;抑制作用
酪氨酸酶(Tyrosinase,TYR)(EC.1.14.8.1)又称多酚氧化酶,广泛存在于植物、动物和微生物体内。它是一种含铜的氧化还原酶,参与黑色素合成的前两步反应,是黑色素合成的限速酶[1],不仅决定黑素合成的速率,还是黑素细胞分化成熟的特征性标志[2].酪氨酸酶的活性与黑素合成量相关,控制其活力即可控制黑素生成量[3]。
在人体中,酪氨酸酶则主要存在于皮肤表皮细胞的黑色素细胞中,与一些常见皮肤疾病如雀斑、黄褐斑、老年斑等色素障碍性疾病及恶性黑色素瘤的发生具有重要关系[4]。因此,酪氨酸酶抑制剂也被作为具有美白作用的添加剂添加到化妆品中,如熊果苷和曲酸可被作为化妆品中的美白剂,改善皮肤中色素细胞的酪氨酸酶的代谢,阻止色素沉着[5]。天然产物化妆品,特别是添加了中草药有效活性成分的化妆品的开发越来越受到国内外厂商的重视,也深受消费者的青睐,具有很大的市场潜力[6]。
香水莲花(Nymphaea Hybrid)是睡莲科Nymphaea水生宿根草本植物,属于大型睡莲类,既是重要的园林观赏花卉,又是生产切花的新兴品种[7],以香水莲花焙制的茶风味独特。已有的研究表明含有挥发油、多糖、黄酮、鞣质等多种活性物质,香水莲花的降血脂作用已经在动物实验中得到证实[8],并具有一定的体外抗氧化活性。
近年来,从植物中分离天然酪氨酸酶抑制剂已得到人们的普遍关注[9-13]。因此,本实验以L-酪氨酸为底物,从马铃薯中提取酪氨酸酶,以熊果苷为阳性对照,研究了香水莲花提取物对酪氨酸酶活性的影响,以寻求新型高效的天然美白剂和进一步提高香水莲花的利用价值。
1 材料与方法
1.1 材料
香水莲花带雄蕊的干燥花托:浙江省温州市三心美德投资有限公司提供。七月采摘,剥去萼片和花瓣,贴近花托基部切去花梗,鼓风干燥。
新鲜马铃薯,购自南京市华润苏果超市。
1.2 试剂
L-酪氨酸(L-Tyrosine,Sigma公司);熊果苷(北京贝利莱斯生物化学有限公司);95%乙醇,二甲基亚砜(DMSO),磷酸,磷酸氢二钠,磷酸二氢钠,浓盐酸,均为市售分析纯;实验用水为去离子水。
1.3 仪器
组织捣碎机(型号JJ-2,江苏省金坛市荣华仪器制造有限公司);紫外可见分光光度计(型号T6新世界,北京普析通用仪器有限公司);离心机(型号80-1,上海手术器械厂);数显恒温水浴锅(型号HH-4,金坛市江南仪器厂)。
1.4 方法
1.4.1 试剂配制
1.4.1.1 磷酸钠缓冲液(1/15M,pH=6.8)
精确称取1.0001 g磷酸二氢钠,1.1860 g磷酸氢二钠,加入少量去离子水溶解后,定容至500 mL,4℃冰箱保存备用。
1.4.1.2 L-酪氨酸溶液(7.5 mmol/L)
精确称取L-酪氨酸0.2721 g,先加入数滴浓盐酸,加去离子水约50 mL,微热完全溶解后,用氢氧化钠溶液调pH至7.0,加去离子水定容至200 mL。
1.4.1.3 受试液
精确称取香水莲花醇提物、水提物及黄酮各项各0.1001 g,分别溶于20 mL二甲基亚砜,得到5 mg/mL的待测液,再对倍稀释到2.5、1.25、0.625、0.3125 mg/mL和0.15625 mg/mL。
1.4.1.4 阳性对照(+CK)
精确称取0.1002 g熊果苷粉末,溶于20 mL的去离子水中,得到5.01 mg/mL的阳性对照母液,再对倍稀释到2.5、1.2500、0.6250、0.3125 mg/mL和0.1562 mg/mL。
1.4.2 材料的制备
1.4.2.1 香水莲花醇提物的制备:分别称取雄蕊、花托和带雄蕊花托各10 g,用80%的乙醇热回流提取2次,每次3 h。提取液抽滤后合并,减压浓缩后真空干燥,得各项醇提物。
1.4.2.2 香水莲花水提物的制备:分别称取雄蕊、花托和带雄蕊花托各10 g,用蒸馏水于90℃提取2次,每次3 h。提取液抽滤后合并,减压浓缩后真空干燥,得各项水提物。
1.4.2.3 香水莲花雄蕊总黄酮的制备:称取雄蕊10 g,石油醚脱脂两次,每次2 h,过滤。滤渣烘干后用75%的乙醇热回流提取两次,每次3 h。提取液抽滤后合并,减压浓缩后部分进行真空干燥,得总黄酮提取物;另一部分浓缩到料液比为1∶2,用HPD-400大孔树脂分离,洗脱剂分别为30%和60%乙醇。洗脱液减压浓缩后真空干燥,得30%流份和60%流份。
1.4.3 酪氨酸酶液的制备
以新鲜完好的马铃薯制取酪氨酸酶液,具体操作为:
将马铃薯洗净,于4℃预冷4 h左右。去皮,切成约1×1×1 cm3丁状,于-20℃冷冻过夜。称重,按1∶1(w∶v)的比例加入4℃预冷的磷酸钠缓冲液,用组织捣碎机制成匀浆,3层纱布过滤,滤液于4000 r/min离心10 min,上清即为所得的酪氨酸酶粗酶液,4℃保存,2 h内用完。
1.4.4 黄酮含量的测定
1.4.4.1 标准品溶液的配置
精密称取105℃常压干燥至恒重的芦丁10.3 mg,以75%乙醇为溶剂,定容至50 mL容量瓶中,配置成0.206 mg/mL的芦丁标准品溶液。
1.4.4.2 样品溶液的配置
精密称取由1.4.2.3方法得到的30%流份、60%流份干燥物0.0201 g,以75%的乙醇为溶剂,定容到50 mL的容量瓶中,配置成0.4 mg/mL的样品溶液。
1.4.4.3 测定波长的确定
采用三氯化铝显色法确定香水莲花总黄酮测定的波长。分别吸取标准品溶液和样品溶液0.1 mL,以75%的乙醇为溶剂,定容至10 mL的容量瓶中,分别吸取2 mL,加2 mL 1%三氯化铝显色10 min后在200~600 nm波长范围内扫描,均以1%三氯化铝为空白对照。
1.4.4.4 标准曲线绘制的方法
精密称取105℃常压干燥至恒重的芦丁20 mg,用75%的乙醇定容至100 mL作为母液。精密量取芦丁标准品溶液0.0、0.2、0.4、0.6、0.8和1.0 mL,分别置于25 mL容量瓶中,用75%的乙醇定容。分别吸取2 mL芦丁标准液加2 mL1%三氯化铝显色10 min后,以样品溶液作为空白对照,在波长425 nm处测定吸光度值。以芦丁量为横坐标,吸光值为纵坐标绘制标准曲线。
1.4.5 样品对酪氨酸酶活性的抑制
总反应体系为5mL。具体设计见“表1”。其中,用分光光度计测量吸光值时,“受试液”、“标准对照”、“阳性对照”分别以“阴性对照1”、“阴性对照2”和“阴性对照3”调零。

表1 5 mL试验体系设计Table 1 The design of the 5 mL test system
在此体系中,受试液(包括阳性对照熊果苷)的终浓度(mg/mL)梯度为0.03125、0.0625、0.125、0.25和0.5。
实验时,向试管中依次加入磷酸盐缓冲液、不同浓度梯度的受试液(包括阳性对照)和酶液,于30℃水浴10 min。然后加入底物L-酪氨酸,立即开始计时。测定反应20 min时475 nm波长下的吸光值。测定时以相应的阴性对照为参比,用下列公式计算受试液(包括阳性对照)对酪氨酸酶的抑制率,并依据浓度-酶抑制率曲线估算半数抑制浓度( IC50)的近似值。
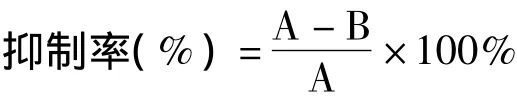
其中,“A”为标准对照的吸光值,“B”为受试液(或阳性对照)的吸光值.
每个实验做3个平行。抑制率高表明其对酪氨酸酶活性的抑制强度高。
2 结果与分析
2.1 黄酮含量的测定
2.1.1 测定波长的确定
经紫外光谱分析,芦丁标准溶液在425 nm处有最大吸收,样品在425 nm处接近最大吸收。因此选择425 nm作为黄酮含量的测定波长。
2.1.2 芦丁标准曲线
根据“1.4.4.4”中的方法绘制的芦丁标准曲线,求得到回归方程:y=0.0251x+0.0092;R2= 0.9992,表明芦丁在本是实验涉及的浓度范围4~40 μg/mL范围内呈良好线性关系。

表2 香水莲花各提取物的黄酮含量Table 2 The contents of flavonoids in Nymphaea Hybrid
2.1.3 黄酮含量测定结果
2.2 香水莲花提取物对酪氨酸酶的抑制作用结果
2.2.1 香水莲花总醇提物、花托醇提物、雄蕊醇提物及熊果苷对酪氨酸酶的抑制作用如图1所示:
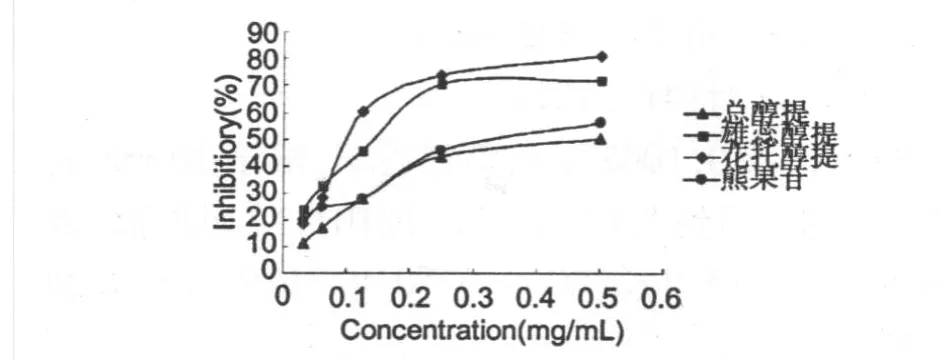
图1 香水莲花各醇提物对酪氨酸酶的抑制作用Fig.1 Inhibitory of ethanol extract from the flower of N.hybrid and arbutin on the activity of tyrosinase
2.2.2 香水莲花总水提物、花托水提物、雄蕊水提物及熊果苷对酪氨酸酶的抑制作用如图2所示:
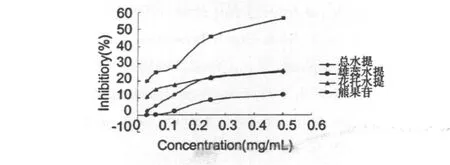
图2 香水莲花各水提物对酪氨酸酶的抑制作用Fig.2 Ihibitory of the aqueous extract from the flower of N.hybrid and arbutin on the activity of tyrosinase
2.2.3 香水莲花雄蕊总黄酮、30%流份、60%流份及熊果苷对酪氨酸酶的抑制作用如图3所示:

图3 香水莲花各黄酮提取物对酪氨酸酶的抑制作用Fig.3 Ihibitory of the flavone extract from the flower of N.hybrid and arbutin on the activity of tyrosinase
由图1可以看出,在实验浓度范围内,随着样品浓度的升高,各项样品对酪氨酸酶的抑制率呈上升趋势,均表现为剂量依赖性抑制。其中香水莲花花托和雄蕊醇提物对酪氨酸酶的抑制作用明显强于同浓度的阳性对照熊果苷对酪氨酸酶的抑制作用,而总醇提物对酪氨酸酶的抑制作用稍弱,大致与熊果苷对酪氨酸酶的抑制作用相当。由图1可比较出各项醇提物及熊果苷的IC50值(半数抑制浓度)大小,依次为IC50值(香水莲花花托醇提物)<IC50值(香水莲花熊蕊醇提物)<IC50值(熊果苷)<IC50值(香水莲花总醇提物)。
由图2可以看出,在实验浓度范围内,香水莲花不同部位水提物的抑制率均未达到50%,且均低于熊果苷的抑制率,是由于香水莲花的水提物中能够抑制酪氨酸酶的有效物质很少,只出现了较弱的酪氨酸酶抑制活性。
由图3可以看出,在实验浓度范围内,各项黄酮物质对酪氨酸酶的抑制率均很高,且均高于熊果苷的抑制率。总黄酮的抑制率一直处于平缓增加的趋势,30%流份的抑制率有明显的升高,60%流份当浓度大于0.625 mg/mL,处于缓慢增加的趋势。
由表2可看出,同种提取溶剂中,雄蕊提取物的黄酮含量均比花托提取物高,并有资料显示,黄酮类物质对酪氨酸酶的活性有比较强的抑制作用,提示了黄酮类物质可通过抑制酪氨酸酶活性而达到美白之功效[14]。但是各项提取物中,花托提取物对酪氨酸酶的抑制率均比雄蕊提取物对酪氨酸酶的抑制率高。这是由于花托的总酚和鞣质的含量比雄蕊的总酚和鞣质的含量高:花托总酚含量为8.613%,雄蕊总酚含量为7.696%;花托鞣质含量为5.703%,雄蕊鞣质含量为3.163%,据文献报道,多酚[15]及鞣质[16]均有抑制酪氨酸酶活性。因此香水莲花抑制酪氨酸酶活性的物质基础应为总黄酮、多酚及鞣质类。
熊果苷(β-Arbutin,化学名为4-羟苯基-β-D-吡喃葡萄糖苷)是Akiu等于1988年从杜鹃花科植物熊果(Arctostap hylosuva-ursi(L.)Spreng.)果实中分离到的。它是酪氨酸酶的竞争性抑制剂,可有效地抑制皮肤中的酪氨酸酶活性,阻断黑色素的生成,减少皮肤色素沉积,祛除色斑和雀斑,而且对黑色素细胞不产生毒害性,刺激性、致敏性等副作用,使用安全性很高[17]。因此本试验选择熊果苷作为阳性对照,无疑能够对香水莲花醇提物的酪氨酸酶活性抑制作用作出更具说服力的客观评价。
酪氨酸酶同时具有单酚酶活性(以酪氨酸为底物)和二酚酶活性(以多巴为底物)[18]。酪氨酸酶的活性与黑色素的生成有密切的关系。在机体内它能将L-酪氨酸(L-Tyrosine,L-Tyr)羟化,产生邻位二羟基苯丙氨酸(L-多巴,L-DOPA),再将多巴氧化成多巴醌,进而生成一系列能引起褐化的色素类物质[19]。酪氨酸酶抑制剂可用来预防和治疗色素沉着和黑色素瘤等疾病。目前,氢醌、果酸、维生素C、曲酸和熊果苷等酪氨酸酶抑制剂已作为美白剂应用于化妆品中,但氢醌、果酸由于刺激性大已逐渐被淘汰;维生素C、曲酸易氧化,保质期短。因此,寻求新型的生物美白剂已成为当今美白化妆品的发展方向。
本实验结果表明,香水莲花提取物不仅对酪氨酸酶活性具有抑制作用,并且对酪氨酸酶活性的抑制效率呈剂量依赖性关系,随着香水莲花提取物浓度的增加其对酪氨酸酶活性的抑制效率也逐步增加。
3 结论
本实验证明香水莲花总黄酮对黑色素形成具有明显的抑制效率。因此,香水莲花黄酮提取物作为一种新型的植物源美白剂,配入各种霜膏中,可制成保护皮肤、抗衰老和祛斑的功能性化妆品,在药用和化妆品行业具有良好的开发应用前景。
1 Sánchez-Ferrer A,Rodríguez-López JN,García-Cánovas F,et al.Tyrosinase:a comprehensive review of its mechanism.BBA-protein Mol Enzym,1995,1247:1-11.
2 Smith B,Selby P,Southgate J,et al.Detection of melanoma cells in peripheral blood by means of reverse transcriptase and polymerase chain reaction.Lancet,1991,338:1227-1229.
3 Iwata M,Corn T,Iwata S,et al.The relationship between tyrosinase activity and skin color in human foreskins.J Invest Dermatol,1990,95:9-15.
4 Pan XH(潘兴华),Chen ZL(陈志龙),Huang LN(黄丽娜).Formation and regulation of melanocytes and melanin.Prog Physiol Sci(生理科学进展),1998,29:179-181.
5Wang HQ(王寒清),Wang CT(王昌涛),Dong YM(董银卯).Evaluation method for whitening cosmetics.Chin Surf Det Cosmc(日用化学工业),2007,30:32-34.
6 Chen PD(陈培栋).Appearance of“nine kinds of Nymphaea Hybrid”.China Flower Hortic(中国花卉园艺),2003(24): 38.
7 Zhong QQ(钟秋琴),Cao GQ(曹光群),Lu PL(陆蓓蕾),et al.Inhibitory effect of active constituents from Radix Puerariae on Tyrosinase.Nat Prod Res Dev(天然产物研究与开发),2008,20:681-684.
8 Zhang WM(张卫明),Jiang HF(姜洪芳),Xu H(徐辉),et al.Experimental study on reducing blood lipid of Nymphaea Hybrid.Sci Technol Food Ind(食品工业科技),2009,30: 111-112.
9 Kubo I,Kinst-Hor I,Yokakawa Y.Tyrosinase inhibitors from anacadium occidental fruits.J Nat Prod,1994,57:545-551.
10 Kubo I,Yokakawa Y,Kinst-Hor I.Tyrosinase inhibitors from Bolivian medicinal plants.J Nat Prod,1995,58:739-743.
11 Kubo I,Kinst-Hori I.2-Hydroxy-4-melhoxybenzaldehyde:a potent tyrosinase inhibitor from African medicinal plants.Planta Med,1999,65:19-22.
12 Gong X,Li QY.Inhibitory effect of EGb on tyrosinaes.Food Sci(食品科学),2001,22(12):25-27.
13 Lee HS.Tyrosinase inhibitors of Pullsatilla cernum root-derived materials.J Agric Food Chem,2002,50:1400-1403.
14 Wei ZC(魏振承),Sun L(孙玲).Inhibitory action of soybean isoflavone on tyrosinase activities.Sci Technol Food Ind Guangzhou(广州食品工业科技),2004,(3):10-11.
15 Tian LL(田丽丽),Liu ZH(刘仲华),Li X(李勤),et al.The research progress of polyphenols in cosmetics.Guangdong Tea(广东茶业),2007,(2):15-17.
16 Zhang M(张目),Yan ZM(严泽民),Zhu SJ(朱少娟),et al.The research of whitening effect of several Chinese medicines.Flavour Fragr Cosm(香料香精化妆品),2009,(1): 33-36.
17 Duan XH(段晓红),Mao Q(毛歆),Peng ZR(彭珍荣).Studies on production of melanin synthesized by immobilized cells.J Wuhan Univ,Nat Sci(武汉大学学报,自然科学版),1997,43:249-253.
18 Liu XD(刘晓丹),Huang H(黄璜),Chen QX(陈清西).Studies on inhibitory effects of benzoic acid on mushroom tyrosinase.J Xiamen Univ,Nat Sci(厦门大学学报,自然科学版),2003,42:102-106.
19 Xu D(徐迪),Ma L(马林),Gu LQ(古练权),et al.The oxidation of hydroxypyridine compounds catalyzed by mushroom tyrosinase.J Zhongshan Univ,Nat Sci(中山大学学报,自然科学版),2002,41:33-35.
Inhibition of the Extract from Nymphaea Hybrid on the Activity of Tyrosinase
REN Hong-rong1,2,SHAN Cheng-ying2,JIANG Hong-fang1,2,ZHANG Wei-ming1,2*1School of Life Science,Nanjing Normal University,Nanjing,210097,China;2Nanjing Institute for the Comprehensive Utilization of Wild Plant,Nanjing,210042,China
This study aimed to investigate the Nymphaea Hybrid inhibition performances of an alcohol extract,a total flavone extract and an aqueous extract.The inhibition rates of these three kinds of extracts on tyrosinase were tested by the colorimetry method using the L-tyrosine as the substrate and arbutin as a positive control.The results showed that the N.hybrid inhibition function of these extracts followed the order:the total flavone extract>alcohol extract>the queous extract.This suggested that the active component of inhibition function was alcohol-soluble.Therefore,N.hybrid could be considered as a new kind of botanical whitening agent and thus be applied to cosmetic industry.
Nymphaea Hybrid;alcohol extract;aqueous extract;total flavone;tyrosinase;inhibition
1001-6880(2011)06-1122-05
2010-03-04 接受日期:2010-08-31
国家“十一五”支撑计划课题(2006BADO6B05)
*通讯作者 Tel:86-25-85413696;E-mail:botanyzh@163.com
R284.2
A

