高速逆流色谱分离制备甘草中的甘草苷和芒柄花苷
袁延强,王祖林,刘秀河,韩利文,刘可春*
1山东省科学院生物研究所,济南250014;2山东轻工业学院食品与生物工程学院,济南250353
高速逆流色谱分离制备甘草中的甘草苷和芒柄花苷
袁延强1,王祖林2,刘秀河2,韩利文1,刘可春1*
1山东省科学院生物研究所,济南250014;2山东轻工业学院食品与生物工程学院,济南250353
应用高速逆流色谱分离制备甘草中的甘草苷和芒柄花苷。将甘草乙酸乙酯提取物经聚酰胺柱粗分后,30%乙醇洗脱物用高速逆流色谱进一步分离,所用两相溶剂系统为乙酸乙酯-水(5∶5,v/v),转速850 rpm,流速2.0 mL/min,检测波长254 nm,从50 mg30%乙醇洗脱物中得到甘草苷8.7 mg、芒柄花苷4.2 mg,纯度分别为99.5%和97.3%。所得产物的结构经核磁共振谱(NMR)鉴定。利用该方法可以对甘草中的甘草苷和芒柄花苷进行快速的分离和纯化。
高速逆流色谱;甘草;甘草苷;芒柄花苷
甘草为豆科植物甘草 Glycyrrhiza uralensis Fisch.、胀果甘草G.inflata Bat.或光果甘草G.glabra L.的干燥根及根茎,有补脾益气,清热解毒,祛痰止咳、缓急止痛,调和诸药等功效[1]。甘草中的黄酮类化合物具有较强的生物活性,近年发现该类化合物有抗氧化、抗炎、抗HlV、抗肿瘤等多种药理作用[2-5]。甘草苷和芒柄花苷是甘草的主要活性成分,其中甘草苷具有抗炎、抗皮肤肿瘤、祛除皮肤色斑和抗抑郁的作用[6,7],芒柄花苷具有神经保护和抗氧化的作用[8]。因此,为了对甘草活性成分进行更深层次的药理药效研究,建立一种快速有效的分离制备方法具有重要意义。
高速逆流色谱(HSCCC)是近年来发展起来的一种液-液分配色谱新技术,其特点是被分离物质在两相液体中进行分配,不需要任何固相载体,克服了固相载体对样品吸附、损失、污染等缺点,具有适应面广、高效、快速、制备量大、费用低等特点,因而在天然产物的分离纯化领域得到了广泛的应用。目前,利用高速逆流色谱已从甘草中成功分离到多种黄酮类化合物,如甘草黄酮醇(licoflavonol)、甘草素(liquiritigenin)、芒柄花素(formononetin)、甘草异黄酮甲(licoisoflavone A)、异甘草素(isoliquiritigenin)、甘草查儿酮甲(licochalcone A)等[9-11]。
本实验先用聚酰胺树脂对甘草乙酸乙酯提取物进行处理,然后采用HSCCC法对其进一步分离,得到了纯度均大于97%的甘草苷和芒柄花苷,为从甘草中制备甘草苷和芒柄花苷提供了一种新方法。
1 材料
甘草粗提物制备及HSCCC分离用溶剂(石油醚、乙酸乙酯、正己烷、甲醇、乙醇等)均为分析纯(天津广成化学试剂公司);HPLC分析用甲醇为色谱纯(天津科密欧化学试剂公司);水为超纯水;聚酰胺树脂(80~100目,浙江省台州市路桥四甲生化塑料厂)。
甘草购于济南建联中药店,产地内蒙古,由宋广运研究员鉴定。
TBE-300A高速逆流色谱仪(上海同田生化技术有限公司);HITACHI L-2000高效液相色谱仪(日本日立公司);HX-1050恒温器(北京博医康实验仪器有限公司);色谱柱:Apollo C18(5 μm,250 mm× 4.6 mm i.d.)(美国Alltech公司);INOVA-600型核磁共振仪(美国Varian公司)。
2 方法
2.1 样品的预处理
2.1.1 甘草乙酸乙酯浸膏的制备
称取1 kg甘草,干燥,粉碎至80目粒径,以6倍质量的70%乙醇水溶液加热回流提取3次,减压回收乙醇后,将浸膏溶于3 L热水中,先用等体积的石油醚萃取5次,再用等体积的乙酸乙酯萃取5次,将乙酸乙酯萃取物减压蒸馏,得30 g乙酸乙酯浸膏。
2.1.2 聚酰胺层析柱分离
将上述乙酸乙酯浸膏用少量乙醇溶解,加入2倍重量的聚酰胺树脂,搅拌均匀后加入已处理好的聚酰胺(300 g)柱(5 cm×100 cm)上,依次用蒸馏水、30%乙醇、50%乙醇、70%乙醇、95%乙醇梯度洗脱,每个梯度分别用5倍柱体积溶液冲洗,流速0.3 BV/h。将30%乙醇洗脱物浓缩干燥后得4.26 g样品,置于冰箱中备用。
2.2 HPLC分析条件
色谱柱:Apollo C18(5 μm,250 mm×4.6 mm i.d.);检测波长:254 nm;流动相:甲醇-0.5%乙酸,以0~50 min甲醇从20%到100%进行梯度洗脱;流速:1 mL/min;柱温:35℃;进样量:20 μL。
2.3 两相溶剂系统及样品溶液的制备
HSCCC溶剂系统乙酸乙酯-水(5∶5,v/v),按比例将两种溶剂加入分液漏斗中,振荡使溶液充分混合,静置平衡后分得上相和下相,分别超声脱气15 min以备用。称取约50 mg甘草预处理样品,加入溶剂系统的上、下相各10 mL,振荡使之溶解,以备HSCCC进样。
2.4 HSCCC分离过程
以10 mL/min将乙酸乙酯-水(5∶5,v/v)的上相(固定相)泵入HSCCC螺旋管,待螺旋管完全充满固定相后,开启HSCCC主机,旋转方向为顺时针,使转速逐渐增加到850 rpm,同时以2.0 mL/min的流速泵入下相(流动相)。当流动相从螺旋管尾端流出时,系统即达到动力学平衡,此时将“2.3”制备的样品溶液注入样品环。紫外检测器检测波长为254 nm,根据色谱图收集各流分。
3 结果与分析
3.1 甘草预处理样品的HPLC分析
采用“2.2”节的色谱条件,对甘草预处理样品进行分离,色谱图见图1。结果表明,在该条件下,样品可以得到很好的分离效果,A和B为254 nm检测到的主要色谱峰。
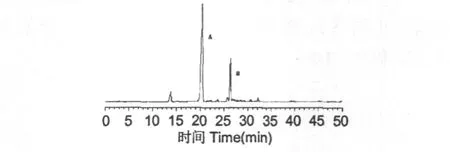
图1 甘草预处理样品的HPLC图Fig.1 HPLC chromatogram of pretreatment samples of Glycyrrhiza uralensis
3.2 高速逆流色谱分离条件的优化
溶剂系统的选择是高速逆流色谱分离的关键环节,不同的溶剂系统会对不同的成分产生不同的溶解分配能力,从而造成分配系数的差异,对分离效果产生显著的影响。通常对HSCCC最合适的分配系数K值范围是0.5~5。如果分配系数K过小,出峰时间太快,峰之间的分离度较差;而分配系数K过大时出峰时间太长且峰形变宽。根据待分离组分的极性,本实验考察了乙酸乙酯-水系统,通过加入正己烷、甲醇、正丁醇等溶剂调整成分A和B的分配系数(依据文献[12]计算分配系数),结果见表1。

表1 成分A和B在不同两相溶剂系统中的分配系数Table 1 The K-values of compound A and B in different twophase solvent systems

正己烷-乙酸乙酯-甲醇-水( 1∶5∶1∶5,v / v ) 0.1 4 0.4 1乙酸乙酯-正丁醇-水( 5∶1∶5,v / v ) 2.3 8 5.9 7乙酸乙酯-水( 5∶5,v / v ) 0.7 1 2.1 3
在正己烷-乙酸乙酯-甲醇-水(5∶5∶5∶5,v/v)系统中成分A和B的分配系数太小,通过降低正己烷、甲醇的比例,增大正丁醇的比例使KA、KB增大。根据以上实验结果,成分A、B在乙酸乙酯-水(5∶5,v/v)系统的分配系数较合适。
本实验还对进样量进行了考察,由于该样品在乙酸乙酯-水(5∶5,v/v)系统中的溶解性较差,若进样量太大,样品不溶解,易导致固定相流失。因此本实验最终选择进样量为50 mg。
3.3 HSCCC分离制备的结果
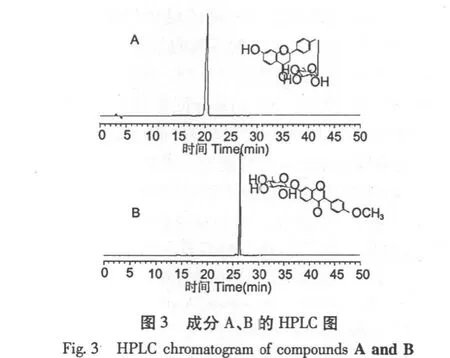
选择乙酸乙酯-水(5∶5,v/v)为溶剂系统,采用“2.4”的条件进行HSCCC分离,在此条件下,固定相保留率为53%,分离时间4 h,HSCCC图见图2。根据HSCCC图收集成分A和B,减压干燥得A (8.7 mg)和B(4.2 mg),将成分A和B通过HPLC检测(见图3),面积归一化确定其纯度分别为99.5%和97.3%。

3.4 成分A、B的结构鉴定
A(白色粉末)1H NMR(600 MHz,DMSO-d6)δ: 7.65(1H,d,J=8.4 Hz,H-5),7.45(2H,d,J=8.4 Hz,H-2',6'),7.07(2H,d,J=8.4 Hz,H-3',5'),6.51(1H,dd,J=9.0,1.8 Hz,H-6),6.35(1H,d,J= 1.8 Hz,H-8),5.53(1H,dd,J=12.6 Hz,2.4,H-2),4.89(1H,d,J=7.2 Hz,glc-H-1),3.14(1H,dd,J= 16.2,12.6 Hz,H-3-trans),2.67(1H,dd,J=16.2,2.4 Hz,H-3-cis)。13C NMR(150 MHz,DMSO-d6)δ: 79.34(C-2),43.84(C-3),190.61(C-4),129.09(C-5),111.24(C-6),165.32(C-7),103.26(C-8),163.73(C-9),114.22(C-10),133.01(C-1'),128.69 (C-2',6'),116.83(C-3',5'),158.12(C-4'),100.95 (glc-C-1),73.88(glc-C-2),77.72(glc-C-3),70.36 (glc-C-4),77.28(glc-C-5),61.35(glc-C-6)。以上波谱数据与文献[13]报道一致,故鉴定为甘草苷。
B(白色粉末)1H NMR(600 MHz,DMSO-d6)δ: 8.45(1H,s,H-2),8.06(1H,d,J=9.0 Hz,H-5),7.54(2H,d,J=9.0 Hz,H-2',6'),7.25(1H,d,J= 1.8Hz,H-8),7.15(1H,dd,J=9.0 Hz,1.8 Hz,H-6),7.0(2H,d,J=9.0 Hz,H-3',5'),5.11(1H,d,J =7.8Hz,glc-H-1),3.79(3H,s,-OCH3)。13C NMR (150 MHz,DMSO-d6)δ:154.34(C-2),124.04(C-3),175.34(C-4),127.63(C-5),116.31(C-6),162.12(C-7),104.07(C-8),157.72(C-9),119.12 (C-10),124.67(C-1'),130.76(C-2',6'),114.30 (C-3',5'),159.70(C-4'),100.64(glc-C-1),73.79 (glc-C-2),77.14(glc-C-3),70.29(glc-C-4),77.88 (glc-C-5),61.30(glc-C-6),55.83(-OCH3)。以上波谱数据与文献[14]报道一致,故鉴定为芒柄花苷。
4 讨论
本文采用聚酰胺树脂和高速逆流色谱相结合的方法分离纯化甘草中的黄酮类成分,实验结果表明,通过两种方法的联用可以分离制备高纯度的甘草苷和芒柄花苷。本文的研究为甘草中黄酮类成分的分离提供了一条新的技术路线,为甘草黄酮成分的进一步药理活性研究奠定了良好的基础。
1 National Pharmacopoeia Committee(国家药典委员会).Chinese Pharmacopoeia(中国药典),VolⅠ.Beijing:Chemical Industry Press,2005.59.
2 Lee SE,Hwang HJ,Ha JS.Screening of medicinal plant extracts for antioxidant activity.Life Sci,2003,73:167-179.
3 Gupta VK,Fatima A,Faridi U.Antimicrobial potential of Glycyrrhiza glabra roots.J Ethnopharmacol,2008,116:377-380.
4 Shin EM,Zhou HY,Guo LY.Anti-inflammatory effects of glycyrol isolated from Glycyrrhiza uralensis in LPS-stimulated RAW264.7 macrophages.Int Immunopharmacol,2008,8: 1524-1532.
5 Fu Y,Hsieh TC,Guo JQ,Licochalcone-A,a novel flavonoid isolated from licorice root(Glycyrrhiza glabra),causes G2 and late-G1 arrests in androgen-independent PC-3 prostate cancer cells.Biochem Biophys Res Commun,2004,322:263-270.
6 Wang JG(王建国),Zhou Z(周忠),Liu HF(刘海峰),et al.Application of active glycyrrhizic constituents to cosmetics.China Surf Deter Cosmet(日用化学工业),2004,34: 249-252.
7 Zhao ZY,Wang WX,Guo HZ,et al.Antidepressant-like effect of liquiritin from Glycyrrhiza uralensis in chronic variable stress induced depression model rats.Behav Brain Res,2008,194:108-113.
8 Yu DH,Duan YL,Bao YM,et al.An Isoflavonoids from Astragalus mongholicus protect PC12 cells from toxicity induced by l-glutamate.J Ethnopharmacol,2005,98:89-94.
9Gao L(高蕾),Yang GL(杨光丽),Chen LJ(陈俐娟).One step isolation and purification of four licoflavones from Glycyrrhiza uralensis by High-speed Counter-counter Chromatography.Sichuan Chem Ind(四川化工),2007,10(2):34-37.
10 Ma CJ,Li GS,Zhang DL,Liu K,et al.One step isolation and purification of liquiritigenin and isoliquiritigenin from Glycyrrhiza uralensis Risch.using high-speed counter-current chromatography.J Chromatogr A,2005,1078:188-192.
11 Wang QE,Lee FS,Wang XR.Isolation and purification of inflacoumarin A and licochalcone A from licorice by highspeed counter-current chromatography.J Chromatogr A,2004,1048:51-57.
12 Cao XL(曹学丽).Application of High-Speed Counter-Current Chromatography(高速逆流色谱分离技术与应用).Beijing:Chemical Industry Press,2005.171.
13 Wang YH(王英华),Bai H(白虹),Dou DQ(窦德强),et al.Study on the flavonoids constituents of cultivated licorice.Northwest Pharm J(西北药学志),2004,19(6):252-253.
14 Xiang C(向诚),Cheng J(成军),Liang H(梁鸿),et al.Isoflavones from Millettia nitida var.hirsutissima.Acta Pharm Sin(药学学报),2009,44:158-161.
Preparative Separation of Liquiritin and Ononin from Glycyrrhiza uralensis by High-speed Counter-current Chromatography
YUAN Yan-qiang1,WANG Zu-lin2,LIU Xiu-he2,HAN Li-wen1,LIU Ke-chun1*1Biology Institute of Shandong Academy of Sciences,Jinan 250014,China;2College of Food&Bioengineering,Shandong Institute of Light Industry,Jinan 250353,China
High-speed counter-current chromatography(HSCCC)was used to isolate and produce liquiritin and ononin from Glycyrrhiza uralensis.Firstly,the ethyl acetate extract of G.uralensis was purified by polyamide column chromatography,and then,the samples eluted by 30%ethanol-water were further purified by HSCCC.By using a two-phase solvent system composed of ethyl acetate-water(5∶5,v/v),8.7 mg of liquiritin and 4.2 mg of ononin were isolated from 50 mg samples with purities of 99.5%and 97.3%under the conditions of the flow rate of 2.0 mL/min,the rotational speed of 850 r/min and the detection wavelength of 254 nm.The structures of the obtained products were analyzed by NMR.The results indicated that HSCCC was an efficient method for isolation and purification of liquiritin and ononin.
high-speed counter-current chromatography;Glycyrrhiza uralensis;liquiritin;ononin
1001-6880(2011)06-1148-04
2010-01-26 接受日期:2010-06-12
山东省科技攻关项目(2006GG3202038)
*通讯作者 Tel:86-531-82605352;E-mail:hliukch@keylab.net
R284.2
A

