花烛突变体叶色嵌合性状的分化特征与保持方法
陈星旭,邵会会,王广东
(南京农业大学园艺学院,江苏 南京 210095)
花烛(Anthurium andraeanum Lind.)为天南星科(Araceae)多年生常绿草本植物[1],其叶片、佛焰苞及肉穗花序均具有较高的观赏价值,因此,既可作为优良盆花和切花,还可作为观叶植物。目前观叶花烛品种较少,培育观叶花烛新品种既可以丰富花烛品种,又能满足市场需求。
叶色嵌合体具有较高的观赏性,在天南星科其他种类中较为普遍,但在自然条件下花烛叶色嵌合体极少出现。2004年本项目组在进行花烛品种‘Sonate’的离体培养时发现,由愈伤组织再生的无菌苗中出现1株叶片颜色黄绿相间的叶色嵌合突变株,其表现形式为典型的扇区型嵌合体(sectorial chimera),其特征为不同遗传型细胞呈扇区状分布于生长点原基不同区域,从而形成左右相异的“阴阳脸型”。通过腋芽增殖和愈伤组织再生对该嵌合植株进行增殖,获得了多种性状的叶色突变株系,并从最初的花叶嵌合株系、黄化株系和深绿色株系中不断筛选出稳定的红化和白化株系[2]。
花烛叶色嵌合体无论是在离体培养条件下还是移栽后,均有一定比例植株的顶芽失去嵌合性状,但某些顶芽失去嵌合性状的植株,其侧芽萌发后仍能保持原有的叶色嵌合性状。因此,作者选择部分顶芽失去嵌合性状的突变单株进行单芽培养,即将母株切分成若干茎段,每个茎段含1个(或多个)茎节,然后将切分的茎段接种于培养基上[3],记录并分析侧芽再生植株的叶色性状特征,为进一步研究花烛叶色嵌合体叶色性状的形成和保持规律及稳定嵌合体的筛选提供依据。
1 材料和方法
1.1 材料
以花烛品种‘Sonate’叶色嵌合型无菌苗为实验材料。由于花烛嵌合体材料较少,生长速度慢,因此仅选择16个顶芽失去嵌合性状的单株进行研究。其中,8个单株处于增殖阶段,接种于增殖培养基[4]中;另外8个单株长期处于生根阶段,接种于生根培养基[5]中。
1.2 方法
将16个单株的茎分别切成小段,每个切段包含1片叶。顶芽和基部保留,一并进行后续培养。将处于增殖阶段单株的切段继续接种于增殖培养基上;将处于生根阶段单株的小段(包括带根的基部)继续接种于生根培养基上。待侧芽萌发后,连续记录每片新生叶片的叶色性状,拍照并统计嵌合再生率。
1.3 数据处理
分别统计增殖和生根阶段每个单株的侧芽嵌合再生率及基部再生芽嵌合率,并计算总嵌合再生率。计算公式分别为:侧芽嵌合再生率=(嵌合侧芽数/侧芽数)×100%;基部再生芽嵌合率=(嵌合芽数/再生芽数)×100%;总嵌合再生率=(嵌合芽总数/再生芽总数)×100%。
2 结果和分析
2.1 处于增殖阶段的花烛突变单株叶色嵌合性状的分化特征及嵌合再生率分析
8个处于增殖阶段的花烛突变单株均有一定比例的侧芽具有嵌合性状,其中1个单株的侧芽再生植株中嵌合性状的分化特征见图1。在图1-1中,Ⅰ切段为植株基部,Ⅵ切段为植株顶芽,Ⅱ、Ⅲ、Ⅳ和Ⅴ切段为基部至顶部按顺序排列的4个茎段,接种于增殖培养基上2~3个月后均有再生芽形成。Ⅰ切段的再生植株性状见图1-2~4,在第4片新生叶边缘有少量非绿色部分,但该植株是由愈伤组织再生而来(图1-3),因此,在计算侧芽再生植株的嵌合率时并不将其计入。这种现象在Ⅱ茎段中尤为明显,Ⅱ茎段的侧芽并未萌发,而是先在切口处长出一团愈伤组织(图1-6),然后再由愈伤组织分化出1株具嵌合性状的植株(图1-7)。Ⅲ和Ⅳ茎段最初的叶片均为嵌合型叶片(图1-1中箭头所示),二者在随后的培养过程中均分化出具嵌合性状的植株(图1-10,13)。但这2个再生植株的第1片叶均不具备嵌合性状,前者的第2片新生叶(图1-9箭头所示)和后者的第3片新生叶(图1-13箭头所示)才具有嵌合性状。Ⅴ茎段的第3片叶边缘存在少许非绿色部分,但随后的第4片叶嵌合性状消失(图1-16)。Ⅵ切段为顶芽,其再生叶片均为绿色,无嵌合性状出现(图1-19)。此单株总计再生植株6株,其中确定为侧芽的4株,侧芽中明显出现嵌合性状的2株。
在计算侧芽的嵌合率时对偶然出现且非绿色部分在叶面积中所占比率极小的叶片不予计数,因此,上述单株的侧芽嵌合再生率为50.0%。按此方法,统计了处于增殖阶段的8个单株的侧芽嵌合再生率,统计结果见表1。
由表1可知:8个单株的侧芽均能再生出具嵌合性状的植株,且这些侧芽均萌发于最初即为嵌合叶片的叶腋。供试的8个单株中,侧芽嵌合再生率最高为75.0%、最低为25.0%,处于增殖阶段的8个单株的总侧芽嵌合再生率为48.4%。

图1 处于增殖阶段的花烛突变单株再生植株叶色嵌合性状的分化特征Fig.1 Differentiation characteristics of leaf color chimera feature of regenerated plantlet from mutated plantlet of Anthurium andraeanum Lind.in proliferation phase
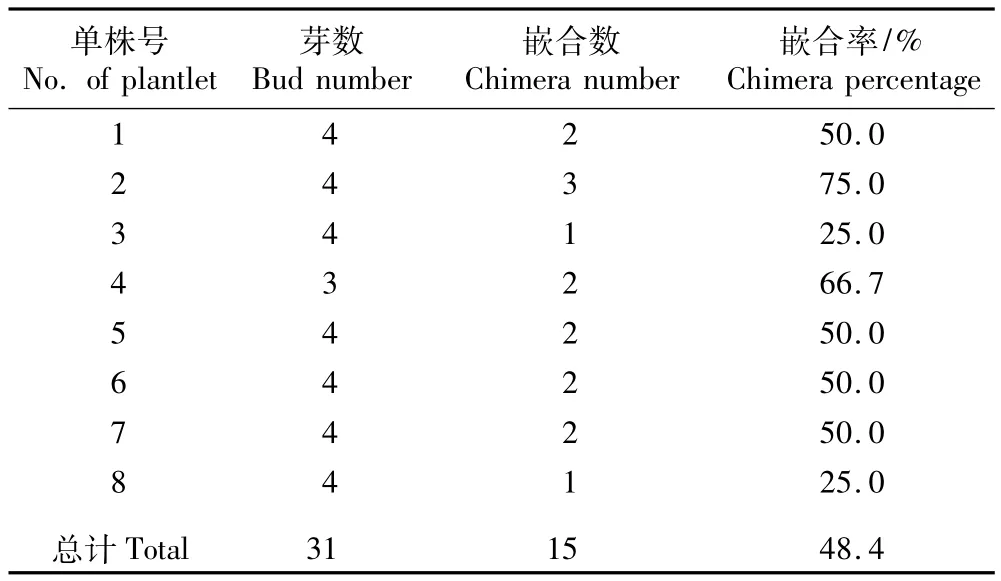
表1 处于增殖阶段的8个花烛突变单株侧芽嵌合率比较Table1 Comparison of chimera percentage of axillary bud from eight mutated p lantlets of Anthurium andraeanum Lind.in proliferation phase
2.2 处于生根阶段的花烛突变单株叶色嵌合性状的分化特征及嵌合再生率分析
处于生根阶段的8个花烛突变单株均有一定比例的侧芽具有嵌合性状,其中1个单株的侧芽再生植株中嵌合性状的分化特征见图2。如图2-1所示,Ⅰ号为失去嵌合性状的顶芽,在培养过程中出现了散点绿型叶片(图2-3)。Ⅱ号为该嵌合单株的基部,在培养过程中从基部萌发了2个新芽,分别为嵌合型和非绿色型(图2-4)。该嵌合单株还具有2个萌发侧芽Ⅲ和Ⅳ(图2-1),在未进行单芽繁殖前,其中Ⅲ号侧芽在非绿色的一端(图2-1),为非绿色型;Ⅳ号侧芽在绿色部分的一端(图2-1),为嵌合型;Ⅲ号侧芽在随后的培养中一直为非绿色型(图2-6~8),而Ⅳ号侧芽则一直保持嵌合性状(图2-9~11)。
由于本实验仅统计侧芽嵌合率,因而由顶芽性状改变重新生成的嵌合型叶片不计入侧芽嵌合再生率;由于植株处于生根阶段,此阶段的培养基成分与增殖阶段不同,不易使茎段切口处出现大量愈伤组织,因此将此阶段侧芽再生的新芽全部进行统计记录;再则,基部短缩茎节上叶片全部老化脱落,无法进一步分析基部再生芽的叶色性状与原叶片及母株叶色特征间的关系,因此未将这类再生芽计入侧芽再生数,而是作为基部再生芽数另行统计分析,因此,每个单株的总再生芽数包括了侧芽与基部再生芽数。按照前述统计原则,8个处于生根阶段的单株的侧芽再生芽及基部再生芽的嵌合状况的统计结果见表2。结果表明:8个单株的侧芽及基部均能萌发出具嵌合性状的再生芽,总嵌合再生率分别达到47.8%和64.7%。其中8个单株中侧芽嵌合再生率最高达到66.7%,最低为25.0%;8个单株中基部再生芽嵌合率最高为80.0%、最低33.3%,表明通过侧芽和基部再生芽均可萌发获得嵌合体。

图2 处于生根阶段的花烛突变单株再生芽叶色嵌合性状的分化特征Fig.2 Differentiation characteristics of leaf color chimera feature of regenerated bud from mutated plantlet of Anthurium andraeanum Lind.in rooting phase
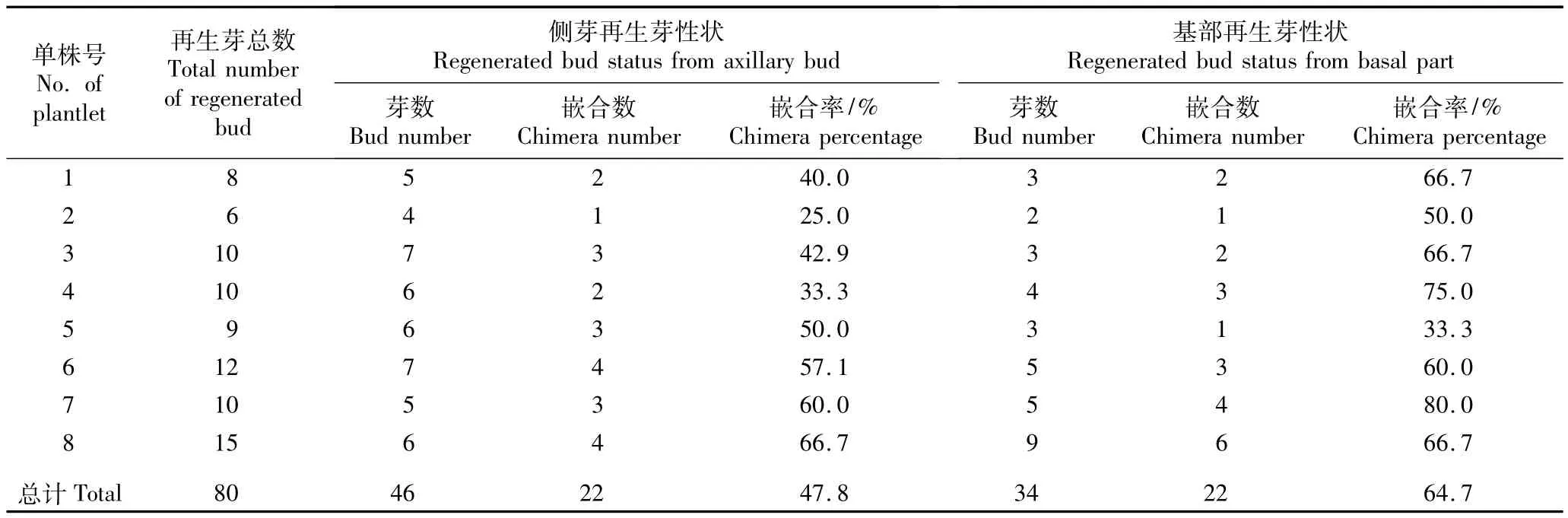
表2 处于生根阶段的8个花烛突变单株侧芽及基部再生芽的嵌合率比较Table2 Comparison of chimera percentage of regenerated bud from axillary bud and basal part of eight mutated p lantlets of Anthurium andraeanum Lind.in rooting phase
3 讨论和结论
处于增殖和生根2个阶段的花烛叶色嵌合体通过侧芽再生总嵌合率分别可达48.4%和47.8%。通过生根阶段植株茎基部再生不定芽的方法,总嵌合率则高达64.7%。因此,可以利用现有嵌合植株(不同生长阶段皆可)通过侧芽再生(增殖与生根2个阶段)或基部再生(生根阶段)的方法确保嵌合性状的持续出现,其中以基部再生芽嵌合率略高,适于稳定嵌合体的筛选。根据本研究结果,总结归纳出花烛突变单株叶色嵌合性状的保持方法,其流程图见图3。

图3 花烛突变植株叶色嵌合性状保持流程图Fig.3 Flow chart of retention of leaf color chimera feature of mutated plantlet of Anthurium andraeanum Lind.
花烛茎节短缩,不易切成小段进行单芽繁殖培养。但是,供试品种‘Sonate’为切花品种,其茎节长于其他品种,在增殖培养基中添加了2iP,能够促使其幼苗茎节进一步伸长[3-4],便于在增殖阶段进行单芽繁殖操作。在生根阶段,幼苗生根、茎加粗、茎节缩短,且培养时间越长,茎基部茎节缩短越明显;而在此阶段生长时间较长,且茎节上又存在休眠芽[6],因而,处于此阶段的植株基部存在较多芽点,切掉基部以上部位后仍可以促使这些芽点萌发,产生大量再生植株。因而,除可通过侧芽再生培养保持叶色嵌合性状外,也可通过生根阶段茎基部的再生培养保持花烛的叶色嵌合性状。
植物嵌合性状若能连续表现,那么在顶端分生组织中就必然包含突变细胞,且突变细胞能够在顶端分生组织不断形成中不被替代[7-9]。同时,在含突变细胞的顶端分生组织形成叶原基的过程中,要确保突变细胞在顶端分生组织的L1、L2和L3层中占有一定的比率,进而在叶原基形成叶片时才能呈现出嵌合性状[8-9]。侧芽的形成晚于顶芽,侧芽的形成与分化具有特殊之处,即存在倾向于分化成叶片的营养性原基(vegetative primordium)和倾向于重新形成分生组织的生殖性原基(reproductive primordium)的差别[10]。花烛叶色嵌合体顶芽失去嵌合性状后,可以通过侧芽增殖保持嵌合性状,这说明侧芽原基中部分分生组织细胞中包含突变细胞。分生组织细胞是在侧芽原基的形成过程中确立的,这种重新确立的机制尚不明确,而这一问题的解决将为进一步明确顶端分生组织及侧芽原基的形成和分化机制以及嵌合性状的传递和保持特性提供理论基础。
[1]Higaki T,Lichty JS,Moniz D.Anthurium Culture in Hawaii[M].Honolulu:University of Hawaii,1995:1.
[2]徐 彬,辛伟杰,王广东,等.花烛离体培养叶色变异株系的相关性状[J].植物学通报,2006,23(6):698-702.
[3]Pierik R L M.In Vitro Culture of Higher Plants[M].Dordrecht: Martinus Nijh of f Publishers,1987:196.
[4]徐 彬.几个花烛品种离体快繁体系的建立和离体叶色变异株系性状研究[D].南京:南京农业大学园艺学院,2005:50.
[5]陈星旭,张 琪,王广东.花烛叶色嵌合体不同生长阶段叶色性状的保持特征[J].植物研究,2009,29(5):565-570.
[6]Dufour L,Guérin V.Growth,developmental features and flower production of Anthurium andraeanum Lind.in tropical conditions[J].Scientia Horticulturae,2003,98(1):25-35.
[7]Groß-Hardt R,Laux T.Stem cell regulation in the shootmeristem[J].Journal of Cell Science,2003,116(9):1659-1666.
[8]Marcotrigiano M.Chimeras and variegation:patterns of deceit[J].HortScience,1997,32(5):773-784.
[9]Szymkowiak E J,Sussex IM.What chimeras can tell us about plant development[J].Annual Review of Plant Physiology and Plant Molecular Biology,1996,47:351-376.
[10]Grbi′c V.Comparative analysis of axillary and floralmeristem development[J].Canadian Journal of Botany,2005,83(4):343-349.

