眼针对局灶性脑缺血大鼠模型海马组织TGF-β1表达的影响*
宓 丹 马贤德 王 建
(1.辽宁中医药大学,辽宁 沈阳 110032;2.辽宁中医药大学附属第二医院,辽宁 沈阳110034;3.辽宁中医药大学附属医院,辽宁 沈阳 110032)
近年来研究表明脑缺血、缺氧后可刺激机体产生各种生长相关因子,这些生长因子可以减轻神经元的损伤,促进神经元的再生。转化生长因子-β1(TGF-β1)是一种多功能生长因子,可延长神经元的存活,具有神经保护作用。已有研究表明眼针可以通过抑制TNF[1]等炎症因子来治疗脑缺血,但是否可以通过促进各种生长因子来治疗缺血性脑血管疾病尚未见报道。本研究通过观察眼针对局灶性脑缺血大鼠模型海马组织TGF-β1表达影响,来进一步探讨眼针治疗缺血性脑血管疾病的机制。
1 材料与方法
1.1 试剂 兔抗鼠TGF-β1抗体、即用型SABC免疫组化染色试剂盒及DAB染色试剂均购自武汉博士德生物工程有限公司。
1.2 动物与分组 健康SPF级SD大鼠90只,雌雄不拘,体质量(280±20)g,由上海西普尔必凯实验动物有限公司提供,许可号:SCXK(沪)2008-0016。适应性喂养1周,自由饮水、摄取标准颗粒饲料,室内温度22℃,相对湿度45%。按随机数字表法将大鼠分为空白组、假手术3 h组、假手术24 h组、假手术72 h组、模型3 h组、模型24 h组、模型 72 h组、眼针3 h组、眼针24 h组、眼针72 h组,共10组,每组9只。
1.3 模型制备 参照文献[2],模型组及眼针组采用改良线栓法复制大鼠大脑中动脉缺血再灌注损伤模型。大鼠于缺血2 h后进行再灌注,再灌注后进行神经功能缺损程度评分,参照Longa 5分制评分标准[3]:0分为无症状;1分为不能完全伸展对侧前爪;2分为向对侧转圈;3分为向对侧倾倒;4分为不能自发行走,意识丧失。评分为1~3分者纳入,未达标准者排除。假手术组术式同模型、眼针组,区别在于鱼线插入深度为0.5~1 cm。空白组未做处理。
1.4 干预方法 眼针组:用31号13 mm毫针,于大鼠眶周2 mm处针刺,定位参照人体取穴方法[4],取肝区、上焦区、下焦区、肾区针刺。手法:平刺,进针3 mm。留针20 min,留针期间捻转行针3次,每次1 min。治疗时机:眼针组于脑缺血再灌注即刻进行眼针治疗,存活期间每12小时1次;眼针3 h组于取材前30 min再进行眼针治疗1次。
1.5 标本采集与处理 动物完成观察时间后,以10%水合氯醛(3.5 mL/kg体质量)腹腔麻醉,开胸暴露心脏,将灌注针头插入心脏,剪开右心耳,依次迅速灌注0.9%氯化钠注射液200 mL、4℃的4%多聚甲醛200 mL,灌注至无血色止,灌毕迅速取脑,在视交叉平面前后5~10 mm处将脑冠状切面切开,留取中间部分置于4℃的4%多聚甲醛固定液中过夜。常规上行脱水、透明后用石蜡包埋,连续切片,切片厚5 μm,每隔10张取1张,使每张切片上都有海马组织。
1.6 指标检测 采用免疫组化(SABC法)检测。切片脱蜡至水,抗原修复液修复,滴加封闭液,滴加1∶100兔抗鼠抗体,过夜,加SABC。DAB显色、复染、脱水、透明,封片。采用BI2000医学图像分析系统对采集的图像测定阳性反应物的灰度,细胞膜或细胞浆内出现清晰棕褐色颗粒为阳性。每例动物随机取3~4张切片,且各组所选部位相同。
1.7 统计学处理 应用SPSS10.0统计软件。数据以 (±s)表示。组间比较采用单因素方差分析处理。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠神经功能缺损程度评分比较 见表1。模型组和眼针组大鼠均出现不同程度的神经功能障碍,如提尾时左侧前肢不能伸直,行走向对侧旋转或倾倒等;假手术组大鼠无神经功能障碍表现。模型组大鼠神经功能障碍在24 h达到高峰,随时间延长,72 h时大鼠神经功能障碍减轻但无明显差异。眼针组与模型组相比,在再灌注损伤3 h后神经功能缺损程度评分无差异,随时间延长眼针组大鼠神经功能障碍减轻,与模型组比各时间点大鼠神经功能缺损程度评分有差异(P<0.05)。
表1 眼针对局灶性脑缺血大鼠神经功能缺损程度评分比较(分,±s)

表1 眼针对局灶性脑缺血大鼠神经功能缺损程度评分比较(分,±s)
与模型组比较,*P<0.05,**P<0.01。 下同。
组 别 24 h 72 h空白组 0 0 n 3 h 9 0假手术组 0 0 9 0模型组 9 2.2±0.6 2.7±0.4 2.3±0.5眼针组 9 2.1±0.6 2.0±0.7* 1.5±0.9*
2.2 各组大鼠海马组织TGF-β1表达比较 见表2。空白组和假手术组可见TGF-β1蛋白微量表达,模型组和眼针组大鼠各时间点TGF-β1蛋白含量与假手术组比较,差异均有统计学意义(P<0.01)。模型组TGF-β1蛋白含量在脑缺血再灌注3 h开始增加,随缺血时间延长逐渐升;在相应各时间点,眼针组TGF-β1蛋白含量较模型组增高,差异均具有统计学意义,以脑缺血再灌注72 h升高最为明显(P<0.05或0.01)
表2 各组大鼠海马组织TGF-β1表达比较(±s)
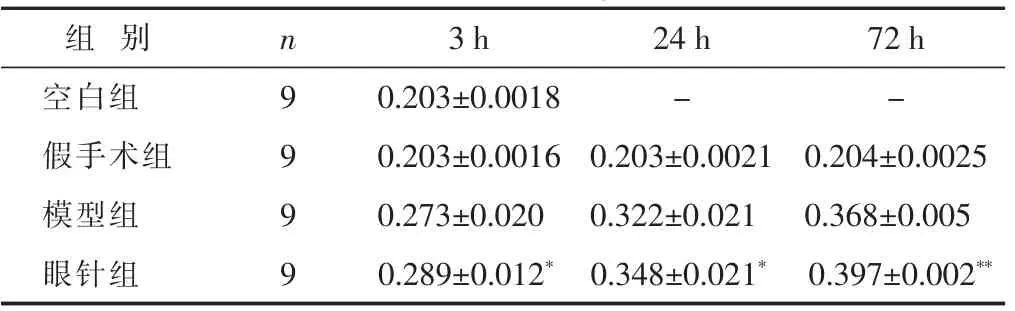
表2 各组大鼠海马组织TGF-β1表达比较(±s)
组 别 24 h 72 h空白组 - -n 3 h 9 0.203±0.0018假手术组 0.203±0.0021 0.204±0.0025 9 0.203±0.0016模型组 9 0.273±0.020 0.322±0.021 0.368±0.005眼针组 9 0.289±0.012* 0.348±0.021* 0.397±0.002**
3 讨 论
TGF-β是一种生物效应比较广泛的生长因子,参与细胞的增殖和分化、胚胎发育、细胞外基质的合成以及血管生成等体内生理学过程,在纤维化、损伤修复和肿瘤生长等许多病理学过程中发挥重要作用[5]。其中TGF-β1在哺乳动物体细胞体系中所占的比例最高(>90%),活性最强,与疾病关系最密切,成为研究的热点。在生理情况下,TGF-β1呈低水平表达;缺血、缺氧可以刺激TGF-β1的表达。Kyupinski等[6]对10例缺血性卒中患者死亡24 h内的脑组织进行病理学检查发现,所有神经元、胶质细胞,特别是少突胶质细胞均表达TGF-β1mRNA,微血管周围的巨噬细胞和梗死组织的内皮细胞也有较强表达。对侧脑组织中TGF-β1mRNA水平最低,缺血半暗带最高。李华军等[7]通过对小鼠全脑缺血再灌注TGF-β1在缺血组织中的表达检测,结果表明缺血30 min及再灌注早期TGF-β1表达增强,但随着再灌注时间延长,坏死加重,TGF-β1表达下降。而缺血半影区TGF-β1表达随缺血再灌注时间延长逐渐增强。此趋势说明,它在调节神经细胞死亡的机制中起着重要作用,参与脑缺血后神经元的保护与修复作用。缺乏TGF-β1基因表达的新生小鼠会出现广泛的神经元变性,同时伴有突触素和层黏蛋白表达下降以及显著的小胶质增生。这种缺乏TGF-β1基因小鼠的神经元在体外培养时存活时间明显缩短,并且成年小鼠易受到兴奋性毒性损伤[8]。作为一种活性很强的血管生成调节因子,TGF-β1还可激活缺血半暗带的内皮细胞,促进微血管再生。研究表明,TGF-β1能够与碱性成纤维生长因子和巨噬细胞一起诱导血管生成,并有利于转运坏死组织和神经重塑[9]。体内和体外实验均已经证实了TGF-β1的神经保护作用。但是由于TGF-β1无法通过血脑屏障,因此对于利用外源性TGF-β1治疗缺血性脑血管疾病的研究一直无法应用于临床。
名老中医彭静山教授根据中医学 “五轮八廓”等理论结合“八卦”学说,建立“八区十三穴络脑通脏腑”理论。临床上通过观察眼睛各区中脉络形态和色泽变化以诊断疾病,依据 “观眼识病”创立了彭氏眼针疗法。40多年的临床百余万病例实践证明,眼针疗法对脑梗死病患者治疗效果确切显著,是一种简便有效、无不良反应、易于推广的疗法。
中风病的基本病机之一为肝肾阴虚,偏瘫的上、下肢分别归属上焦区、下焦区,故本实验用眼针取肝区、肾区以滋补肝肾治病求本,取上焦区、下焦区以活血通络治其标。实验结果表明,假手术组和空白组TGF-β1微量表达;模型组3 h可见TGF-β1表达上升与假手术组比有差异(P<0.05),随缺血时间延长,TGF-β1蛋白表达持续升高,说明缺血缺氧可刺激其表达;眼针组TGF-β1蛋白表达趋势与模型组一致,各时间点与模型组比有明显差异,以72 h时间点差异最为明显。而眼针组大鼠模型神经功能缺损评分明显下降 (P<0.05)。说明眼针可以通过刺激肝区、肾区、上焦、下焦,对内源性TGF-β1的生成加以干预调节使其增,从而通过一系列免疫介导减轻神经元的损伤,改善神经功能障碍。但是眼针如何促进TGF-β1表达的机理目前尚不清楚,还需进一步研究。
[1]王鹏琴,周鸿飞,王健,等.眼针对局灶脑缺血再灌注大鼠脑组织及血液肿瘤坏死因子含量的影响[J].上海针灸杂志,2011,30(2);71-72.
[2]马贤德,孙宏伟.线栓法制备大鼠脑缺血再灌注模型的方法研究[J].中华中医药学刊,2009,27(6):1200-1201.
[3]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[4]彭静山.眼针疗法[M].沈阳:辽宁科学技术出版社,1990:11.
[5]Azhar M,Schultz J,Grupp I,et al.Transforming growth factor beta in cardiovascular development and function[J].Cytokine Growth Factor Rev,2003,14(5):391-407.
[6]Krupinski J,Kumar P,Kumar S,et al.Increased expression of TGF-batal in brain tissue after is chemic stroke inhumans[J].Stroke,1996,27(5):852-869.
[7]李华军,尹娇,陈东,等.转化生长因子β-1在全脑缺血再灌注后迟发性神经元坏死时的表达[J].中风与神经疾病,2003,2(20):52-54.
[8]Brionne TC,Tesseur I,Masliah E,et al.Loss of TGF-β1leads to increased neuronal cell death and microglios is in mouse brain [J].Neuron,2003,40:1133-1145.
[9]Clemetson KJ,Clemetson JM.Integrins and cardiovascular disease[J].Cell MolLife Sci,1998,54:502-513.

