口腔鳞癌细胞过表达MHC-Ⅰ类链相关蛋白A对自然杀伤细胞与细胞毒性T淋巴细胞杀伤活性影响的实验研究
李超 石芳琼 杨丹 王洁 翦新春 蒋灿华
(1.中南大学湘雅医院 口腔颌面外科;2.中南大学湘雅医学院 免疫学系,长沙 410078)
口腔鳞癌细胞过表达MHC-Ⅰ类链相关蛋白A对自然杀伤细胞与细胞毒性T淋巴细胞杀伤活性影响的实验研究
李超1石芳琼1杨丹1王洁2翦新春1蒋灿华1
(1.中南大学湘雅医院 口腔颌面外科;2.中南大学湘雅医学院 免疫学系,长沙 410078)
目的 探讨口腔鳞癌细胞过表达MHC-Ⅰ类链相关蛋白A(MICA)对自然杀伤细胞(NK)与细胞毒性T淋巴细胞(CTL)杀伤活性的影响。方法 通过绘制细胞生长曲线、检测细胞周期、进行平板集落形成率及裸鼠皮下成瘤等方法对稳定转染并过表达MICA的口腔鳞癌细胞株进行生物学特性鉴定。采用乳酸脱氢酶释放法及流式细胞术分析口腔鳞癌细胞过表达MICA对NK与CTL细胞杀伤活性及自然杀伤细胞2族成员D(NKG2D)受体表达的影响。结果 口腔鳞癌细胞转染MICA基因后主要生物学特性未发生改变,但能显著增强NK与CTL细胞杀伤活性并上调其表面NKG2D的表达,与未转染及转染空白载体的细胞比较,差异有统计学意义(P<0.05)。结论 MICA可作为口腔鳞癌免疫基因治疗的潜在靶标,值得进一步研究。
口腔; 鳞状细胞癌; MHC-Ⅰ类链相关蛋白A; 杀伤活性; 基因治疗
MHC-Ⅰ类链相关蛋白A(MHC classⅠchainrelated protein A,MICA)是新近发现的由MHC基因编码的跨膜糖蛋白,其主要功能是作为自然杀伤细胞(natural killer,NK)、细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)等免疫效应细胞活化性受体自然杀伤细胞2族成员D(natural killer group 2,member D,NKG2D)的配体,能与NKG2D特异性结合,传递活化信号,诱导免疫效应细胞迅速清除异常表达此种配体的肿瘤细胞[1-3]。正常情况下MICA组织分布局限,但近年来发现MICA在许多肿瘤细胞均有表达或上调,因而被视为一种肿瘤相关性抗原[4-7]。
在前期研究中,成功构建了MICA基因的真核表达载体,采用脂质体法转染人舌鳞癌脑高转移Tb细胞系,经G418筛选,有限稀释法建立单克隆细胞株。逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)及免疫细胞化学检测显示,转染后MICA mRNA和蛋白均呈过表达状态[8]。本研究主要通过体外实验观察人舌鳞癌脑高转移Tb细胞系稳定转染并过表达MICA后对NK与CTL细胞NKG2D表达及细胞毒活性的影响,为通过MICA基因调控来进行口腔鳞癌的免疫治疗提供新的思路。
1 材料和方法
1.1 主要试剂和仪器
胎牛血清、马血清、RPMI1640及α-MEM培养液(GIBCO公司,美国),人重组白细胞介素-2(recombine human interleukin-2,rhIL-2)(长春生物制品研究所),甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)、淋巴细胞分离液(Sigma公司,美国),异藻蓝蛋白(allophycocyanin,APC)标记的鼠抗人NKG2D/ CD314单克隆抗体(eBioscience公司,美国),乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(南京建成生物工程研究所)。
1.2 实验动物和细胞系
选取BALB/C-nu/nu裸小鼠18只(购自上海斯莱克实验动物有限公司),4~6周龄,雄性,饲养于中南大学实验动物中心无特定病原体(special pathogen free,SPF)级动物房。人舌鳞癌脑高转移Tb细胞系由上海交通大学口腔医学院肿瘤生物实验室馈赠。人NK细胞系NK92由华中科技大学同济医学院医学免疫学系馈赠,培养于含12.5%胎牛血清、12.5%马血清和rhIL-2(100U·mL-1)的α-MEM培养液中。转染MICA基因重组质粒pEGFP-N1-MICA或空白质粒pEGFPN1的细胞株Tb-pEGFP-N1-MICA及Tb-pEGFP-N1由本课题组建立。
1.3 Tb-pEGFP-N1-MICA细胞株生物学特性的鉴定
以Tb细胞及Tb-pEGFP-N1细胞为对照,对Tb细胞转染并过表达MICA后的生物学特性进行鉴定。
1.3.1 细胞生长曲线 接种细胞于96孔板,每孔103个,培养于200μL含10%胎牛血清的RMPI1640培养液中,每组15孔,每24 h每组取3孔加入10μL MTT溶液(5mg·mL-1),继续培养4 h后弃上清,每孔加入200μL二甲基亚砜,充分溶解蓝紫色结晶后于酶标仪上(检测波长为570nm)测定光密度值(A值),连续5 d,绘制细胞生长曲线。
1.3.2 细胞周期检测 无血清RMPI1640培养液培养细胞过夜,0.25%胰酶消化后重悬,1 500 r·min-1离心5min,PBS洗涤2次,70%预冷乙醇4℃固定过夜,PBS洗涤3次,加入1mL碘化丙啶(propidium iodide,PI)染液(50μg·mL-1),37℃孵育30min后上流式细胞仪检测。
1.3.3 平板集落形成实验 台盼蓝染色计数活细胞,稀释于含10%胎牛血清的RMPI1640培养液中,6孔板每孔加入细胞数为200个,37℃、5%CO2的细胞培养箱中培养2周,弃上清,用PBS小心浸洗2次,甲醇固定15min,加适量结晶紫染液染色15min,洗去染液,空气干燥。显微镜下计数,细胞数大于50计为1个集落。计算集落形成率=集落数/细胞接种数× 100%。
1.3.4 裸鼠移植瘤实验 消化细胞调整密度至每毫升5×106个,皮下接种裸小鼠,成瘤后颈椎脱臼处死,无菌条件下剥离肿瘤,修整成2mm×2mm×2mm大小组织块,共6块,分别植入另6只裸鼠背部皮下。植入后第11天开始用游标卡尺测量移植瘤最小径a,最大径b,计算移植瘤体积V=a2b/2,2 d 1次,绘制移植瘤生长曲线,至第23天处死裸鼠,剥离肿瘤称重。
1.4 口腔鳞癌细胞过表达MICA对NK细胞NKG2D表达及杀伤活性的影响
调整NK92细胞密度为每毫升1×107个,作为效应细胞;Tb、Tb-pEGFP-N1和Tb-pEGFP-N1-MICA细胞密度为每毫升1×106个,作为靶细胞,设效靶比为10∶1,按以下方案在96孔板中加样。1)测定孔:效应细胞和靶细胞各100μL;2)自然释放孔:靶细胞100μL,RPMI1640培养液100μL;3)最大释放孔:靶细胞100μL,20%十二烷基硫酸钠(dodecyl sulfate sodium salt,SDS)100μL;4)细胞对照孔:效应细胞100μL,RPMI1640培养液100μL。以上每组设3个复孔。将96孔板轻轻混匀后置37℃、5%CO2培养箱中培养24 h。收集测定孔NK92细胞用于流式细胞术检测。吸取各孔上清于另一96孔板中继续培养10min,每孔加入底物溶液100μL,室温避光孵育10min,加入终止反应溶液30μL,用酶标仪(检测波长490 nm)测定A值。计算杀伤活性(%)=(测定孔A值-自然释放孔A值-细胞对照孔A值)/(最大释放孔A值-细胞对照孔A值)×100%。
测定孔NK92细胞重悬后加入2个流式细胞仪专用检测管中,其中1个管加入APC标记的鼠抗人NKG2D/ CD314单克隆抗体5μL,另1个管不加抗体作为空白对照管,振荡混匀后避光室温孵育15min,1200 r·min-1离心5min,弃上清,每管加入PBS溶液0.3mL,重悬后上机检测。利用CELLQUEST软件,先用空白对照管设置仪器检测参数,再以每管不少于10 000个细胞的条件收集另1管中的细胞。在CELLQUEST软件上结合“画门”(gating)技术对收集的数据进行分析。
1.5 口腔鳞癌细胞过表达MICA对CTL细胞NKG2D表达及细胞毒活性的影响
密度梯度离心法分离人外周血(健康志愿者提供)单个核细胞(peripheral blood mononuclear cell,PBMC),分别与经过丝裂霉素C灭活处理的Tb、TbpEGFP-N1和Tb-pEGFP-N1-MICA细胞按1∶1的比例混合,培养7 d对PBMC进行预刺激,调整密度后作为效应细胞;对数生长期Tb细胞作为靶细胞,设效靶比为10∶1,共同孵育24 h,流式细胞仪检测CTL细胞NKG2D的表达,LDH释放法检测CTL细胞对Tb细胞的细胞毒活性(方法同1.4)。
1.6 统计学处理
采用SPSS16.0统计软件包两独立样本t检验或方差分析进行统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 Tb-pEGFP-N1-MICA细胞株的生物学特性
Tb细胞转染并稳定过表达MICA后细胞生长曲线、细胞周期、平板集落形成及皮下成瘤等生物学特性未发生明显改变(图1~3、表1)。

图1 细胞生长曲线Fig 1 Cell growth curve
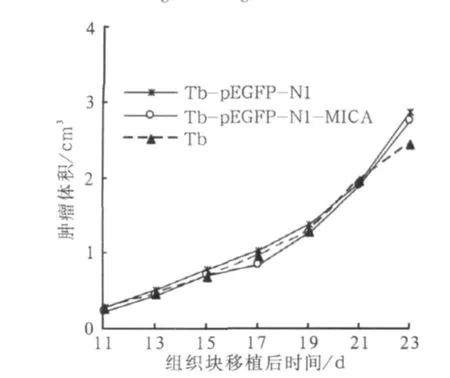
图2 裸鼠移植瘤体积生长曲线Fig 2 Growth curve of transplanted tumors in nude mice

图3 裸鼠重量的比较Fig 3 Comparison of transplanted tumors in weight
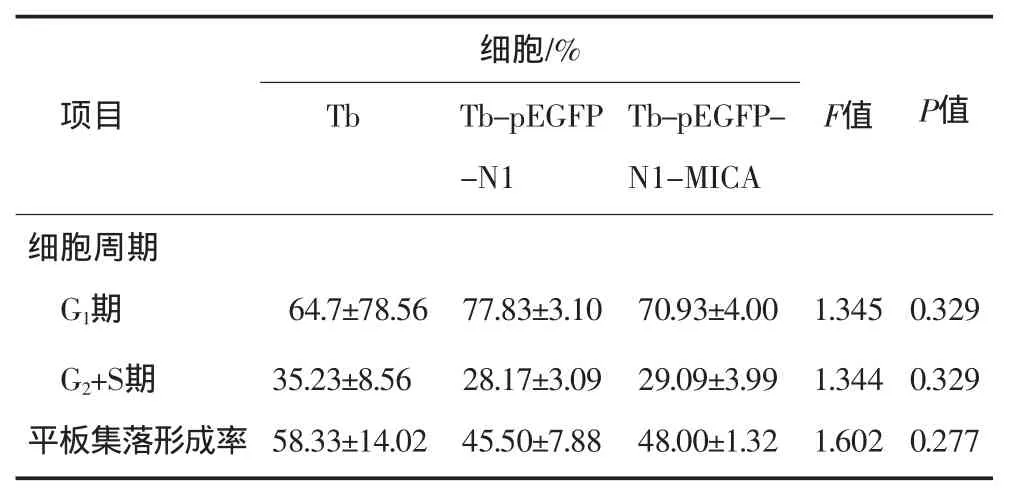
表1 细胞周期及平板集落形成率的比较Tab 1 Com parison of cell cycle distribution and p late clone form ing rate
2.2 口腔鳞癌细胞过表达MICA对NK与CTL细胞NKG2D表达及杀伤活性的影响
Tb-pEGFP-N1-MICA细胞能明显上调NK与CTL细胞NKG2D的表达并增强其对肿瘤靶细胞的杀伤活性,与Tb和Tb-pEGFP-N1细胞比较,差异有统计学意义(P<0.05,表2)。

表2 口腔鳞癌细胞过表达M ICA对NK与CTL细胞NKG2D表达及杀伤活性的影响Tab 2 Effects on NKG2D receptor expression and cytotoxicity of NK and CTL by genetic overexpression of M ICA in OSCC cells %
3 讨论
NK和CTL是机体内主要的抗肿瘤免疫效应细胞,其功能状态与细胞表面的C型凝集素样活化型受体NKG2D密切相关。NKG2D识别的配体在人类主要有3个,分别为MICA、MICB及ULBP(UL16-binding protein),但现有研究表明:在抗肿瘤免疫中起主要作用的是MICA[9-10]。肿瘤细胞MICA与NK细胞NKG2D结合后,能诱导死亡伴随蛋白-10的YxxM基序磷酸化,继而激活磷脂酰肌醇-3-激酶的P85亚基,使下游的蛋白激酶B磷酸化,从而激活细胞外信号调节激酶1/ 2和促丝裂原激活蛋白激酶旁路,并促使Ca2+内流,传递活化信号。此外,MICA还能够与CTL的NKG2D结合并促进其增殖,显著增强T细胞抗原受体依赖性的细胞毒作用,而且MICA-NKG2D可替代CD28-B7产生共刺激信号,活化CTL细胞[11]。因而,近年来MICA-NKG2D信号通路介导的免疫监视在抗肿瘤免疫研究中的作用越来越受到学者们的重视。
MICA在机体内存在2种功能形式,即细胞表面的膜结合型MICA(member MICA,mMICA)和游离状态的可溶性MICA(soluble MICA,sMICA),后者在免疫效应中的作用恰好相反,通过诱导NKG2D的内化和降解,促进肿瘤逃逸免疫应答。mMICA可通过多种机制脱落而成为sMICA。近年的研究多集中在金属基质蛋白酶和解聚素对MICA脱落的影响[12-14]。前期研究发现,口腔鳞癌MICA mRNA高于癌旁组织但蛋白表达却低于癌旁组织,而血清中sMICA高于正常,提示肿瘤细胞表面的MICA因发生脱落不足以充分活化NKG2D,导致NK和CTL细胞杀伤效应降低。
本研究中首先以未转染的Tb细胞及转染空白载体的Tb-pEGFP-N1细胞为对照,对Tb-pEGFP-N1-MICA细胞的生物学特性进行了鉴定。结果发现:3组细胞的细胞形态、生长速度、细胞周期、平板集落形成及皮下成瘤等均未见差异,表明Tb细胞转染并稳定过表达MICA后主要生物学特性未发生改变。
以人NK92细胞或经过灭活处理的Tb、Tb-pEGFPN1和Tb-pEGFP-N1-MICA细胞预刺激的人PBMC作为效应细胞,以Tb、Tb-pEGFP-N1及Tb-pEGFP-N1-MICA细胞作为靶细胞在体外共同培养,流式细胞术及LDH释放法检测结果显示:口腔鳞癌细胞过表达MICA蛋白能显著上调NK及CTL细胞表面NKG2D的表达并增强其杀伤活性。与其他研究结果[15-16]基本一致。
总之,口腔鳞癌细胞稳定转染并过表达MICA后,生物学特性未发生明显改变,但能显著上调NK与CTL细胞NKG2D表达及杀伤活性。MICA有望成为口腔鳞癌免疫基因治疗的新靶标,值得进一步深入研究。
[1] Li P,Morris DL,Willcox BE,et al.Complex structure of the activating immunoreceptor NKG2D and its MHC classⅠ-like ligand MICA[J].Nat Immunol,2001,2(5):443-451.
[2] Bauer S,Groh V,Wu J,et al.Activation of NK cells and T cells by NKG2D,a receptor for stress-inducible MICA[J].Science,1999, 285(5428):727-729.
[3] Wu J,Song Y,Bakker AB,et al.An activating immunoreceptor complex formed by NKG2D and DAP10[J].Science,1999,285(5428):730-732.
[4] Zhang C,Niu J,Zhang J,et al.Opposing effects of interferonalpha and interferon-gamma on the expression of major histocompatibility complex classⅠchain-related A in tumors[J].Cancer Sci, 2008,99(6):1279-1286.
[5] Madjd Z,Spendlove I,Moss R,et al.Upregulation of MICA on high-grade invasive operable breast carcinoma[J].Cancer Immun, 2007,7:17.
[6] Fuertes MB,Girart MV,Molinero LL,et al.Intracellular retention of the NKG2D ligand MHC classⅠchain-related gene A in human melanomas confers immune privilege and prevents NK cellmediated cytotoxicity[J].J Immunol,2008,180(7):4606-4614.
[7] Xiao P,Xue L,Che LH,et al.Expression and roles of MICA in human osteosarcoma[J].Histopathology,2008,52(5):640-642.
[8] 李超,杨丹,石芳琼,等.MHC-Ⅰ类链相关基因A真核表达载体的构建与稳定转染舌鳞癌细胞的实验研究[J].华西口腔医学杂志,2011,29(4):437-441.
Li Chao,Yang Dan,Shi Fangqiong,et al.Construction of eukaryotic expression vector ofmajor histocompatibility complex classⅠ-related chain A and establishment of its stable transfected Tca-8113-Tb cell line[J].West China JStomatol,2011,29(4):437-441.
[9] Jinushi M,Takehara T,Tatsumi T,et al.Expression and role of MICA and MICB in human hepatocellular carcinomas and their regulation by retinoic acid[J].Int J Cancer,2003,104(3):354-361.
[10] Sutherland CL,Chalupny NJ,Schooley K,et al.UL16-binding proteins,novel MHC classⅠ-related proteins,bind to NKG2D and activate multiple signaling pathways in primary NK cells[J].J Immunol,2002,168(2):671-679.
[11]Jamieson AM,Diefenbach A,McMahon CW,et al.The role of the NKG2D immunoreceptor in immune cell activation and natural killing[J].Immunity,2002,17(1):19-29.
[12]Liu G,Atteridge CL,Wang X,et al.The membrane type matrix metalloproteinase MMP14 mediates constitutive shedding of MHC classⅠchain-related molecule A independent of A disintegrin and metalloproteinases[J].J Immunol,2010,184(7):3346-3350.
[13] Kohga K,Takehara T,Tatsumi T,et al.Sorafenib inhibits the shedding of major histocompatibility complex classⅠ-related chain A on hepatocellular carcinoma cells by down-regulating a disintegrin and metalloproteinase 9[J].Hepatology,2010,51(4):1264-1273.
[14] Kohga K,Takehara T,Tatsumi T,et al.Anticancer chemotherapy inhibits MHC classⅠ-related chain a ectodomain shedding by downregulating ADAM10 expression in hepatocellular carcinoma [J].Cancer Res,2009,69(20):8050-8057.
[15] Diefenbach A,Jensen ER,Jamieson AM,et al.Rae1 and H60 ligands of the NKG2D receptor stimulate tumour immunity[J].Nature,2001,413(6852):165-171.
[16]Friese MA,Platten M,Lutz SZ,et al.MICA/NKG2D-mediated immunogene therapy of experimental gliomas[J].Cancer Res,2003, 63(24):8996-9006.
(本文编辑 杜冰)
Natural killer and cytotoxic T lymphocyte-mediated cytotoxicity enhanced by genetic overexpression of MHC classⅠchain-related protein A in oral squamous cell carcinoma:An experimental study in vivo
Li Chao1,Shi Fangqiong1,Yang Dan1,Wang Jie2,Jian Xinchun1,Jiang Canhua1.(1.Dept.of Oral and Maxillofacial Surgery,Xiangya Hospital,Central-south University,Changsha410078,China;2.Dept.of Immunology,Xiangya Medical School,Central-south University,Changsha410078,China)
ObjectiveTo investigate the effect on natural killer(NK)and cytotoxic T lymphocyte(CTL)-mediated cytotoxicity by genetic overexpression of MHC classⅠchain-related protein A(MICA)in oral squamous cell carcinoma(OSCC).MethodsThe OSCC cells by genetic overexpression of MICA were detected to identify the biological features including cell growth curve,cell cycle distribution,plate clone forming rate and tumorigenicity in nude mice.The expression of natural killer group 2,member D(NKG2D)receptor and the cytotoxicity to target tumor cells of NK92 and CTL cells,which co-cultured with the transfected OSCC cells or the non-transfected or blank vector-transfected controls,were measured by flow cytometry and lactate dehydrogenase(LDH)release assay.Results There was no difference in biological features before and after MICA gene transfection to OSCC cells.Flow cytometry and LDH release assay showed that MICA-overexpressed OSCC cells enhanced the cytotoxicity to target tumor cells and up-regulated the expression of NKG2D on NK92 and CTL(P<0.05).ConclusionMICA may be considered as a promising immunotherapy target of OSCC.
oral; squamous cell carcinoma; MHC classⅠchain-related protein A; cytotoxicity; gene therapy
Q 78
A
10.3969/j.issn.1000-1182.2012.01.008
1000-1182(2012)01-0032-04
2011-02-25;
2011-11-17
国家自然科学基金资助项目(30772437);湖南省科技计划一般基金资助项目(06sk3026,06sk3044)
李超(1985—),女,湖南人,硕士
蒋灿华,Tel:0731-84327475
·基础研究·
- 华西口腔医学杂志的其它文章
- CT测量分析低角型安氏Ⅱ类错成年患者矫治后颞下颌关节的变化

