褪黑素对糖尿病大鼠早期视网膜神经细胞凋亡的影响
李晓艳 张卯年
近年来越来越多的研究表明,糖尿病视网膜病变(diabetic retinopathy,DR)不仅存在视网膜微血管病变,同时也有视网膜神经元的损害[1]。在糖尿病患者[2]和动物模型实验[3]中,都证实在未出现视网膜微血管病理改变之前,已存在视网膜神经组织的损伤及功能改变。因此,DR不仅仅是微血管病变,它还是一种神经变性性疾病,其病理生理改变可能与微血管病变相关[4],甚至是微血管病变的启动因素[5]。视网膜神经细胞凋亡是糖尿病早期最主要的病理表现形式。褪黑素是一种强大的自由基清除剂及亲脂性抗氧化剂,随着研究深入,人们发现褪黑素还具有对抗氧化应激、抗炎症、抗凋亡等作用。在糖尿病发生时,褪黑素对于视网膜神经细胞的凋亡有何影响,有关这方面的研究至今鲜有报道。
1 材料与方法
1.1 材料
1.1.1 实验动物和分组方法 解放军军事医学科学院动物实验中心提供54只健康成年雄性8周龄SD大鼠,体质量230~250 g。54只大鼠随机分为正常对照组、糖尿病组及褪黑素组,各组再按4周、8周、12周3个时间点随机分为3小组,每组各6只大鼠。正常对照组不进行干预;糖尿病组大鼠给予一次性腹腔注射链脲佐菌素(STZ)60 mg·kg-1,以诱导糖尿病大鼠模型;褪黑素组在成功建立糖尿病大鼠模型后每天给予褪黑素10 mg·kg-1·d-1灌胃进行干预。取每只大鼠的左眼眼球,制作石蜡组织病理学切片,进行TUNEL检测。
1.1.2 药品和试剂 STZ及TUNEL检测试剂盒、褪黑素均购自美国Sigma公司。
1.2 实验方法
1.2.1 糖尿病动物模型的建立 除正常对照组外其余大鼠给予一次性腹腔注射STZ 60 mg·kg-1,诱导糖尿病大鼠模型。给药后48 h剪尾法测血糖、尿糖(试纸)。模型建立成功标准:血糖>16.7 mmol· L-1,尿糖(+++)以上。
1.2.2 褪黑素干预方法 STZ诱导糖尿病模型成功的大鼠从模型建立成功即日开始,给予每天褪黑素10 mg·kg-1·d-1灌胃,给药时间定于每天上午10∶00~11∶00,对照组及糖尿病组不做任何干预,各组饲养条件完全相同。
1.2.3 石蜡切片制备 100 g·L-1水合氯醛麻醉大鼠,快速取出左眼眼球,固定于40 g·L-1多聚甲醛固定液中15~20 min后,从角膜缘剪开眼球,小心去除眼前节和部分玻璃体,余下“眼杯”再次固定2 h左右,依次梯度乙醇脱水,二甲苯透明,浸蜡包埋。选择距视盘2 mm处连续切片(厚度4 μm)。
1.2.4 TUNEL法检测视网膜神经细胞凋亡 石蜡切片常规脱腊至水化;体积分数3%H2O2室温处理10 min;Proteinase K 37℃消化10 min;取 TdT和DIG-dUTP各1 μL,加入18 μL标记缓冲液,混匀后滴加至标本片,37℃湿盒内标记2 h;加封闭液室温处理30 min;用抗体稀释液1∶100稀释生物素化抗地高辛抗体,混匀后加至标本片,37℃湿盒内反应30 min;用抗体稀释液1∶100稀释Streptavidin-Biotin Complex染色,混匀后加至标本片,37℃湿盒内反应30 min;二氨基联苯胺显色;Mayer苏木素轻度复染;水洗、脱水、透明、封片,光学显微镜下观察。视网膜神经节细胞凋亡指数计算方法:凋亡指数=凋亡细胞/同一视野细胞总数×100%。每个标本抽取3张切片,每张切片高倍镜下选取5个视野计数,取其均值,作为该标本的凋亡指数。每组中6个标本的均值,作为该组的凋亡指数。
1.3 统计学分析方法 应用SPSS 13.0统计软件进行数据分析。本研究中的计量资料以均数±标准差(s)表示,正常对照组与糖尿病组大鼠各时间点视网膜神经节细胞凋亡指数采用两因素方差分析,进一步的两两比较采用LSD检验法(软件分析中两两比较结果仅提供具体P值),以P<0.05作为差异有统计学意义。
2 结果
2.1 各组大鼠血糖及体质量 正常对照组:8周时SD大鼠体质量230~250 g,毛色光滑、柔顺,禁食12 h后血糖为4.2~6.3 mmol·L-1,尿糖试纸查尿糖为阴性,角膜及晶状体透明。每天饮水量、尿量正常,体质量随鼠龄增加呈上升趋势。随鼠龄增长,血糖无明显变化,其差异无统计学意义(P>0.05)。糖尿病组:糖尿病模型鼠血糖在19.7~35.5 mmol· L-1之间,按4周、8周、12周时间点处死时测血糖,各组血糖均>16.7 mmol·L-1,无血糖自行恢复者。每天饮水量、尿量明显多于同期对照组,随鼠龄增加体质量初期改变不明显或略有增加,之后呈逐渐下降趋势,最终呈现消瘦状态。糖尿病模型鼠随鼠龄增加,部分大鼠晶状体逐渐趋于混浊。褪黑素组:褪黑素组大鼠血糖均>16.7 mmol·L-1,4周、8周、12周时血糖变化均不明显,与糖尿病各组相比血糖值之间差异均无统计学意义(均为P>0.05)。褪黑素组大鼠与同期糖尿病组大鼠相比,“三多一少”的症状略有减轻,表现为每天进食量、进水量较同期糖尿病组略有减少,随干预时间延长,褪黑素组体质量变化不明显,至12周时较同期糖尿病组体质量有所增加(P<0.01)。各组大鼠血糖值及体质量详见表1-表2。
表1 各组各时间点血糖值Table 1 Blood glucose at each time point in each group (n=6,s,c/mmol·L-1)
Note:Compared with control group,*P<0.01;Compared with diabetic group,△P>0.05
Group Blood glucose 4 weeks 8 weeks 12 weeks Control group 4.88±0.51 5.15±0.65 5.28±0.46 Diabetic group 27.75±2.12* 28.85±2.48* 29.40±1.70* Melatonin group 28.40±1.58△ 28.13±2.21△ 28.63±1.55△
2.2 视网膜神经细胞凋亡 正常对照组4周、8周、12周视网膜均未见神经细胞凋亡(图1-图3)。糖尿病组4周视网膜可见散在的凋亡细胞分布于内核层,凋亡细胞的细胞核呈现棕褐色或棕黄色,神经节细胞层及外核层细胞未见明显凋亡细胞,细胞核呈深蓝色(图4),神经节细胞凋亡指数为(0.48± 0.53)%;糖尿病组8周大鼠视网膜内核层凋亡细胞增多、密度增大,神经节细胞层也出现明显染色阳性的凋亡细胞(图5),神经节细胞凋亡指数为(5.66± 2.10)%;糖尿病组12周大鼠视网膜神经节细胞层及内核层可见凋亡细胞明显增多(图6),神经节细胞凋亡指数为(11.83±1.58)%。褪黑素组4周与同期糖尿病组相比细胞凋亡程度无明显差异(图7),视网膜神经节细胞凋亡指数为(0.30±0.74)%;褪黑素组8周及12周神经节细胞层及内核层凋亡细胞数均低于同期糖尿病组(图8-图9),视网膜神经节细胞凋亡指数分别为(1.67±0.54)%和(7.73±0.95)%。正常对照组、糖尿病组、褪黑素组大鼠各时间点间视网膜神经节细胞凋亡指数差异有统计学意义(F=112.896,P=0.000)。进一步两两比较:糖尿病组4周与同期对照组的细胞凋亡指数差异无统计学意义(P=0.405);糖尿病组8周和12周与同期对照组比较,细胞凋亡指数明显增加,差异有统计学意义(均为P=0.000);褪黑素组4周与同期糖尿病组的细胞凋亡指数差异无统计学意义(P= 0.755),褪黑素组8周和12周大鼠与同期糖尿病组比较,视网膜神经节细胞凋亡指数明显下降,差异均有统计学意义(均为P=0.000)。
表2 各组各时间点体质量Table 2 Body mass at each time point in each group (n=6,s,m/g)

表2 各组各时间点体质量Table 2 Body mass at each time point in each group (n=6,s,m/g)
Note:Compared with control group,*P<0.01,△P>0.05;Compared with diabetic group,▲P>0.05,□P<0.05
Group Body mass 4 weeks 8 weeks 12 weeks Control group 269.00±8.39 370.83±9.58 431.83±15.09 Diabetic group 259.50±10.08△ 247.17±8.42* 241.33±5.35* Melatonin group 261.33±6.65▲ 255.67±7.74▲ 253.00±7.56□
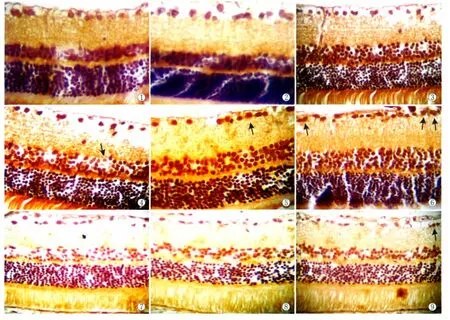
Figure 1 Retinal TUNEL lable at 4 weeks in control group(×400).Figure 2 Retinal TUNEL lable at 8 weeks in control group(×400).Figure 3 Retinal TUNEL lable at 12 weeks in control group(×400).Figure 4 Retinal TUNEL lable at 4 weeks in diabetic group(×400).Figure 5 Retinal TUNEL lable at 8 weeks in diabetic group(×400).Figure 6 Retinal TUNEL lable at 12 weeks in diabetic group(×400).Figure 7 Retinal TUNEL lable at 4 weeks in melatonin treatment group(×400).Figure 8 Retinal TUNEL lable at 8 weeks in melatonin treatment group(× 400).Figure 9 Retinal TUNEL lable at 12 weeks in melatonin treatment group(×400) 图1 正常对照组4周大鼠视网膜TUNEL标记(× 400)。图2 正常对照组8周大鼠视网膜TUNEL标记(×400)。图3 正常对照组12周大鼠视网膜TUNEL标记(×400)。图4 糖尿病组4周大鼠视网膜TUNEL标记(×400)。图5 糖尿病组8周大鼠视网膜TUNEL标记(×400)。图6 糖尿病组12周大鼠视网膜TUNEL标记(×400)。图7 褪黑素组4周大鼠视网膜TUNEL标记(×400)。图8 褪黑素组8周大鼠视网膜TUNEL标记(×400)。图9 褪黑素组12周大鼠视网膜TUNEL标记(×400)
3 讨论
DR虽然是微血管病变,但近年来已有研究表明,在微血管病变之前,患者视功能已发生改变[6],因而早期神经保护非常重要。视网膜神经细胞凋亡是糖尿病早期的主要病理改变,TUNEL法是近年来出现的将分子生物学与形态学相结合的细胞凋亡原位检测技术,主要用于早期凋亡的检测,其敏感性高、特异性较强而且能够定量的显示细胞凋亡的程度,因而是目前广泛应用的细胞凋亡检测方法。实验发现:细胞凋亡主要发生于视网膜神经节细胞层及内核层,细胞凋亡程度随病程延长逐渐加重。Barber等[7]的研究证实7.5个月的糖尿病大鼠视网膜内丛状层及内核层厚度分别比同龄大鼠减少22%和14%,并认为其厚度变薄与神经细胞凋亡有关。
褪黑素是由松果体分泌的一种吲哚胺激素,长期以来,人们认为褪黑素的生物学作用主要是调节昼夜节律、睡眠-觉醒生物节律相位转换,改善睡眠等。随着研究深入,人们发现褪黑素还具有对抗氧化应激、抗炎症、抗凋亡等作用。近年来,有关褪黑素对糖尿病并发症保护作用的研究也越来越多,主要集中于其能够提高全身或局部组织的多种抗氧化酶活性、改善氧化应激水平、减轻氧化损伤等方面[8]。随着对线粒体结构和功能的研究深入,近年来有学者开始认识到:褪黑素具有强大的线粒体保护作用,它能够减轻大鼠缺血-再灌注损伤造成的肝细胞线粒体的肿胀、保护线粒体内膜的完整、减少细胞色素C等介质的释放、减轻caspase-3的激活及凋亡形成[9]。目前褪黑素已开始逐步用于糖尿病视网膜病变的研究中[10],他们发现其能够改善高糖状态下大鼠视网膜或视网膜细胞的脂质过氧化,而对于褪黑素对视网膜神经细胞凋亡的影响,至今鲜有报道。
我们的实验结果显示:随着褪黑素对糖尿病大鼠干预时间的延长,TUNEL法检测的神经细胞凋亡情况较同期糖尿病组减轻,4周时无明显差异,8周及12周时差异显著,12周时糖尿病组的视网膜神经节细胞凋亡指数为(11.83±1.58)%,而褪黑素组明显降低,仅为(7.73±0.95)%,内核层凋亡细胞的密度也明显低于同期糖尿病组,说明褪黑素干预能够减轻糖尿病大鼠视网膜神经细胞的凋亡。
本实验中,褪黑素组与同期糖尿病组相比血糖无明显变化(P>0.05),但“三多一少”的症状较糖尿病组有所减轻,一方面说明褪黑素对糖尿病早期视网膜神经细胞凋亡的影响并非降血糖作用;另一方面提示褪黑素可能在一定程度上改善了糖尿病大鼠的代谢情况。然而,也有研究报道褪黑素可减轻糖尿病鼠胰岛β细胞的氧化损伤,发挥较弱的降血糖作用[11]。
已有报道证实褪黑素是一种高效的氧自由基吞噬剂及抗氧化剂[12],其抗氧化能力明显高于维生素E[13],改善DNA氧化损伤的效应比维生素C和E高60~70倍[14]。褪黑素凭借其强大的抗氧化作用及无毒性和双重溶解性的优越性,目前正作为新型的抗氧化剂用于临床实验的研究中[15],希望随着研究的不断深入,褪黑素能够早日成为早期DR神经保护的新策略。
1 Park JW,Park SJ,Park SH,Kim KY,Chung JW,Chun MH,et al. Up-regulated expression of neuronal nitric oxide synthase in experimental diabetic retina[J].Neurobiol Dis,2006,21(1):43-49.
2 Neckell A.Adaptometry in diabetic patients[J].Oftalmologia,2007,51(3):95-97.
3 Hancock HA,Kraft TW.Oscillatory potential analysis and ERGs of normal and diabetic rats[J].Invest Ophthalmol Vis Sci,2004,45(3):1002-1008.
4 Feit-Leichman RA,Kinouchi R,Takeda M,Fan Z,Mohr S,Kern TS,et al.Vascular damage in a mouse model of diabetic retinopathy:relation to neuronal and glial changes[J].Invest Ophthalmol Vis Sci,2005,46(11):4281-4287.
5 Fletcher EL,Phipps JA,Ward MM,Puthussery T,Wilkinson-Berka JL.Neuronal and glial cell abnormality as predictors of progression of diabetic retinopathy[J].Curr Pharm Des,2007,13 (26):2699-2712.
6 Barber AJ.A new view of diabetic retinopathy:a neurodegenerative disease of the eye[J].Prog Neuropsychopharmacol Biol Psychiatry,2003,27(2):283-290.
7 Barber AJ,Lieth E,Khin SA,Antonetti DA,Buchanan AG,Gardner TW.Neural apoptosis in the retina during experimental and human diabetes.Early onset and effect of insulin[J].J Clin Invest,1998,102(4):783-791.
8 Chang HM,Huang YL,Lan CT,Wu UI,Hu ME,Youn SC.Melatonin preserves superoxide dismutase activity in hypoglossal motoneurons of adult rats following peripheral nerve injury[J].J Pineal Res,2008,44(2):172-180.
9 Kim SH,Lee SM.Cytoprotective effects of melatonin against necrosis and apoptosis induced by ischemia/reperfusion injury in rat liver[J].J Pineal Res,2008,44(2):165-171.
10 Phaneuf S,Leeuwenburgh C.Cytochrome c release from mitochondria in the aging heart:a possible mechanism for apoptosis with age[J].Am J Physiol Regul Integr Comp Physiol,2002,282(2):423-430.
11 Kanter M,Uysal H,Karaca T,Sagmanligil HO.Depression of glucose levels and partial restoration of pancreatic beta-cell damage by melatonin in streptozotocin-induced diabetic rats[J]. Arch Toxicol,2006,80(6):362-369.
12 Rodriguez C,Mayo JC,Sainz RM,Antolín I,Herrera F,Martín V,et al.Regulation of antioxidant enzymes:a significant role for melatonin[J].J Pineal Res,2004,36(1):1-9.
13 Batciogˇlu K,Karagözler AA,Genç M,Celik S.Comparison of the chemopreventive potentials of melatonin and vitamin E plus selenium on 7,12-dimethylbenz[a]anthracene-induced inhibition of mouse liver antioxidant enzymes[J].Eur J Cancer Prev,2002,11(1):57-61.
14 Al-Jassabi S,Khalil AM.Microcystin-induced 8-hydroxydeoxyguanosine in DNA and its reduction by melatonin,vitamin C,and vitamin E in mice[J].Biochemistry(Mosc),2006,71(10): 1115-1119.
15 Korkmaz A,Reiter RJ,Topal T,Manchester LC,Oter S,Tan DX. Melatonin:an established antioxidant worthy of use in clinical trials[J].Mol Med,2009,15(1-2):43-50.

