拟除虫菊酯类农药的酶水解研究进展
徐 斐,赵 洁,曹 慧,于劲松
(上海理工大学食品质量与安全研究所,上海 200093)
目前,拟除虫菊酯类农药已有70多个品种。2003年,该品种农药市场销售总额为13.0亿美元,占所有农药市场份额的19.5%,仅次于销售总额为16.3亿美元的有机磷农药[1]。近年来,有学者预测,随着甲胺磷等5种高毒农药全面退市,国内农用市场对拟除虫菊酯的需求会日益增大,国内卫生用菊酯的需求在未来5~10年也将处于加速增长的黄金时期[2]。
拟除虫菊酯类农药在体内易被氧化酶系统降解,因此,一直认为其具有高效、低毒、易分解、残留少等优点。但近期有研究表明,此类农药具有蓄积毒性等缺点,长期低剂量接触会引起慢性疾病,对哺乳动物具有中等神经毒性、免疫系统毒性、心血管毒性和遗传毒性,有些品种甚至具有致畸、致癌、致突变作用[3-7]。
国内外学者通过探讨作用途径与剂量-效应关系,对拟除虫菊酯类农药的毒性机制进行研究,一致认为该类农药主要对神经细胞膜钠通道起作用。Sogorb等认为,拟除虫菊酯类农药对钠离子通道具有高亲和力,通过改变通道功能会产生毒性作用[8]。拟除虫菊酯通过作用钠离子通道,使通道电压闸门关闭延迟、去极化延长,形成去极化后电位或重复去极化,从而抑制中枢神经细胞膜的γ-氨基丁酸受体,降低氨基丁酸对大脑的抑制性功能,使中枢神经系统兴奋性增高。高浓度拟除虫菊酯易引起神经细胞膜完全去极化,导致神经元持续兴奋,低浓度则易引起间歇性兴奋作用。研究表明只需改变钠离子通道的1%就足以诱导过度兴奋。David等指出,拟除虫菊酯的急性毒性对中枢神经系统的作用表现为药理学控制行为,拟除虫菊酯的敏感性在通过钠通道亚型时表现出异质性,但是其分布与功能目前还有待深入研究[9]。
正因为拟除虫菊酯具有以上毒性特征,其降解途径和机制引起国内外学者的广泛关注。氧化和水解是拟除虫菊酯类农药主要降解途径,其中最有效的是羧酸酯酶催化拟除虫菊酯酯键的水解,其降解效果与酶的来源、酶的形式及水解反应的温度、pH等因素密切相关。本文将结合酶催化拟除虫菊酯类农药的水解机制,介绍拟除虫菊酯类农药酶水解的研究进展,包括酶的选取、纯化、固定化以及水解反应条件的优化,并对其发展趋势进行展望。
1 拟除虫菊酯类农药的酶水解机制
拟除虫菊酯类农药品种繁多,结构各异,但目前使用较多品种如甲氰菊酯、杀灭菊酯等,其共同特征均含有酯键。生物体内所含的酶特别是酯酶,在多数情况下属于关键酶,具有很强的专一性,水解与酯有关的物质,使酯键断裂,从而降解含酯键的农药。拟除虫菊酯的酶水解机制见图1。
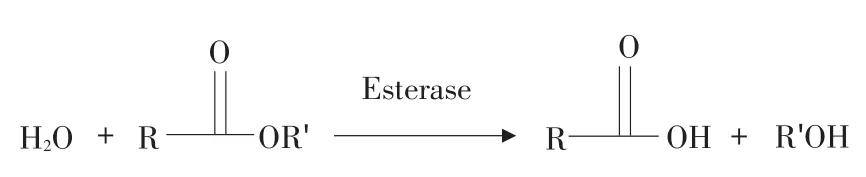
图1 酯酶水解拟除虫菊酯类农药的通式Fig.1 Fomula for the course of esterase hydrolyzing pyrethroids
目前,这方面的研究主要集中在:通过剖析酶催化农药水解获得产物,进一步探讨酶催化水解反应机理。虞云龙等以杀灭菊酯(见图2)为研究对象,用GC-MS方法测定其降解产物以推断拟除虫菊酯的降解机理,发现杀灭菊酯经酶降解12 h后得到C和D两种产物,产物结构如图3所示,但24 h后不再检测到C和D,说明这两种产物是杀灭菊酯降解的中间体[10]。李时银等以氰戊菊酯为研究对象,采用紫外可见分光光度计对氰戊菊酯及其水解产物进行波长扫描,发现在277 nm处吸收强度显示出明显差异,产生一定减色效应,因此,推断酯键断裂后产生的产物中苯环上电子的共轭能力小于氰戊菊酯原药[11]。Mandar等运用GC-MS分析丙烯菊酯降解机理时发现,该农药降解48 h后主要生成化合物1[2-Ethyl-1,3-dimethyl cyclopent-2-ene-carboxylic acid]、化合物2[Cyclopropanecarboxylic acid 2, 2-dimethyl-3-(2-methyl-1-propenyl)]和化合物 3[2-Propanal(1,1-dimethyl ethyl)-methyl]等,72 h后化合物3消失[12]。综上所述,采用仪器分析法已基本确定酯酶催化酯键断裂是拟除虫菊酯农药的酶水解机制,但在水解产物及中间产物问题上目前仍无统一定论。
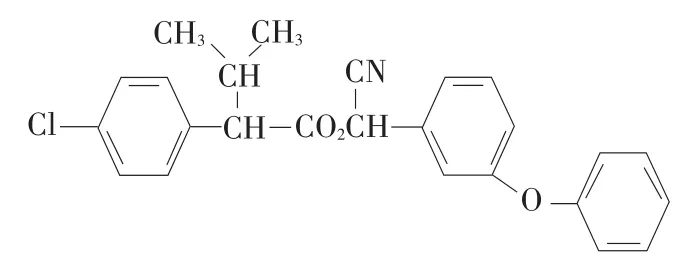
图2 杀灭菊酯结构式Fig.2 Structural formula of fenvalerate
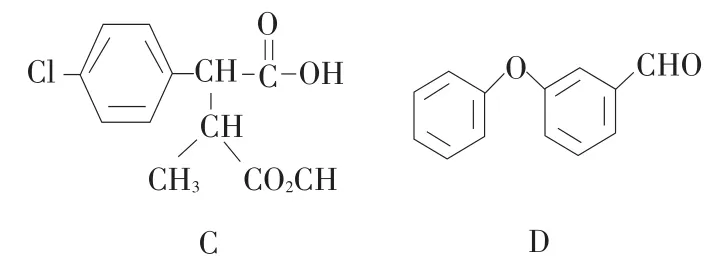
图3 化合物C和D的分子结构Fig.3 Molecular structure of compounds C and D
采用仪器分析降解产物的分子结构无法对酶催化降解机理进行深入理论性探讨。近年来,有学者开始采用量子化学法研究拟除虫菊酯类农药的降解机理,但仍处于起步阶段。2007年褚嘉杰采用量子化学的方法,用计算机模拟化学反应过程,研究拟除虫菊酯的降解反应机理[13]。运用密度泛函理论,在3LYP/6-31G*水平上建立计算方法,以氰戊菊酯为研究对象,多方面考察反应过程中旧键断裂和新键形成的细节,发现降解过程中,氰戊菊酯的C(1)=O(2)羰键逐渐变弱,C(1)=O(31)之间形成弱单键,形成过渡态;随之,过渡态的C(1)-O(3)键断裂,同时C(1)-O(31)之间成键,完成双分子亲核取代反应,得到醇羟基和羧酸产物。
2 拟除虫菊酯类农药降解酶的研究
2.1 降解酶的选取
由于酶在拟除虫菊酯类农药的降解过程中起关键作用,研究一直试图从微生物菌株、昆虫、动物及人体内寻求高效酯酶,从而对拟除虫菊酯进行有效降解。
2.1.1 来源于菌株提取的降解酶
氯菊酯酶是90年代初研究较多的拟除虫菊酯降解酶,主要从蜡状芽孢杆菌中提取获得。采用该酶在最优条件下对2 mL 26 μmol·L-1氯菊酯进行降解,降解速率较低,仅为0.352~0.235 nmol·min-1·mg-1·protein,效果不佳。继而发现从某些菌株体内分离出来的粗酶液可用于降解拟除虫菊酯。洪永聪等发现蜡状芽孢杆菌TR2粗酶液对氯氰菊酯的降解率较高,在最佳条件下作用20 min,降解率可达84.6%[14]。解开治等对一株能高效降解拟除虫菊酯的恶臭假单胞菌XP12进行深入研究,发现从中提取出来的粗酶液在pH 6.5~8.0时,对高效氯氰菊酯、溴氰菊酯和高效氯氟氰菊酯的降解率为70%,在叶类蔬菜上试验其对拟除虫菊酯的降解效果,降解率可达80%以上[15]。
目前国内已有较多关于从微生物菌株中提取拟除虫菊酯降解酶的研究报道。多数是对降解酶的分离提取、物理化学属性等进行一些基础性研究,对于降解酶在土壤、污水处理或果蔬农残降解等方面的具体应用却较少提及,有待进一步研究。
2.1.2 来源于昆虫体内提取的降解酶
昆虫体内对拟除虫菊酯的代谢解毒作用是其产生抗性的主要原因,昆虫体内含有多种羧酸酯酶,因此,在研究从菌株中分离降解酶的同时,有学者从抗性昆虫入手,研究昆虫体内某些对拟除虫菊酯有催化降解作用的酯酶。兰亦全等研究甜菜夜蛾对氰戊菊酯与顺式氯氰菊酯的抗性机理,发现羧酸酯酶活性提高是甜菜夜蛾对菊酯产生抗性的重要原因之一,甜菜夜蛾抗溴氰菊酯品系对溴氰菊酯的降解速率是敏感品系的17倍[16]。Peter等从蜱幼虫的组织匀浆中提取并纯化出一种羧酸酯酶,能够水解反式氯菊酯[17]。Lien等发现从蟑螂、家蝇、马利筋虫体内提取出来的酯酶能够水解苄呋菊脂和胺菊酯的正反异构体,但不能水解右旋反式炔丙菊酯,在水解过程中发现对反式异构体的降解比顺式异构体更快[18]。因此可将抗性昆虫产生的高活性酶制成药剂,用于治疗人体拟除虫菊酯类农药中毒。
2.1.3 来源于动物与人体内提取的降解酶
从菌体、昆虫体内提取新酶源对拟除虫菊酯进行降解取得一定效果。然而动物与昆虫相比,对拟除虫菊酯的敏感度更低,这是由于动物的代谢速度高、体温较高、以及离子通道靶点的敏感性较低所致。不少学者致力于研究动物体内拟除虫菊酯的代谢途径,发现动物体内含有多种羧酸酯酶,一般以肝脏、血清和脑组织中的酯酶活性较高,这些羧酸酯酶对拟除虫菊酯类农药的降解起重要作用。有试验证明小鼠肝脏中的菊酯水解酶活力要高于昆虫[18]。张慧君等发现鸡肝酯酶是一种广谱性酯酶,酶活力与乙酰胆碱酯酶相近,是一种能够催化拟除虫菊酯水解的B酯酶[19-20]。Syed等发现小鼠脑组织匀浆中含有一种或多种羧酸酯酶,能够水解反式菊酯[21]。该酶对反式菊酯的亲和力比小鼠肝脏内羧酸酯酶的亲和力高,但最大水解速度却低于后者。氰戊菊酯与鲫鱼肝胰组织中的磷酸单酯水解酶活性具有剂量-效应和时间-效应关系,因此该酶还可用作鱼体受农药污染的标记物[22]。
人体对拟除虫菊酯的代谢途径与哺乳动物相似,人体肝脏中含有羧酸酯酶hCE-1和hCE-2,在水解I型和II型除虫菊酯时具有很强的立体选择性,例如这两种酯酶水解氯菊酯和氯氰菊酯的反式异构体比顺式异构体更快。hCE-2虽能水解反式氯菊酯,但不能水解溴氰菊酯和苄呋菊脂[23]。因此特异性强的酯酶不仅是水解拟除虫菊酯的关键酶,还可以用来作为某些特定菊酯的靶标酶。
2.2 降解酶的纯化与固定化
降解酶的来源是影响农药降解率的重要因素,研究发现,酶的纯度及活性对农药降解率有一定作用。
针对粗酶中所含杂质会对水解反应造成影响,对降解酶进行分离纯化,以提高降解速率。林淦等从恶臭假单胞菌CP-1中提取粗酶,以0.005 mol·L-1Na2HPO4-NaH2PO4溶液为洗脱液,经阴阳离子交换层析两步纯化酯酶,结果表明,降解活力由最初的15.0 U·mg-1分别提高到55.4和85.0 U·mg-1,且回收率达到90%,达到预期目的[24]。
采用固定化技术提高游离酶稳定性。酶的固定化是将游离酶固定于某一载体上,以提高酶的稳定性,从而增强降解效果。但固定后酶活性会部分降低。有学者采用凝胶或离子交换树脂等作为拟除虫菊酯降解酶的固定化材料,已取得较好效果[25-27]。纳米材料应用于其他农药降解酶的固定化已有多篇报道,但用于拟除虫菊酯类农药降解酶固定化的文献尚未见到。纳米材料在酶的固定化应用上已成为当今研究热点,探索用于拟除虫菊酯降解酶的固定化具有一定的前景,也是提高酶降解率的有效方法之一。
3 酶催化拟除虫菊酯水解的条件优化研究
酶催化拟除虫菊酯水解过程中,控制好水解反应的条件如反应温度、pH等因素也是提高降解率的重要保证。国内外学者对酶参与水解拟除虫菊酯的反应条件展开一系列研究。Maloney等从蜡状芽孢杆菌提取氯菊酯酶用于降解拟除虫菊酯,研究发现在反应温度37℃、pH 7.0条件下活性最强,但是降解拟除虫菊酯的速率较低,水解效果不明显[28]。虞云龙等从YFI1菌株提取出粗酶液,经研究发现其在30~34℃、pH 6.0~9.5范围内对杀灭菊酯和氯菊酯均具有降解活性。在最佳反应条件32.5℃、pH 8.0时对杀灭菊酯显示最大的降解活性,最大降解速率为211.8 nmol·min-1·mg-1·protein,米氏常数为41.4 nmol·mL-1;对氯菊酯的降解在32.5℃、pH 9.0时显示最大活性,最大降解速率为20.8 nmol·min-1·mg-1·protein,米氏常数为 5.2 nmol·mL-1,与其他反应条件相比显示出较好的降解效果[29-30]。由于酯键在碱性环境下更容易发生水解反应,多数拟除虫菊酯酶水解应控制在偏碱性条件下进行,但应当同时考虑降解酶的适应条件。
对于降解菌中提取的降解酶,除考虑以上因素外,还应当考虑底物浓度、菌量以及有机、无机物质等影响。刘丽花等从海洋沉积物中筛选到一株能够高产降解溴氰菊酯降解酶的菌株,并发现该菌株在以可溶性淀粉为碳源、蛋白胨与酵母浸膏质量比2∶1为氮源、pH 7.5、温度30℃、培养时间2 d、接种量3%的最适产酶条件下,对15 μmol·L-1溴氰菊酯降解率达54.6%[31]。Grant等从使用拟除虫菊酯的菜园和农田土壤的混合土样中分离出荧光假单胞菌和普城沙雷菌,用这两种菌株处理含有氯氰菊酯的绵羊蘸洗液,并在25℃、80r·min-1条件下培养14d,结果发现其对250mg·L-1氯氰菊酯去除率约66.7%[32-33]。水解条件的优化研究对菜园、农田土壤中的拟除虫菊酯降解具有重要意义。
4 小结与展望
酶催化拟除虫菊酯类农药水解能够有效地降解农药,相比其他降解方法如光降解、氧化降解,酶水解具有高效专一、安全、成本低等优点,具有较好的发展前景。在水解过程中,酶起关键作用,因此对催化拟除虫菊酯类农药水解的酶进行深入研究,探寻酶的结构与活力之间的关系,并对酶进行生物改造,这不仅有助于提高酶的降解活力,提高哺乳动物或人体内对拟除虫菊酯类农药的降解速率,更有助于今后开发更有效、安全、易降解的菊酯类农药。目前对参与拟除虫菊酯类农药水解的酶(主要是羧酸酯酶)的研究,多数是在对菌体和昆虫体内提取出的酶的生化特性进行描述,而哺乳动物体内提取酶的研究较少,对羧酸酯酶的基础性研究也有待加强,这将成为未来要深入研究的目标之一。
[1] 张一宾.世界拟除虫菊酯类杀虫剂的发展概况[J].中国农药,2005(4):21-23.
[2] 张为农.部分拟除虫菊酯杀虫剂品种市场行情分析[J].中国农药,2008(3):49-50.
[3] Ai-Makkawy H K,Madbouly M D.Persistence and accumulation of some organic insecticides in Nile water and fish[J].Resources,Conservation and Recycling,1999,27(1/2):105-115.
[4] Mohnssen H M.Chronic sequelae and irreversible injuries following acute pyrethroid intoxication[J].Toxicology Letters,1999,107(1/3):161-176.
[5] Shukla Y,Arora A,Singh A.Tumourigenic studies on deltamethrin in Swiss albino mice[J].Toxicology,2001,163(1):1-9.
[6] Cerda E.Action potential and underlying ionic currents by the pyrethroid insecticide delta methrin[J].Archives of Medical Research,2002,33(5):448-454.
[7] 吴鹏,秦智伟,周秀艳,等.蔬菜农药残留研究进展[J].东北农业大学学报,2011,42(1):138-144.
[8] Sogorb M A,Vilanova E.Enzymes involved in the detoxification of organophosphorus,carbamate and pyrethroid insecticides through hydrolysis[J].Toxicology Letters,2002,128(1-3):215-228.
[9] David E R,Jeffrey R F.A reassessment of the neurotoxicity of pyrethroid insecticides[J].Pharmacology&Therapeutics,2006,111(1):174-193.
[10] 虞云龙,陈鹤鑫,樊德方,等.Alcaligenes sp.YF1菌对杀灭菊酯的降解机理[J].环境污染与防治,1998,20(6):5-7.
[11] 李时银,张晓昆,冯建昉,等.氰戊菊酯及代谢物对土壤过氧化氢酶活性的影响[J].中国环境科学,2002,22(2):154-157.
[12] Mandar P,Manish J,Dileep D.Biodegradation of allethrin,a pyrethroid insecticide by an Acidomonas sp.[J].Biotechnology Letters,2005,27:1909-1913.
[13] 褚嘉杰.拟除虫菊酯类农药降解机理的理论研究[D].青岛:中国海洋大学,2007:25-27.
[14] 洪永聪,辛伟,崔德杰,等.蜡状芽孢杆菌菌株TR2的氯氰菊酯降解酶特性[J].青岛农业大学学报:自然科学版,2007,24(3):185-188.
[15] 解开治,徐培智,陈建生,等.恶臭假单胞菌XP12对拟除虫菊酯类农药的酶促降解特性及其应用研究[J].广东农业科学,2009(12):156-160.
[16] 兰亦全,赵士熙.甜菜夜蛾对氰戊菊酯和顺式氯氰菊酯的抗性机理[J].应用生态学报,2010,21(1):203-208.
[17] Peter W R,Patricia A D.Carboxylesterases from Boophilus microplus hydrolyze trans-permethrin[J].Pesticide Biochemistry and Physiology,1983,20(2):133-140.
[18] Lien T J,John E C.Insect pyrethroid-hydrolyzing esterases[J].Pesticide Biochemistry and Physiology,1974,4(4):465-472.
[19] 张慧君,许学勤,徐斐,等.用于农药残留快速检测的两种酶的比较[J].分析化学,2004,32(11):1421-1425.
[20] 李思超,徐斐,赵洁,等.鸡肝酯酶快速检测氰戊菊酯农药的试验研究[J].东北农业大学学报,2011,42(2):10-15.
[21] Syed M G,David M S.Hydrolysis of pyrethroid insecticides by soluble mouse brain esterases[J].Toxicology and Applied Pharmacology,1984,74(3):390-396.
[22] 袁红霞,秦粉菊,徐世清.氰戊菊酯对鲫鱼肝胰脏和鳃组织免疫相关酶活性的影响[J].湖北农业科学,2010,49(2):412-415.
[23] Nishi K,Huang H Z,Kamita S G,et al.Characterization of pyrethroid hydrolysis by the human liver carboxylesterases hCE-1 and hCE-2[J].Archives of Biochemistry and Biophysics,2006,445(1):115-123.
[24] 林淦,黄升谋.甲氰菊酯降解酶的部分纯化及其性质研究[J].河南农业科学,2005(12):47-50.
[25] 虞云龙,盛国英,傅家谟.农药降解酶的固定化及其降解特性[J].应用与环境生物学报,1999,5(l):166-169.
[26] 虞云龙,史锋,樊德方.一种固定化酶对氰戊菊酯的降解特性[J].农药学学报,1999,1(1):74-77.
[27] 林淦,韩萍,吴传兵.固定化农药降解酶对受污染水体的净化作用[J].安徽农业科学,2006,34(17):4371-4372.
[28] Maloney S E,Maule A,Smith A R W.Purification and preliminary characterization of permethrinase from a pyrethroid-transforming strain of Bacillus cereus[J].Applied and Environmental Microbiology,1993,59:2007-2013.
[29] 虞云龙,盛国英,傅家馍,等.杀灭菊酯的微生物降解及酶促降解[J].环境科学,1997,18(1):5-8.
[30] 虞云龙,陈鹤鑫,樊德方,等.氯菊酯的酶促降解[J].环境污染与防治,1997,19(4):8-9.
[31] 刘丽花,王兆守,陈小兰,等.溴氰菊酯降解菌Pseudomonas sp.P1-1-B3产酶条件的优化[J].厦门大学学报:自然科学版,2010,49(1):71-76.
[32] Grant R J,Daniell T J,Betts W B.Isolation and identification of synthetic pyrethroid-degrading bacteria[J].Journal of Applied Microbiology,2002,92(3):534-540.
[33] Grant R J,Betts W B.Biodegradation of the synthetic pyrethroid cypermethrin in used sheep dip[J].Letters in Applied Microbiology,2003,36(3):173-176.

