百合属‘普瑞头’的组织培养和快速繁殖
张彦妮,李文英
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
百合为百合科(Liliaceae)百合属(Lilium),有很高的观赏性,是高档切花之一[1]。百合‘普瑞头’(L.asitichybridscv. Prato)为亚洲杂种系百合[2],株高平均约为83.3 cm,花朵直径平均约为15.6 cm,碗型,橘红色,无香味,抗寒性高,能在东北地区露地越冬[3]。由于抗寒性强,‘普瑞头’是培育抗寒百合新品种的重要杂交亲本,所以,对其的研究主要集中在花粉生活力的测定、远缘杂交以及百合远缘杂交的胚囊和胚胎发育及胚拯救等方面[4-8]。目前,对百合的组织培养和扩繁也有研究,但相对较少[9-10]。本研究以亚洲百合品种‘普瑞头’鳞茎为材料,设置不同激素种类和浓度,以期完善‘普瑞头’鳞片组织培养再生体系,为其生产扩繁、脱毒复壮、基因转化等工作奠定基础。
1 材料与方法
1.1材料 亚洲百合品种‘普瑞头’的鳞茎取自东北林业大学园林学院花卉研究所。
1.2方法
1.2.1无菌材料的获得 洗去‘普瑞头’鳞茎表面的泥土,除去有病斑和机械损伤的鳞片,取中外层无病斑的鳞片,放入三角瓶中,加入适量洗衣粉,然后放在自来水下冲洗3~4 h,在超净工作台上用无菌水冲洗3次,再用75%酒精消毒20~30 s后用无菌水冲洗3遍,放入0.1%升汞溶液中,滴入2~3滴吐温消毒8 min,期间不断摇晃,再用无菌水冲洗5~6次。用无菌滤纸吸干鳞片表面的水分。把鳞片切成0.5 cm×0.5 cm左右的小块接种在MS培养基附加不同浓度6-BA(0、0.01、0.05、0.10、0.50、1.00、1.50 mg·L-1)和NAA(0、0.01、0.05、0.10、0.50、1.00、1.50 mg·L-1)的培养基中。采用鳞片内侧向上平放的接种方式,每个处理3个重复,定期统计不定芽的分化情况。
1.2.2再生小鳞茎鳞片诱导 待再生小植株上的小鳞茎直径超过0.5 cm时,取中外层,接种在MS培养基附加不同浓度6-BA(0、0.05、0.10、0.50、1.00、2.00 mg·L-1)和NAA(0、0.05、0.50、1.00、1.50 mg·L-1)的培养基中,每个处理3个重复,一个月后观察记录诱导分化结果。
1.2.3生根壮苗 待组培苗约2 cm高时,切取长势好、无根的苗,接种到生根培养基(MS+0.05 mg·L-1IBA、MS+1.00 mg·L-1IBA、MS、1/2 MS+0.05 mg·L-1IBA、1/2 MS+0.50 mg·L-1IBA、1/2 MS+1.00 mg·L-1IBA、1/2 MS+2.00 mg·L-1IBA、1/2 MS)上,一个月后统计生根率、平均生根数。
1.2.4炼苗移栽 将生根后的组培苗进行炼苗移栽,先打开三角瓶口的封口膜,经过1 d后,取出并洗净根部附着的培养基,移栽到蛭石中,15 d后移栽到沙和土壤混合壤土中,30 d后统计成活率。
1.3培养条件 所有培养基都采用固体MS培养基,培养基中蔗糖30 g·L-1、琼脂8 g·L-1,pH值为5.8~6.0。1/2 MS培养基中,大量元素减半,pH值不变。培养温度为(25±2) ℃,日光灯光源,光照强度2 000~3 000 lx,光照时间10~12 h·d-1。
1.4数据分析 不同激素、培养基对组培效果影响用Statistica 7.0中的多因素方差(Factorial ANOVA)分析进行。
2 结果与分析
2.1‘普瑞头’鳞片在不同激素组合培养基上的分化效果 将鳞片消毒后接入到培养基上,结果发现,刚接入的外植体为乳白色,15 d左右基部略有膨大,20 d 左右开始出现淡黄绿色愈伤组织,主要集中在鳞片外侧靠近培养基处。鳞片的下部容易形成愈伤,上部和中部大多没有明显的愈伤组织生成。外植体多直接形成小鳞茎状突起,然后分化成不定芽(图1)。结果表明(表1),培养基中只加NAA时,在浓度为0.05 mg·L-1时分化率最高(55.56%)。培养基中只加6-BA,浓度为1.5 mg·L-1时分化率最高(66.67%),但平均分化芽数少于浓度为1.0 mg·L-1时的分化率。当6-BA浓度为1.5 mg·L-1时,不定芽呈丛状生长,生长较弱,有畸形芽出现。同时添加6-BA和NAA,能明显促进不定芽的生成,诱导率高于单独添加6-BA和NAA。在培养基MS+0.5 mg·L-16-BA+0.1 mg·L-1NAA上分化率最高(85.00%),且平均每块分化的芽数最多(3.60个)。所以,诱导小鳞茎的最适宜培养基为MS+0.5 mg·L-16-BA+0.1 mg·L-1NAA。方差分析结果(表2)表明,不同浓度6-BA和NAA组合对外植体分化率和平均芽个数影响显著。
2.2不同激素浓度对再生小鳞茎鳞片分化的影响 再生小鳞茎鳞片的再生能力较强,20 d左右即可分化出小苗,诱导率均达到100%。结果表明(表3),单独添加6-BA时,浓度在1.0 mg·L-1时不定芽分化数最多(4.67个),植株长势良好(图2);单独添加NAA时,随着NAA的浓度增大,平均生成的根数增多,但是诱导的芽数减少且出现畸形根,NAA的浓度为0.5 mg·L-1时平均生成的芽数最多(3.58个),且小苗生长健壮;同时添加6-BA和NAA时,6-BA浓度为1.0 mg·L-1时,诱导的苗长势不佳,黄色且畸形,6-BA浓度为0.5 mg·L-1、NAA的浓度为0.05~0.50 mg·L-1时,诱导率和产生的芽数都很高,随着NAA浓度增大生成的根数增多,但当NAA的浓度达到1.00 mg·L-1时生成的芽数较少且诱导的苗长势不佳,根出现畸形;既能获得数量很多的不定芽又能直接用于生根移栽的最适培养基为MS+0.5 mg·L-1NAA,诱导不定芽的最适培养基为MS+1.0 mg·L-16-BA。方差分析结果(表4)表明,6-BA和NAA浓度对再生小鳞茎鳞片的芽个数、生根率、生根系数影响显著。

图1 鳞片上诱导出的愈伤组织和丛生芽Fig.1 Callus and adventitious buds induced from bulbscale
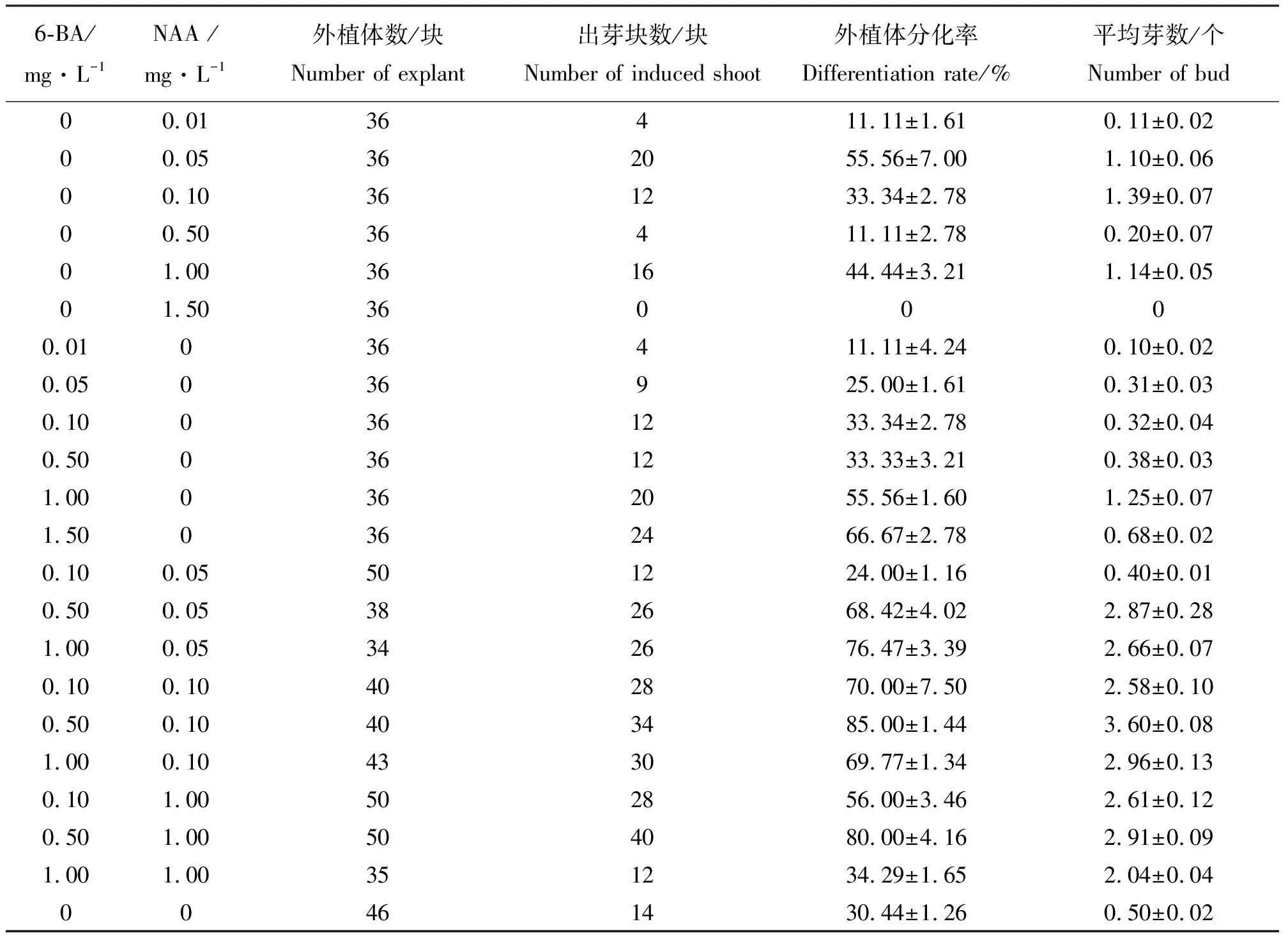
表1 不同浓度6-BA和NAA组合对‘普瑞头’鳞片分化能力的影响
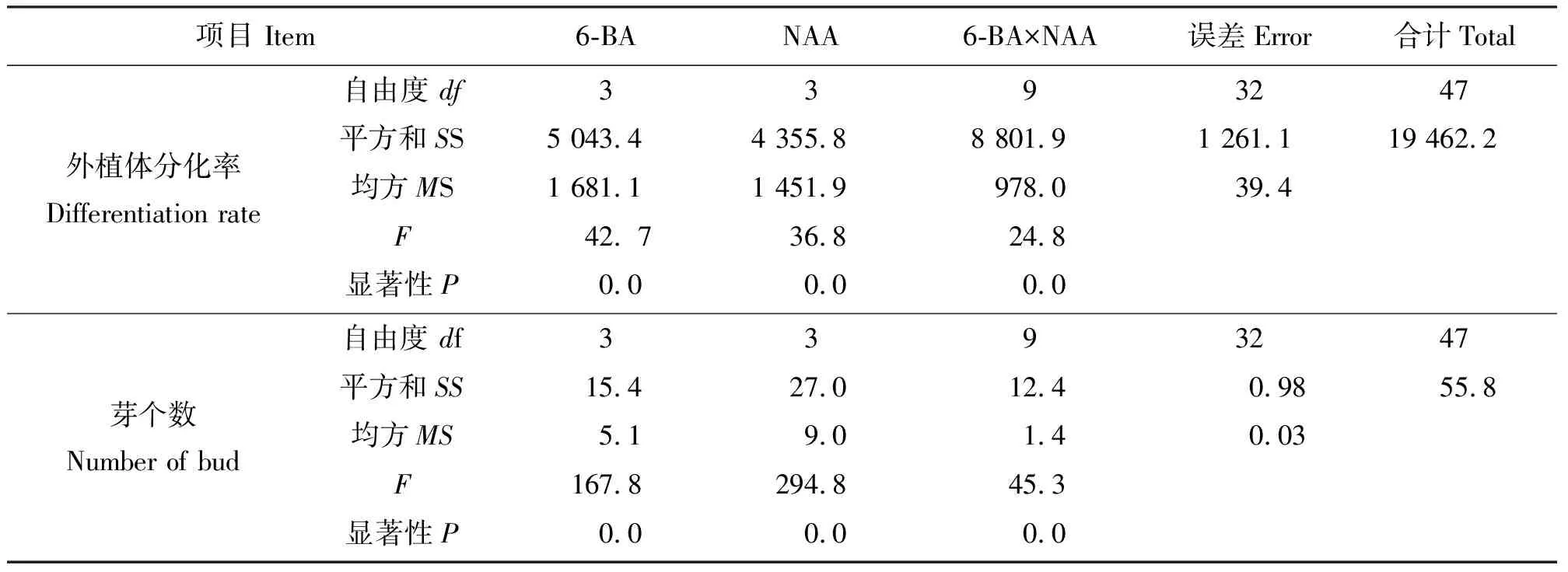
表2 6-BA和NAA浓度对‘普瑞头’鳞片分化能力影响的方差分析结果

图2 生长良好的丛生芽Fig.2 Cluster-shoots growing well
2.3生根培养 当丛生芽长为2 cm左右时,把丛生芽分成单株,接种到生根培养基中诱导生根,7 d后接种到含有IBA的培养基上的多数单株都有根生成,30 d后,观察记录根的生长状况。结果表明(表5),1/2 MS培养基对于生根的影响好于MS培养基。IBA能促进生根,随着IBA浓度升高,生根率及平均根数都明显增加。但IBA浓度达到0.5 mg·L-1时苗的叶尖就出现白化现象,浓度超过1.0mg·L-1时,叶尖白化且苗的生长状况不佳,萎蔫且根畸形。所以,最适的生根培养基为1/2 MS + 0.5 mg·L-1IBA(图3)。方差分析结果(表6)表明,基本培养基、IBA浓度对生根率和生根系数影响显著。
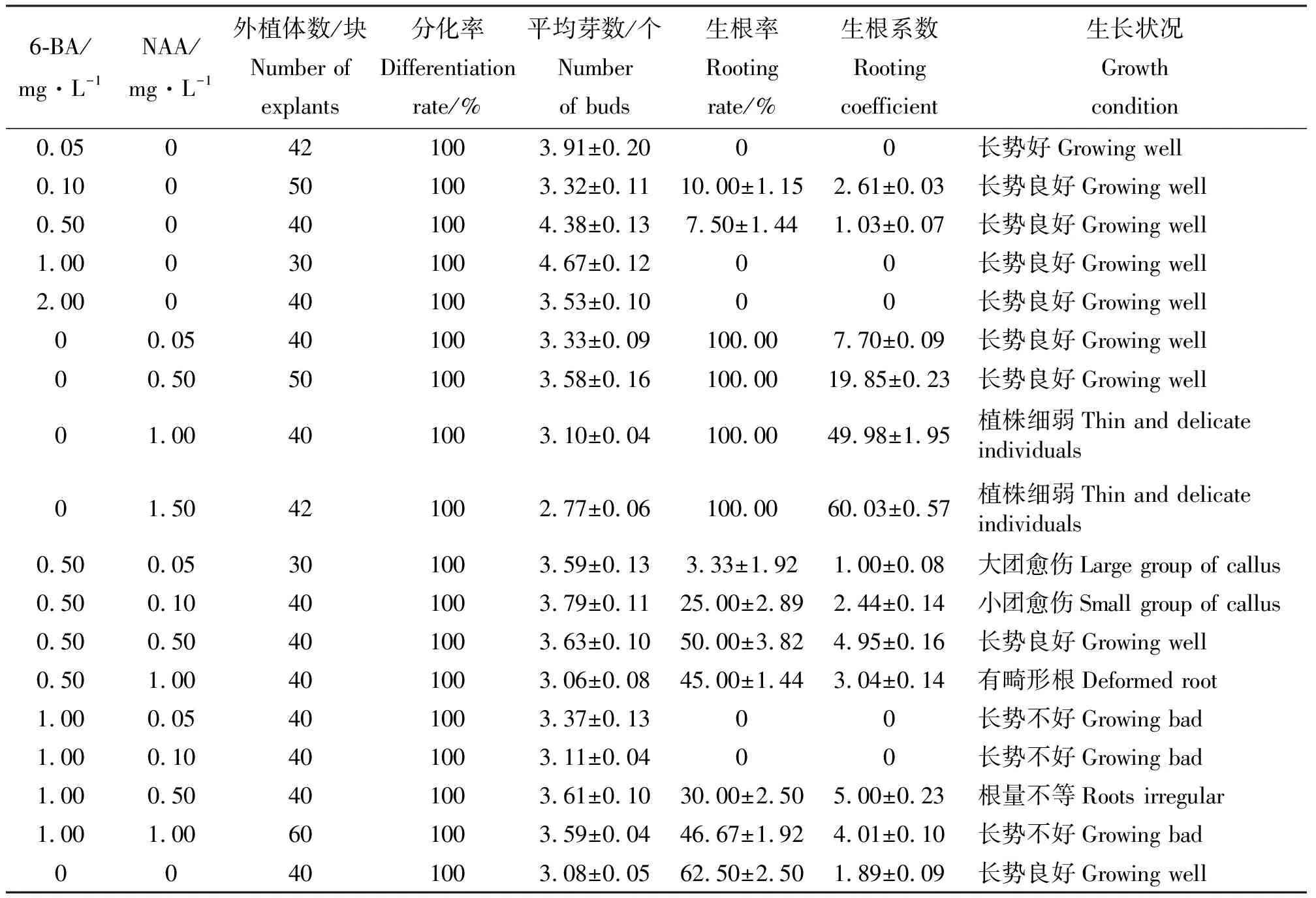
表3 不同激素浓度对再生小鳞茎鳞片分化的影响
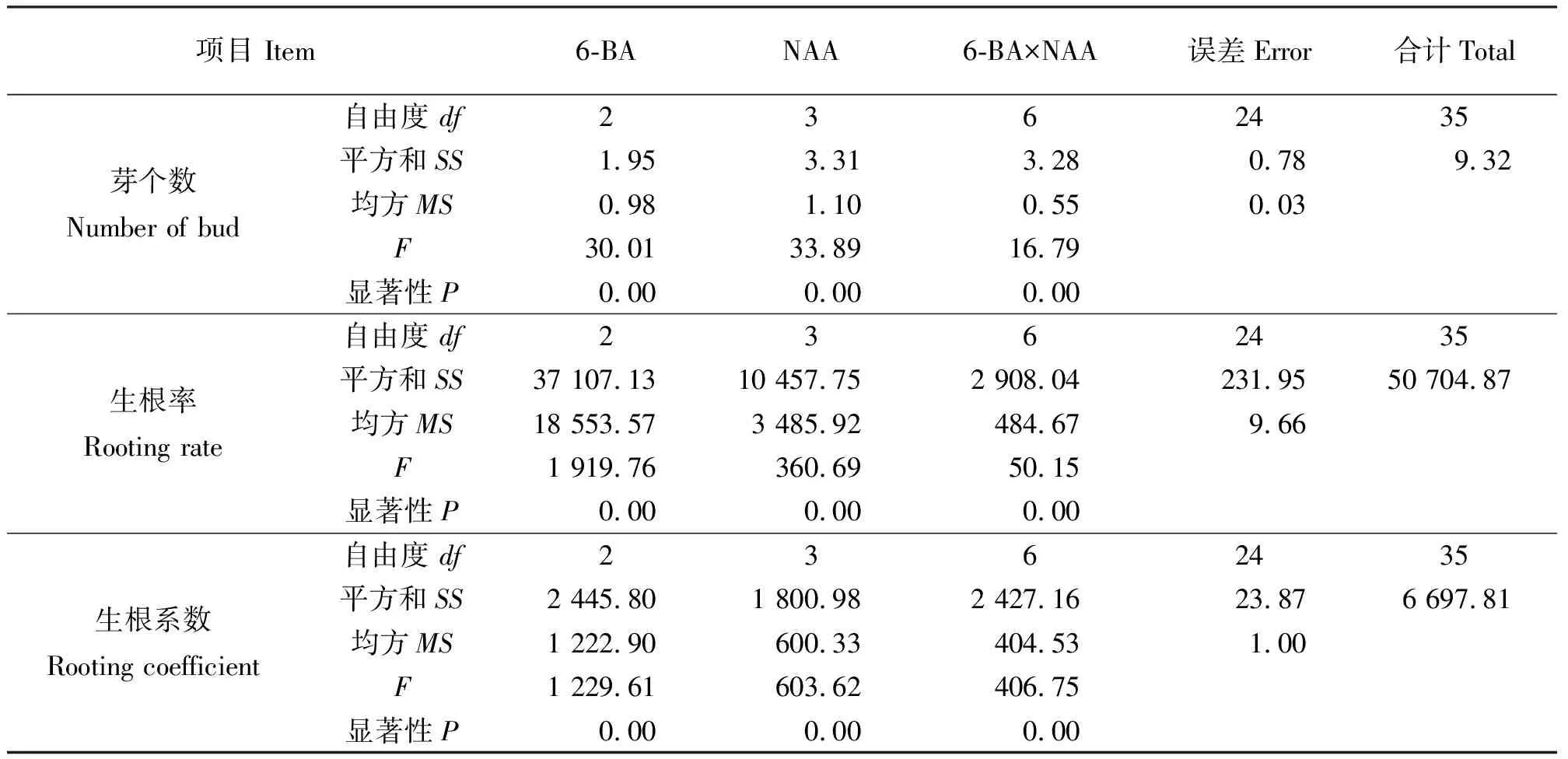
表4 6-BA和NAA浓度对再生小鳞茎鳞片分化影响的方差分析结果
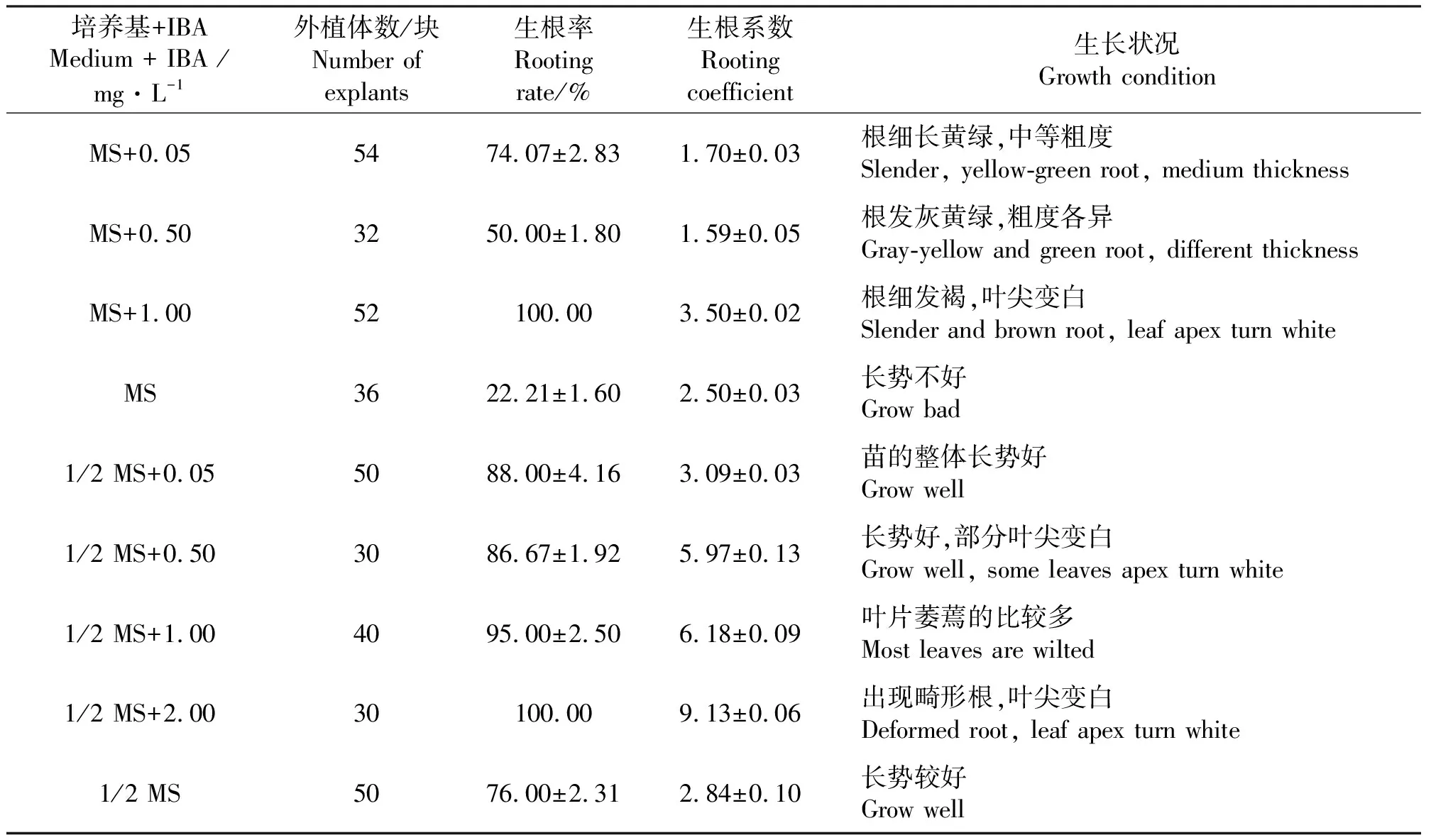
表5 基本培养基和IBA浓度对丛生芽生根的影响
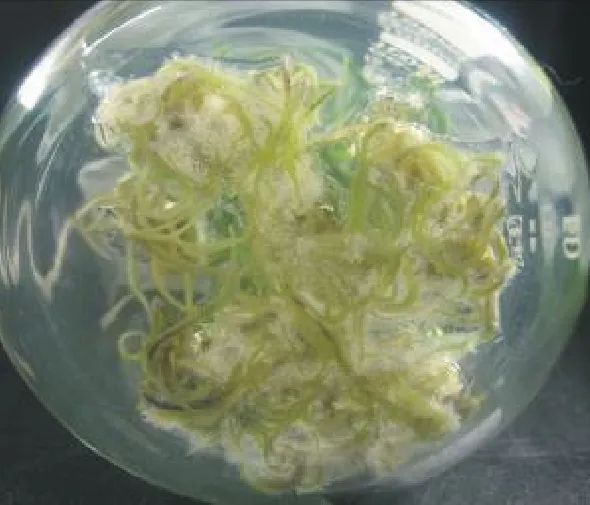
图3 丛生芽的生根
2.4组培苗的驯化及移栽 打开三角瓶的封口,1 d后小心取出生根的无菌苗,洗净其根部的培养基,移栽到蛭石中,遮阴处理,注意通风保湿,15 d后把无菌苗从蛭石中取出放入壤土(壤土和沙的比例为2∶1)中,无菌苗的成活率超过85.0%,且移栽后生长状况良好(图4)。

图4 移栽成活的苗Fig.4 Survival seedlings after transplanting
3 讨论与结论
百合不同部位的鳞片不定芽的分化能力不同,外层、中部鳞片的分化能力大于内部鳞片[11-12],所以本研究直接采用外中层鳞片作为外植体进行不定芽诱导。外源生长素和细胞分裂素是细胞离体培养所必需的激素,合适的浓度和种类的适宜配比不但可以诱导细胞分裂和生长,而且能控制细胞分化和形态建成[13]。不同激素组合对百合鳞片诱导分化不定芽的能力存在差异[14],培养基中只加6-BA,浓度为1.0 mg·L-1时的分化率高且平均分化芽数最多。这与周蕴薇等[10]的研究结果相同,但是分化率及分化系数低于其结果,这可能是因为升汞比次氯酸钠对鳞片的毒害作用大。培养基中6-BA与NAA的适宜搭配,可使芽的诱导和增殖达到最高比率。但是6-BA与NAA的比例不能过高,否则会导致诱导率极低[15]。6-BA质量浓度过高会使部分鳞片产生不定根,抑制不定芽的生成,植株细弱,不利于再生植株的正常发育[16-17]。本研究中当NAA和6-BA的浓度超过1.5 mg·L-1时不定芽的诱导率比较低且出现畸形芽,证实了这一理论。
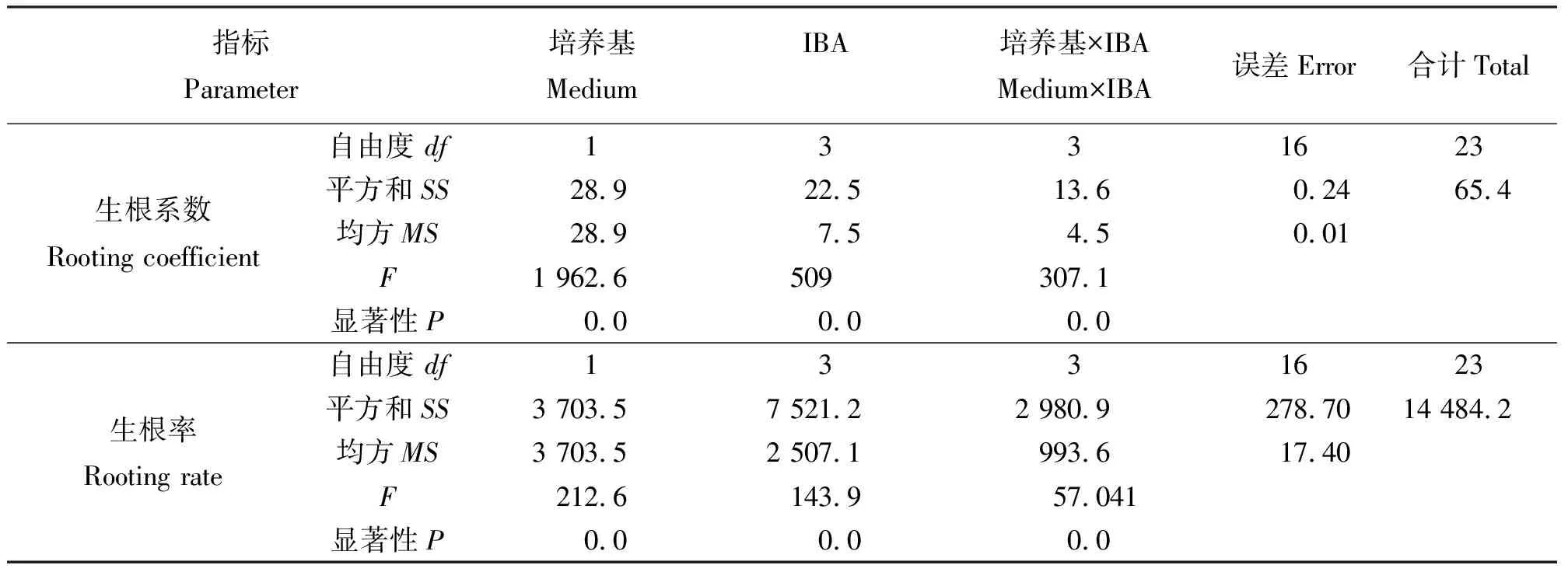
表6 培养基和IBA浓度对丛生芽生根影响的方差分析结果
再生小鳞茎鳞片的诱导效果及诱导周期短,分化能力强,可以作为百合组培再生体系较好的外植体,愈伤的诱导率较高且愈伤的质量较好。诱导无菌小鳞茎鳞片生成不定芽数量多且生长健壮的培养基为MS+1.0 mg·L-16-BA。而在MS附加NAA 0.5 mg·L-1的培养基上诱导出的不定芽及生根多,且植株生长健壮,可直接用于生根移栽,且大大缩短了育苗周期。1/2 MS培养基比MS培养基的生根效果好,这和前人的研究结果相一致[18-19],可能是由于MS培养基含有较高浓度的无机盐而抑制了不定根的形成。IBA对生根有促进作用,但IBA过高,根的数量过多,抑制根的伸长,容易发生老化现象。崔刚等[20]对樱桃(Cerasuspseudocerasus)、苹果(Maluspumila)等进行瓶外生根,未生根的苗木得到了充分的利用,所以也可以尝试用瓶外生根的方式缩短百合育苗周期。
[1] 肖艳,张延龙,牛立新,等.百合种球抗寒性的研究[J].陕西农业科学,2005(5):35-37.
[2] 朱东兴,沈宗根,张芸,等.1-MCP处理对金百合切花保鲜效应的研究[J].热带亚热带植物学报,2008,16(3):225-229.
[3] 钱灿.百合杂交授粉生物学特性研究[D].哈尔滨:东北林业大学,2002.
[4] 周蕴薇,刘芳,李俊涛.百合花粉生活力及贮藏特性[J].东北林业大学学报,2007,35(5):39-40.
[5] 刘凤栾,杨利平,尚爱芹,等.百合远缘杂交的胚囊和胚胎发育及胚拯救[J].河北农业大学学报,2009,32(2):42-45.
[6] 孙晓梅,崔文山,刘艳芬,等.不同授粉方法对新中心和普瑞头两种百合杂交结实影响的研究[J].辽宁林业科技,2002(2):6-9.
[7] 刘凤鸾.克服百合远缘杂交不亲和性的研究[D].石家庄:河北农业大学,2006.
[8] 罗建让,张延龙,张林华.克服百合自交及杂交障碍方法的初步研究[J].西北农业学报,2007,16(4):260-263.
[9] 周艳萍,郑红娟,贾桂霞.两个亚洲百合品种离体再生体系的建立[J].北京林业大学学报,2007,29(1):123-127.
[10] 周蕴薇,刘艳萍,岳莉然,等.亚洲百合‘普瑞头’的组织培养及休眠小鳞茎获得的研究[J].北方园艺,2011(4):146-148.
[11] 唐东芹,钱虹妹,黄丹枫,等.百合基因转化直接分化受体系统的建立[J].江苏农业科学,2003(3):48-51.
[12] 张彦妮,杨利平,陈立新.百合属‘红骑士’的组织培养和快速繁殖[J].北方园艺,2007,6:218-219.
[13] 葛军, 刘振虎, 卢欣石.紫花苜蓿再生体系研究进展[J].中国草地,2004,26(2):63-67.
[14] 景艳莉,周蕴薇,张金玉.精粹百合的组织培养与快速繁殖技术[J].东北林业大学学报,2006,34(6):46-47.
[15] 王刚,杜捷,李桂英,等.兰州百合和野百合组织培养基快速繁殖研究[J].西北师范大学学报(自然科学版),2002,38(1):69-71.
[16] 张建华,庄天明,陈银华.百合无病毒苗快速繁殖技术[J].上海交通大学学报(农业科学版),2006,24(4):370-373.
[17] 潘佑找,柯尊涛,赵宇瑛.不同外植体对兰州百合组织培养的影响[J].安徽农学通报,2007,13(19):242-245.
[18] 刘雅楠,黄惠英,张金文.兰州百合鳞片组织培养研究[J].草原与草坪,2010(4):26-31.
[19] 谢航,白伟,刘云,等.百合组织培养及快繁技术[J].农业与技术,1998,18(5):33-34.
[20] 崔刚.植物开放式组织培养与工厂化育苗新模式的研究[D].泰安:山东农业大学,2005.

