白颖苔草热激转录因子(HSF1)真核表达载体的构建
孙 彦,郭校民,周 禾
(中国农业大学动物科技学院草业科学系 草业科学北京市重点实验室,北京 100193)
白颖苔草(Carexrigescens)别名小羊胡子草,隶属于莎草科苔草属。喜冷凉气候,耐寒力强,且耐干旱、耐瘠薄,能适应多种土壤类型。该草叶绿、纤细,外形整齐美观,是很好的疏林游乐草坪植物,我国北方地区多用作观赏草坪和装饰草坪,也可用作高速公路、铁路两旁等优良的地被植物以及人流量不多的公园、庭院、街道、花坛等绿化材料[1]。
在植物细胞内有一种转录调节因子在热激条件下可以激活热激基因的表达,被称为热激转录因子(HSF)[2]。随着对植物逆境响应研究的逐渐深入,热激因子参与植物环境胁迫响应的证据越来越多[3-7]。迄今,研究人员已在多种生物体内发现了不同种类的HSF,并通过多种方法探明了HSF分子上的大部分重要结构,同时对这些重要结构的定位、空间构象、功能及调节进行了充分的研究[8-10]。
对于草坪草相关热激转录因子的研究报道很少,党卫玲[11]已完成白颖苔草热激转录因子基因的克隆,本研究进行白颖苔草热激转录因子(HSF1)真核表达载体的构建,以期为进一步研究HSF1在热激蛋白(HSP)合成及提高植物耐热性中的作用和培育耐热植物新品种奠定基础。
1 材料与方法
1.1材料
1.1.1菌株和克隆载体 用于转化真核生物的农杆菌LBA4404菌株,用于克隆和载体构建的大肠杆菌DH5α菌株、CrHsf全长cDNA的大肠杆菌菌液及真核表达载体PBI 121(图1)均由中国农业科学院北京畜牧兽医研究所保存。克隆载体Pmd-18T由TaKaRa公司提供。载体在pUC18载体的多克隆位点处的Xba I和Sal I识别位点之间插入了EcoR V识别位点,用EcoR V进行酶切反应后,再在两侧的3′端添加“T”而成。因大部分耐热性DNA聚合酶反应时都有在PCR产物的3′端添加一个“A”的特性,使PCR产物的连接、克隆效率大大提高。pMD-18T载体图谱如图2。
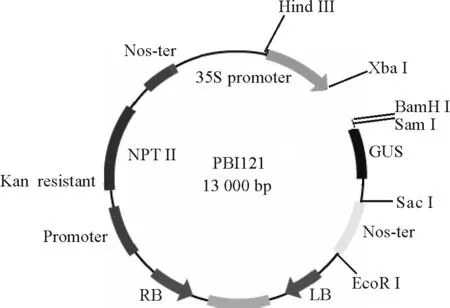
图1 真核表达载体PBI 121
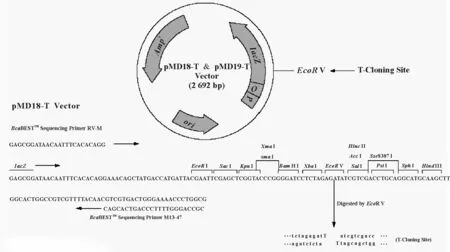
图2 pMD-18T载体图谱
1.1.2溶液的配制 10×TAE:Tris 48.4 g,冰醋酸11.42 mL,0.5 mol·L-1EDTA(pH值8.0)20 mL,加水定容至1 L。
6×DNA Loading Buffer:0.25%溴酚蓝,40%甘油水溶液,4 ℃保存。
LB培养基(1 L):蛋白胨10 g,酵母提取物5 g,NaCl 10 g,调pH值至7.0(固体培养基每升加10 g琼脂粉),高压灭菌20 min。
YEB培养基:牛肉浸膏5 g,酵母提取物1 g,胰化蛋白胨5 g,蔗糖5 g,氨苄青霉素(Amp)贮液(100 mg·mL-1)即100 mg Amp溶于1 mL蒸馏水中,-20 ℃保存。
溶液 Ⅰ:50 mmol·L-1Tris·HCl(pH值7.5),10 mmol·L-1EDTA(pH值8.0),高压灭菌。
溶液Ⅱ:0.2 mol·L-1NaOH,1% SDS,分别配制0.4 mol·L-1NaOH和2% SDS的贮液,使用时以1∶1比例混合。
溶液Ⅲ:1.32 mol·L-1KAc(pH值4.8),高压灭菌。
1.2质粒PMD-CR的构建
1.2.1PCR扩增


CRHSF 全长cDNA 的大肠杆菌菌液,200 mL PCR管中混合,共25.0 μL,组分如下:ddH2O 17.75 μL,10×PCR buffer(含Mg2+)2.5 μL,dNTP(10 mmol·L-1each)0.5 μL,Primer CP1(10 μmol·L-1)1.0 μL,Primer CP2(10 μmol·L-1)1.0 μL菌液2.0 μL,Taq DNA(5 U·μL-1)0.25 μL。混合均匀后按下列条件进行反应:94 ℃ 3 min后,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 60 s,进行40循环后,72 ℃ 5 min。
1.2.2PCR产物的回收和纯化
1)PCR产物在2.0%的琼脂糖凝胶上电泳,待回收的DNA 片段经电泳分离后,从琼脂糖凝胶上切下所需的DNA片段,放在1.5 mL离心管中,称取质量。
2)加入3倍体积的溶胶液PN,50 ℃水浴放置10 min,期间不断温和地翻转离心管,直至琼脂糖凝胶完全溶解。
3)待胶溶液冷却至室温后,将其加入一个吸附柱CA2中,13 000 r·min-1,离心30 s,倒掉收集管中的废液,将吸附柱重新放入收集管中。
4)向吸附柱中加入700 L漂洗液PW,13 000 r·min-1,离心30 s,倒掉收集管中的废液,将吸附柱重新放入收集管中。
5)向吸附柱中加入500 L漂洗液PW,13 000 r·min-1,离心30 s,倒掉收集管中的废液,13 000 r·min-1,离心2 min,室温干燥数分钟,使漂洗液中的乙醇挥发完全。
6)将吸附柱放到一个干净的离心管中,向吸附膜中间位置悬空滴加适量洗脱缓冲液EB,室温放置2 min,13 000 r·min-1,离心1 min,收集DNA溶液。此溶液即为回收的片段。
1.2.3连接反应 将上一步回收的PCR产物直接与pMD-18T载体连接[按(3~9)∶1的摩尔比连接],反应体系:pMD-18T Vector (50 ng·μL-1)1.0 μL,PCR 产物 4.0 μL,Ligation Solution Ⅰ 5.0 μL,共10.0 μL。混匀后,16 ℃连接过夜,-20 ℃保存。
1.2.4大肠杆菌感受态细胞的制备(CaCl2法) 挑单菌落接种于LB液体培养基中,37 ℃培养过夜。取500 μL菌液加到50 mL LB液体培养基中,37 ℃震荡培养2~3 h,至OD600值为0.3~0.5。冰浴20~30 min,9 000 r·min-1,4 ℃离心2 min,收集菌体。用预冷的20 mL 80 mmol·L-1CaCl2悬浮。冰浴20~30 min,9 500 r·min-1,4 ℃离心2 min,收集菌体。再用预冷的20 mL 80 mmol·L-1CaCl2悬浮,菌液置于冰浴中备用(12~14 h内转化效率最高),或者加入20%甘油,每管以200 μL分装于1.5 mL离心管中,液氮速冻后,保存于-70 ℃备用。
1.2.5连接产物的转化 在超净台内将5 μL连接产物加入到200 μL的DH5α感受态细胞中,混匀,置冰上30 min。42 ℃热激90 s,冰浴5 min。加入800 μL LB液体培养基,37 ℃振荡培养1 h。3 500 r·min-1,离心5 min,弃去800 μL上清液,剩余物涂板于含Ampicillin(100 g·mL-1)的LB平板上。37 ℃避光培养过夜,第2天观察结果。
1.2.6菌液PCR 随机挑取克隆单菌落接种于含有相应抗生素的1 mL LB液体培养基中,37 ℃振荡培养过夜。与第1次PCR扩增相同的引物对和PCR反应条件进行扩增。按下列方法准备反应体系:在200 μL PCR管中混合,共25.0 μL如下组分:ddH2O 17.75 μL,10×PCR buffer(含Mg2+)2.5 μL,dNTP(10 mmol·L-1)0.5 μL,Primer CP1(10 μmol·L-1)1.0 μL,Primer CP2(10 μmol·L-1)1.0 μL,菌液 2.0 μL,Taq DNA酶(5 U·μL-1)0.25 μL。混合均匀后按下列条件进行反应:94 ℃ 3 min后,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 60 s,40循环后,72 ℃ 5 min。
1.2.7质粒提取(碱裂解法) 将阳性(PCR扩增后,显示有目的片断的菌即是阳性克隆,否则就是阴性)克隆单菌落接种于含有相应抗生素的5 mL LB液体培养基中,37 ℃振荡培养过夜。取3 mL 菌液,12 058 r·min-1,离心60 s,收集菌体。加100 μL溶液Ⅰ(50 mmol·L-1EDTA,10 mmol·L-1Tris-HCl,pH值7.5),轻轻颠倒混匀。加200 μL新配制的溶液Ⅱ(1%SDS,0.2 mol·L-1NaOH),颠倒混匀。待溶液澄清后立即加入预冷的150 μL溶液Ⅲ(1.32 mol·L-1醋酸钾,pH值4.8),混匀后冰上放置5~10 min。12 058 r·min-1,离心10 min,弃去沉淀。加1倍体积异丙醇,室温放置5 min。12 058 r·min-1,离心10 min。沉淀用70%乙醇洗涤2次,晾干沉淀。用50 μL含RNase A(20 μg·mL-1)的TE缓冲液溶解质粒DNA,37 ℃消化30 min,-20 ℃保存备用。该质粒命名为PMD-CR。
1.3表达载体的构建
1.3.1酶切质粒pMD-CR和表达载体PBI 121酶切的反应体系:pMD-CR(orPBI 121)8 μL,Xba I 1 μL,BamH I 1 μL,10×Buffer K 1 μL,ddH2O 9 μL, 37 ℃保温6 h,回收目的片段。
1.3.2将酶切的目的基因片段和载体片段进行连接 连接的反应体系:PBI 121 3 μL,PMD-CR 9 μL,10× Buffer 2 μL,Ligase 1 μL,ddH2O 5 μL,共20 μL。16 ℃下保温16 h,连接产物在-20 ℃保存或用于转化。
1.3.3农杆菌感受态的制备 挑取根癌农杆菌单菌落于3 mL的含利福平50 μg·mL-1的YEB液体培养基,28 ℃振荡培养过夜。取过夜培养菌液500 μL接种于50 mL YEB(含相应抗生素)液体培养基中,28 ℃振荡培养至OD600为0.5。5 000 r·min-1,离心5 min。加10 mL 0.15 mmol·L-1NaCl悬浮农杆菌细胞,5 000r·min-1,离心5 min。1 mL预冷的20 mmol·L-1CaCl2悬浮细胞,冰浴,24 h内使用,或分装成每管200 μL,液氮中速冻1 min,置-70 ℃保存备用。
1.3.4农杆菌转化及鉴定 取200 μL感受态细胞,加入1 μg构建好的质粒DNA,液氮中速冻1 min,37 ℃水浴5 min,然后加入1 mL YEB培养基,28 ℃慢速振荡培养4 h。1 000 r·min-1,离心30 s,弃上清,加入0.1 mL YEB培养基重新悬浮细胞,涂布于含有100 μg·mL-1Kna和50 μg·mL-1Rif的YEB平板上,28 ℃培养约48 h。挑取平板上长出的单菌落,接种于YEB液体培养液(含有100 μg·mL-1Kna和50 μg·mL-1Rif)中,28 ℃振荡培养过夜。小量提取质粒DNA,以质粒DNA为模板进行PCR扩增鉴定。阳性质粒命名为PBICR,并将其测序。
2 结果与讨论
2.1含有酶切位点CrHsf开放阅读框片段的获得 以实验室的CrHsf 全长cDNA 的大肠杆菌菌液为材料,以 Primer CP1,Primer CP2为引物进行PCR扩增,琼脂糖电泳检测扩增,扩增的DNA片段与预期的1 000 bp大小一致(图3)。
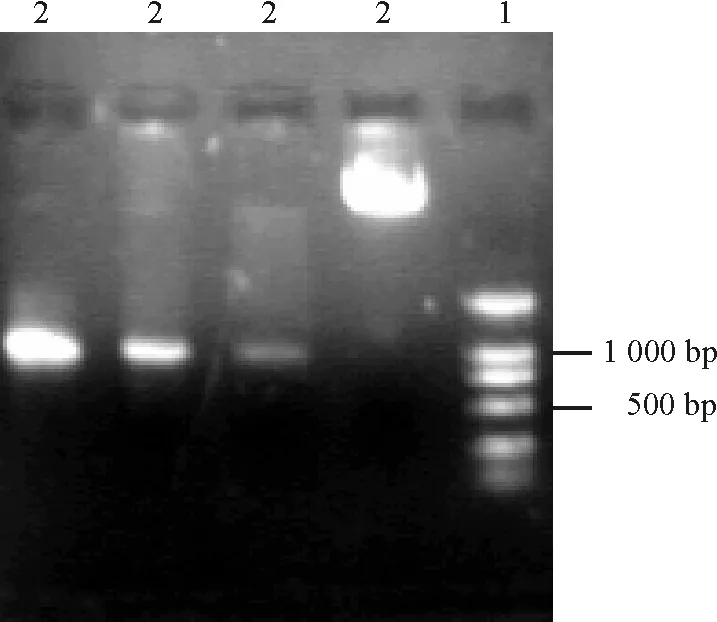
图3 CrHsf全长cDNA的PCR扩增结果
2.2重组质粒PMD-CR的构建及酶切结果 用PCR产物回收试剂盒对cDNA PCR扩增产物进行纯化回收,然后与克隆载体质粒PMD-18T进行连接,将质粒转化大肠杆菌感受态细胞。挑取白色菌株做PCR扩增,提取质粒,连接后的质粒命名为PMD-CR。对质粒PMD-CR进行BamHⅠ和XbaⅠ双酶切,约1 000 bp处即为目的基因片段(图4)。结果证明,酶切后获得了预期目的基因片段。
2.3表达载体的构建及鉴定 对植物表达载体PBI 121进行XbaⅠ/BamHⅠ双酶切,大于2 000 bp的即为载体片段(图5)。分别对酶切产物进行回收,把目的基因片段定向克隆到植物表达载体PBI121上,连接构建载体PBI 121-HSF。转化农杆菌,挑取饱满菌落进行PCR扩增和XbaⅠ/BamHⅠ双酶切消化,有一段外源片段放出。经琼脂糖电泳,在1 000 bp处呈现的条带(图6)与质粒PMD-CR双酶切后的图显示一致,表明目的基因片段已插入植物表达载体PBI 121中,证明植物表达载体PBI-HSF构建成功(图7)。载体的构建成功可以为转基因做准备,同时可以为进一步研究HSF1基因在热激蛋白合成及提高植物耐热性中的作用、培育耐热植物新品种打下一定的基础。
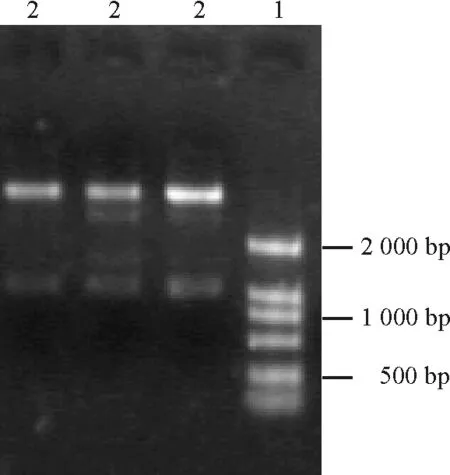
图4 质粒PMD-18T的酶切结果
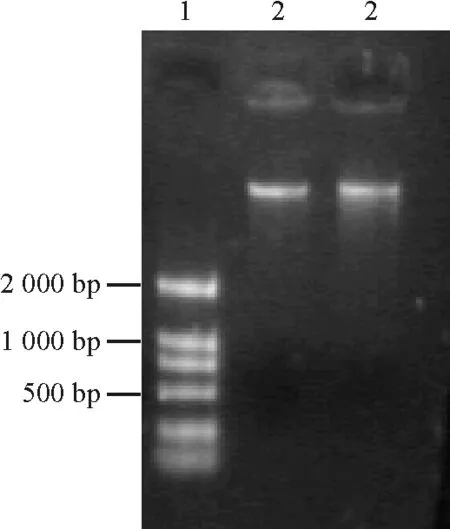
图5 PBI 121酶切图谱
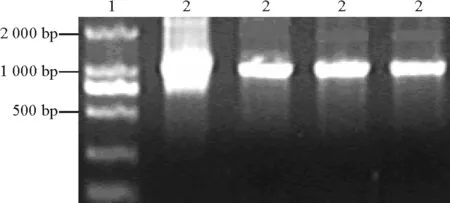
图6 PBI-HSF酶切图谱
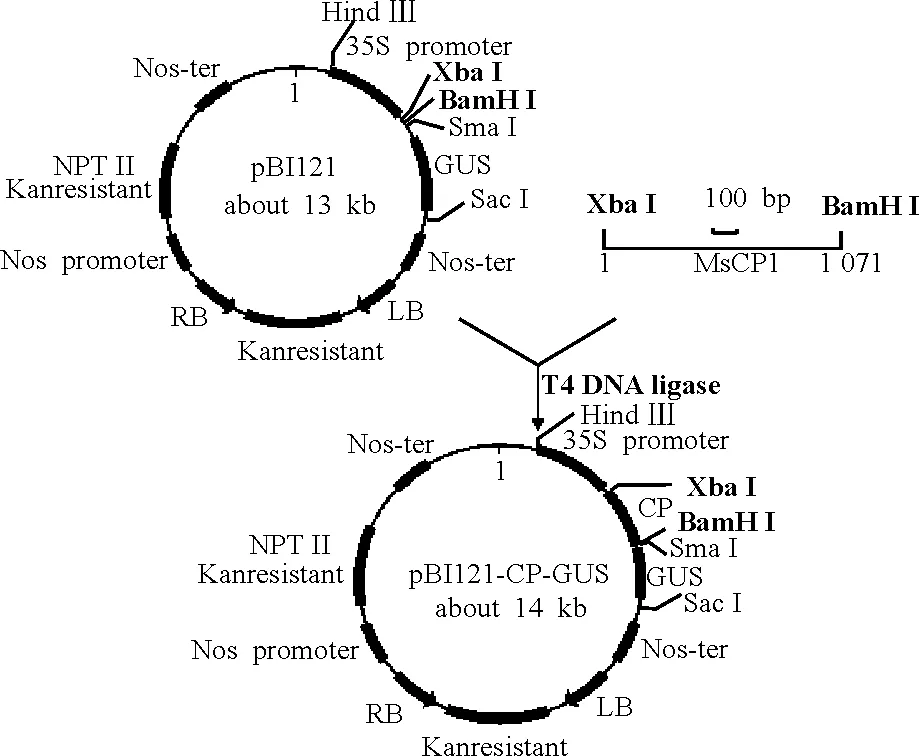
图7 PBI 121-HSF构建图
[1]孙彦.草坪实用技术手册[M].北京:化学工业出版社,2001.
[2]Linquist S.The heat shock response[J].Annual Review of Biochemistry,1986,55:1151-1191.
[3]Baniwal S K,Chan K Y,Scharf K D,etal.Role of heat stress transcription factor HsfA5 as specific repressor of HsfA4[J].Journal of Biology Chemitry,2007,282(6):3605-3613.
[4]Czarnecka-Verner E,Yuan C X,Fox P C,etal.Isolation and characterization of six heat shock transcription factor cDNA clones from soybean[J].Plant Molecular Biology,1995,29(1):37-51.
[5]黄梦苏.热激转录因子基因转化不结球白菜的研究[D].南京:南京农业大学,2002.
[6]穆睿聆.玉米热激因子HSF1基因的克隆[D].石家庄:河北师范大学,2002.
[7]熊爱生,彭日荷,李贤,等.拟南芥热激因子cDNA的克隆及转化烟草研究[J].上海农业学报,2003,19(1):6-10.
[8]Gong M,van der Luit A H,Knight M R,etal.Heat-shock-induced changes in intracellular Ca2+level in tobacco seedlings in relation to thermotolerance[J].Plant Physiology,1998,116:429-437.
[9]张伟.热休克基因转录的调节:热休克转录因子(HSF)的结构与功能[J].第三军医大学学报,2002,22(2):198-200.
[10]Wu C.Heat stress transcription factors:Structure and regulation[J].Annual Reviews of Cell and Developmant Biology,1995,11:441-469.
[11]党卫玲.编码白颖苔草热激转录因子基因的克隆及其序列分析[D].北京:中国农业大学,2007:18-43.

