温度和pH对杂色鲍消化酶活力的影响
(集美大学 水产学院,福建省高校水产科学技术与食品安全重点实验室,福建 厦门 361021)
消化酶是特指消化系统分泌的具有消化功能的酶,具有酶的所有特性,依其消化对象不同大致可划分为蛋白酶、糖酶和脂肪酶三大类[1]。消化酶活力能够反映动物对不同营养成分的消化能力,是评估消化生理机能的一项重要指标,当条件发生改变时,消化酶的活力大小就会发生改变,因此,研究不同因子对消化酶活力的影响对了解消化酶的性质具有重要意义,其中温度和pH是影响消化酶活力的两个重要因子。国内外关于贝类消化酶的研究已有很多[2-23],研究内容主要涉及消化酶的活力与分
布[11-12,15-17,19-20]、环境因子(如温度、pH[3-4,6,13-14]、饵料[18,23]、季节变化[2,5,22]等)对消化酶活力的影响及幼体不同发育阶段消化酶活力的变化规律等[10]。关于鲍消化酶的研究较少,仅见皱纹盘鲍(Haliotis discus hannai)[15-17]、蓝鲍(Haliotis fulgens)[19-20]、南非鲍(Haliotis midae)[21]等。
杂色鲍(Haliotis diversicolorReeve)也叫九孔鲍,是中国南方地区重要的鲍养殖品种之一,味道鲜美,营养丰富,深受消费者的青睐,市场需求量与日俱增,开展快速健康生态养殖势在必行。关于杂色鲍的研究已有很多,主要集中于人工育苗、养成技术[25-26]等方面,而与其健康养殖密切相关的营养学和消化生理学方面的研究很少[24],与其大规模养殖的现状存在明显差距。鉴于此,作者通过研究温度和pH对杂色鲍消化酶活力的影响,初步揭示杂色鲍消化酶的性质,探讨杂色鲍的消化生理特点,从而丰富杂色鲍消化生理学、营养生理学知识,并为杂色鲍快速健康养殖提供理论参考。
1 材料与方法
1.1 实验材料
杂色鲍于2009年10月购自厦门林阳鲍鱼养殖场,共 20只,体质量(12.5±0.86)g,壳长(5.2±0.38)cm。
1.2 样品制备
在冰盘中活体解剖杂色鲍,迅速取出肝胰腺和消化道,由每3只杂色鲍的同一部位组织合成1个样品,每个样品设3个平行组。剔除附着物,用滤纸吸干各部位水分并称重,然后剪碎,各加入 10倍体积(W/V)预冷双蒸水(4℃);用高速匀浆机匀浆,匀浆液用高速冷冻离心机4℃ 4000 r/min冷冻离心30 min,取上清液(即粗酶液),用于测定胃蛋白酶、类胰蛋白酶、淀粉酶、纤维素酶活力及蛋白含量。
1.3 实验梯度设置
根据酶的蛋白性质将各消化酶的温度均设置为10~70℃,每 10℃为一梯度,共 7个梯度,用恒温水浴锅控温。各消化酶的pH系统采用0.2 mol/L磷酸氢二钠-柠檬酸钠缓冲液配制,以 0.4为一个 pH 梯度。其中胃蛋白酶 pH设定为2.2~4.2,共 6个梯度;类胰蛋白酶pH设定范围为7.4~9.8,共设置7个梯度;淀粉酶pH设定为6.0~8.0,共6个梯度;纤维素酶pH设定为4.0~6.0,共 6个梯度。每个梯度均设 3个平行组,3个对照组,结果取平均值。
1.4 酶活力测定
参照潘鲁青等[27]的方法,并作改进,用多功能酶标仪测定各消化酶的光密度值,根据标准曲线计算酶活力。酶活力用比活力表示,比活力=酶活力单位/mg蛋白(U/mg)。
1.4.1 胃蛋白酶活力测定
采用以 1%酸性酪蛋白为底物的福林-酚试剂显色法,以1 mmol/L酪氨酸溶液制作标准曲线。胃蛋白酶活力定义为:在设定温度和pH下,单位粗酶液每分钟水解酪蛋白产生1 μmol酪氨酸为一个活力单位 U(μmol/min)。
1.4.2 类胰蛋白酶活力测定
采用以 1%碱性酪蛋白为底物的福林-酚试剂显色法,标准曲线和酶活力定义同胃蛋白酶。
1.4.3 淀粉酶活力测定
采用以 2%可溶性淀粉为底物的 3,5-二硝基水杨酸显色法,以 1 mmol/L麦芽糖溶液制作标准曲线。淀粉酶活力定义为:在设定温度和pH下,单位粗酶液每分钟水解淀粉产生1 μmol麦芽糖为一个活力单位 U(μmol/min)。
1.4.4 纤维素酶活力测定
采用以0.5%羧甲基纤维素钠为底物的3,5-二硝基水杨酸显色法,以 1mmol/L葡萄糖溶液制作标准曲线。纤维素酶活力定义为:在设定温度和 pH下,单位粗酶液每分钟水解纤维素产生1 μmol葡萄糖为一个活力单位 U(μmol/min)。
1.5 蛋白含量测定
采用考马斯亮蓝G-250染色法[28],以0.1 g/L小牛血清蛋白溶液为标准物,测定单位粗酶液的蛋白含量。
1.6 数据分析与整理
实验数据采用SPSS13.0统计软件进行单因素方差分析(one-way ANOVA)和LSD多重比较,检验各实验组间数据的差异显著性,显著性水平设计为P=0.05,P>0.05表示差异不显著,P<0.05表示差异显著,P<0.01表示差异极显著。所有数据均以平均值±标准差(n=3)表示。
2 结果
2.1 温度对杂色鲍消化酶活力的影响
2.1.1 温度对胃蛋白酶活力的影响
表1显示了杂色鲍胃蛋白酶活力随着温度的升高而发生的变化以及相同温度下不同器官内的差异。杂色鲍肝胰腺和消化道内胃蛋白酶活力均随温度的升高呈现先升后降的峰值变化,且均在 50℃时达到最高值(P<0.01),表明杂色鲍肝胰腺和消化道内胃蛋白酶的最适温度均为50℃。在20~70℃时,肝胰腺中胃蛋白酶活力始终显著高于消化道中(P<0.01),表明杂色鲍肝胰腺对酸性蛋白的消化能力比消化道高。
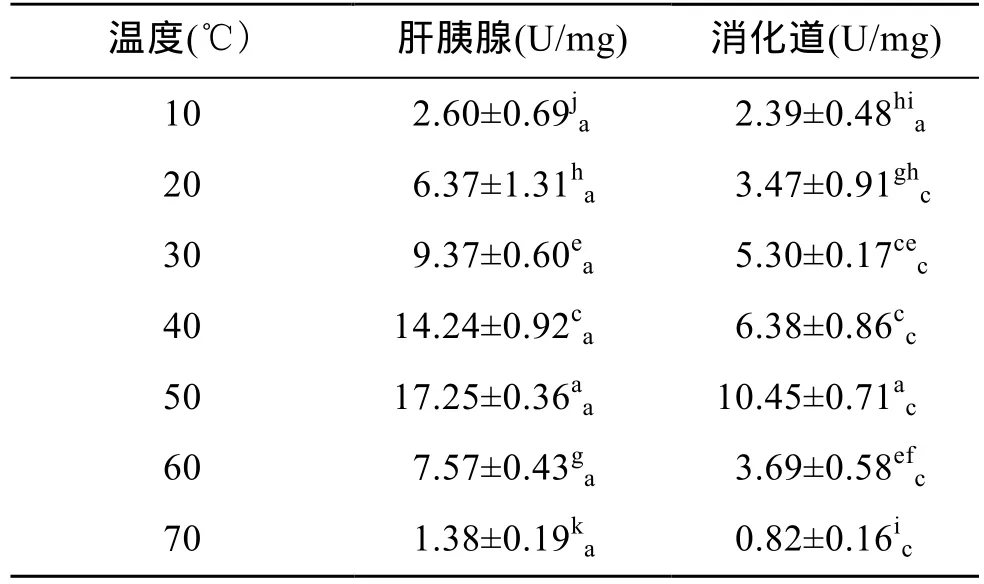
表1 温度对杂色鲍胃蛋白酶活力的影响Tab.1 Effect of temperature on pepsin activity of Haliotis diversicolor Reeve
2.1.2 温度对类胰蛋白酶活力的影响
由表2可以看出,杂色鲍肝胰腺和消化道内的类胰蛋白酶活力随着温度的升高呈现先升后降的变化趋势,其中肝胰腺内类胰蛋白酶活力在 40℃达到最高值(P<0.01),消化道内类胰蛋白酶活力在 50℃达到最高值(P<0.01),表明肝胰腺和消化道内类胰蛋白酶的最适温度分别为 40℃和 50℃。在 10~20℃时,肝胰腺中类胰蛋白酶活力与消化道中无差异(P>0.05),在 30~40℃时,肝胰腺中类胰蛋白酶活力显著高于消化道中(P<0.01),在 50~70℃时,消化道中类胰蛋白酶活力则高于肝胰腺中(P<0.05),表明在温度较低时,杂色鲍肝胰腺对碱性蛋白的消化能力比消化道高,而随着温度升高消化道对碱性蛋白的消化能力则高于肝胰腺。
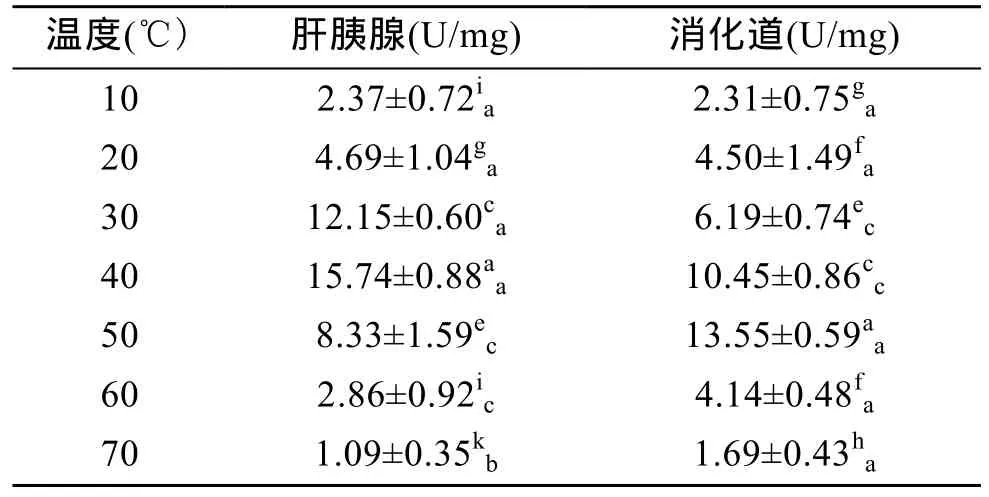
表2 温度对杂色鲍类胰蛋白酶活力的影响Tab.2 Effect of temperature on trypsin activity of Haliotis diversicolor Reeve
2.1.3 温度对淀粉酶活力的影响
表3显示,杂色鲍肝胰腺和消化道内的淀粉酶活力均随温度的升高先升后降,其中肝胰腺内淀粉酶活力在 40℃达到最高值(P<0.01),消化道内淀粉酶活力在 30℃达到最高值(P<0.01),表明杂色鲍肝胰腺和消化道内淀粉酶的最适温度分别为 40℃和30℃。由表3还可以看出,肝胰腺中淀粉酶的活力在各个温度下均显著高于消化道中(P<0.01),表明杂色鲍肝胰腺对淀粉的消化能力远比消化道高。
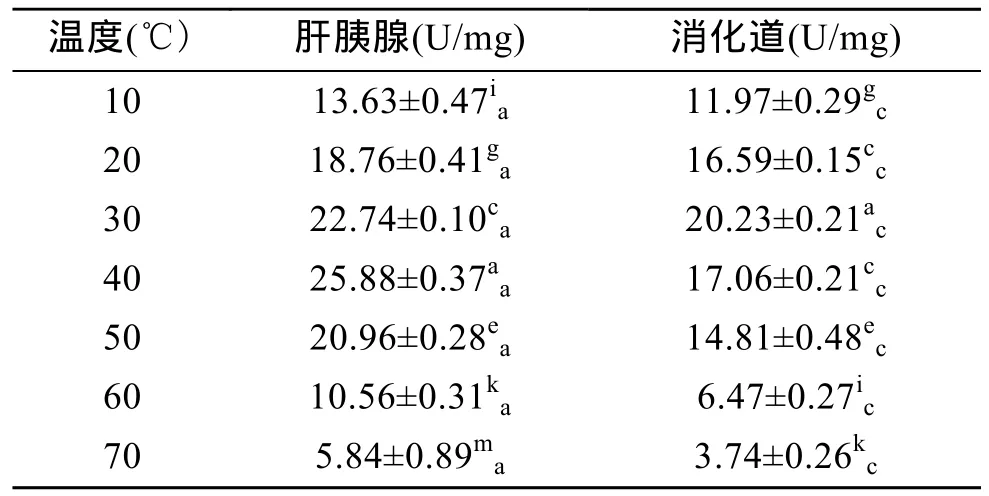
表3 温度对杂色鲍淀粉酶活力的影响Tab.3 Effect of temperature on amylase activity of Haliotis diversicolor Reeve
2.1.4 温度对纤维素酶活力的影响
表4显示了不同温度下杂色鲍纤维素酶活力的变化情况及不同器官中的差异。总体上肝胰腺和消化道中纤维素酶的活力都随着温度的升高先升后降,其中肝胰腺内纤维素酶活力在 50℃时达到最高值(P<0.01),40℃与 50℃时无显著差异(P>0.05),表明肝胰腺中纤维素酶的适宜温度范围为40~50℃。消化道内纤维素酶活力在40℃时达到最高值(P<0.01),表明消化道内纤维素酶的最适温度为 40℃。由表4还可看出,在各反应温度下,肝胰腺中纤维素酶活力总是比消化道中更高(P<0.05),表明杂色鲍肝胰腺对纤维素的消化能力更强。
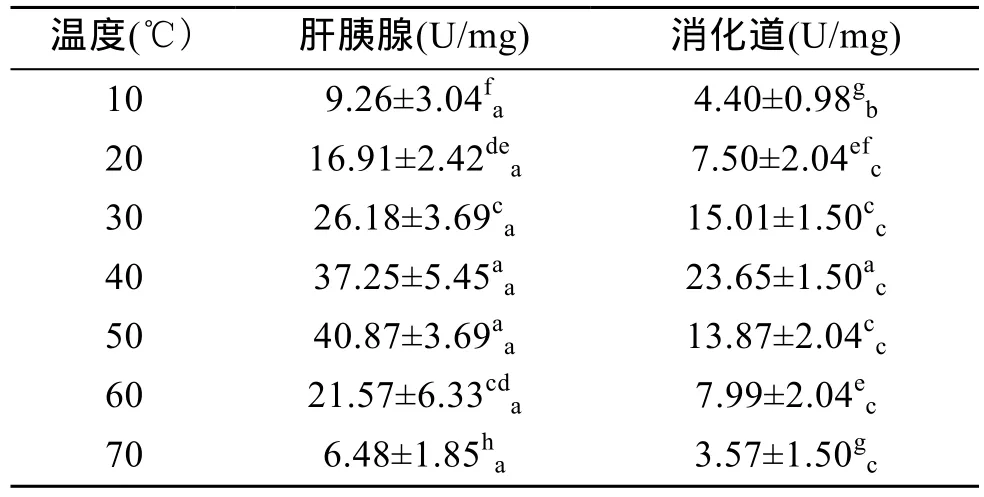
表4 温度对杂色鲍纤维素酶活力的影响Tab.4 Effect of temperature on cellulase activity of Haliotis diversicolor Reeve
2.2 pH对杂色鲍消化酶活力的影响
2.2.1 pH对胃蛋白酶活力的影响
表5显示了杂色鲍肝胰腺和消化道内胃蛋白酶活力随着pH的升高而发生的变化。在pH 2.2~4.2时,杂色鲍肝胰腺和消化道中胃蛋白酶活力均随着 pH的升高呈现先升后降的峰值变化,其中,肝胰腺内胃蛋白酶活力在pH 2.6、3.0时最高(P<0.05),二者无显著差异(P>0.05),表明杂色鲍肝胰腺内胃蛋白酶的适宜 pH为 2.6~3.0;消化道内胃蛋白酶活力在pH 2.6、3.0、3.4时最高(P<0.05),且三者无显著差异(P>0.05),表明消化道内胃蛋白酶的适宜pH范围为 2.6~3.4。由此可见,杂色鲍胃蛋白酶在强酸性条件下活力较强。此外,除pH 2.6外(P<0.05),其余各pH下肝胰腺中胃蛋白酶活力均与消化道无显著差异(P>0.05),表明杂色鲍肝胰腺和消化道对酸性蛋白的消化能力相当。

表5 pH对杂色鲍胃蛋白酶活力的影响Tab.5 Effect of pH on pepsin activity of Haliotis diversicolor Reeve
2.2.2 pH对类胰蛋白酶活力的影响
由表6可以看出,在pH 7.4~9.8时,杂色鲍肝胰腺和消化道内类胰蛋白酶活力也随 pH 的升高均呈现先升后降的变化趋势,其中肝胰腺内类胰蛋白酶活力在pH 8.6、9.0时最高(P<0.05),二者无显著差异(P>0.05),表明其适宜pH范围为8.6~9.0;消化道内类胰蛋白酶活力在 pH 8.2时达最高值(P<0.01),表明其最适 pH为 8.2。由此可见,杂色鲍类胰蛋白酶在碱性环境下活力较强。由表6还可看出,在pH 8.6~9.0时,肝胰腺中类胰蛋白酶活力显著高于消化道中(P<0.01),而在其余pH范围内,肝胰腺与消化道中的类胰蛋白酶活力无差异(P>0.05),表明杂色鲍类胰蛋白酶的器官特异性低。
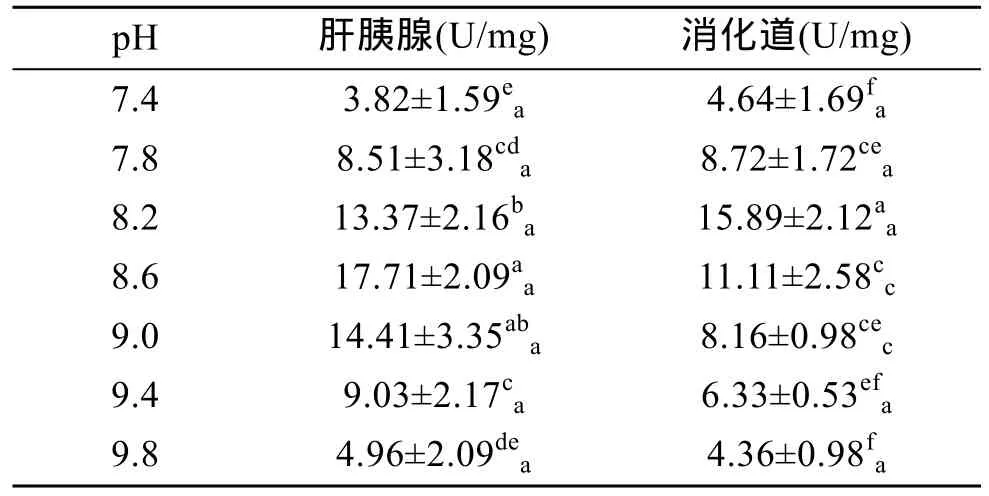
表6 pH对类胰蛋白酶活力的影响Tab.6 Effect of pH on trypsin activity of Haliotis diversicolor Reeve
2.2.3 pH对淀粉酶活力的影响
表7显示,杂色鲍肝胰腺和消化道内淀粉酶活力随着pH的升高先升后降。其中,肝胰腺内淀粉酶活力在pH 6.8时最高(P<0.01),消化道内淀粉酶活力在pH 7.2时最高(P<0.01),表明肝胰腺和消化道的最适pH分别为6.8和7.2,即杂色鲍淀粉酶在近中性条件下活力最高。在pH 6.0~8.0时,肝胰腺中淀粉酶活力始终显著高于消化道中(P<0.01),表明肝胰腺对淀粉的消化能力远高于消化道。
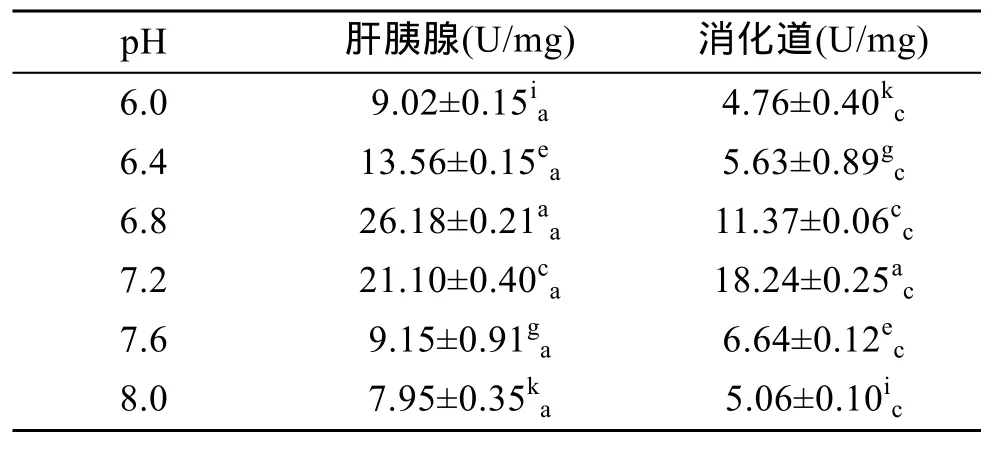
表7 pH对杂色鲍淀粉酶活力的影响Tab.7 Effect of pH on amylase activity of Haliotis diversicolor Reeve
2.2.4 pH对纤维素酶活力的影响
由表8可见,杂色鲍纤维素酶活力也随pH 的升高呈现出先升后降的峰值变化,其中,肝胰腺内纤维素酶活力在pH 5.2时达到峰值(P<0.01),消化道内纤维素酶活力在pH 4.8时最高(P<0.01),表明肝胰腺和消化道内纤维素酶的最适 pH 分别为 5.2和4.8,即杂色鲍纤维素酶在酸性条件下有较高的活力。由表8还可看出,在pH 4.0~4.8时,肝胰腺与消化道中纤维素酶活力无差异(P>0.05),在 pH 5.2~6.0时,肝胰腺中纤维素酶活力显著高于消化道中(P<0.01),表明在偏酸性条件下,纤维素酶活力无器官特异性,随着pH升高,肝胰腺对纤维素的消化能力更强。
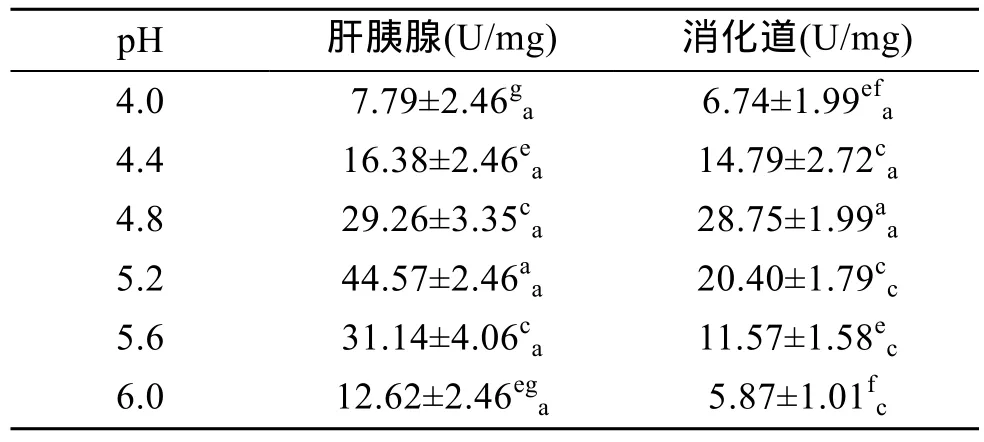
表8 pH对杂色鲍纤维素酶活力的影响Tab.8 Effect of pH on cellulase activity of Haliotis diversicolor Reeve
2.3 杂色鲍各消化酶活力的分布
2.3.1 最适温度下杂色鲍各消化酶活力的分布
表9显示了最适温度下杂色鲍各消化酶在肝胰腺和消化道内的活力差异。在最适温度下,除类胰蛋白酶外,肝胰腺中胃蛋白酶、淀粉酶、纤维素酶活力均显著高于消化道中(P<0.01),表明胃蛋白酶、淀粉酶、纤维素酶的活力分布具有器官特异性。由表9还可看出,同一消化器官内,各消化酶的活力也存在差异。肝胰腺内纤维素酶活力最高(P<0.01),约为淀粉酶活力的 1.6倍,胃蛋白酶和类胰蛋白酶活力的 2.4~2.6倍;消化道中各消化酶活力从高到低依次为:纤维素酶>淀粉酶>类胰蛋白酶>胃蛋白酶(P<0.01),其中纤维素酶活力约为胃蛋白酶活力的2.3倍。

表9 最适温度下杂色鲍各消化器官的消化酶活力比较Tab.9 Comparison of digestive enzymes activities in different digestive organs of Haliotis diversicolor Reeve under the optimum temperature
2.3.2 最适pH下杂色鲍各消化酶活力的分布
由表10可见,在最适pH下,杂色鲍各消化器官内各消化酶活力存在差异。在肝胰腺内,纤维素酶活力最高(P<0.01),约为类胰蛋白酶、淀粉酶、胃蛋白酶活力的2.5~2.8倍,表明肝胰腺对纤维素的消化能力远高于淀粉和蛋白;在消化道内,纤维素酶活力远高于其他三种消化酶(P<0.01),约为其活力的2.0~3.1倍,表明消化道具有较高的消化纤维素的能力,而对淀粉、蛋白质的消化能力较弱。杂色鲍各消化酶的活力分布还具有器官特异性。肝胰腺中淀粉酶、纤维素酶的活力显著高于消化道中(P<0.01),具有器官特异性,而胃蛋白酶和类胰蛋白酶活力在肝胰腺和消化道中无显著差异(P>0.05),表明这两种酶的活力分布无器官特异性。

表10 最适pH下杂色鲍各消化器官的消化酶活力比较Tab.10 Comparison of digestive enzymes activities in different digestive organs of Haliotis diversicolor Reeve under the optimum pH
3 讨论
3.1 温度与杂色鲍消化酶活力的关系
消化酶的蛋白质属性导致温度对消化酶活力具有显著的影响。在一定的温度范围内,酶活力随温度的升高而加快,超过一定范围后,酶活力反而随温度的升高而降低甚至变性失活[29]。本研究结果也验证了这一结论,在设定的温度范围内,杂色鲍各消化酶的活力均随着温度的升高呈现先升后降的变化趋势。不同种类、不同器官、不同酶类,具有不同的最适温度。本研究结果显示,杂色鲍肝胰腺和消化道中胃蛋白酶最适温度均为 50℃,类胰蛋白酶最适温度分别为 40、50℃,与皱纹盘鲍[16]蛋白酶的适宜温度范围40~50℃及西施舌(Coelomactra antiquata(Spengler))[13]胃蛋白酶最适温度 50℃相一致,略低于缢蛏(Sinonovacula constricta)[7]蛋白酶的最适温度55℃;泥蚶(Tegillarca granosa)[3-4]蛋白酶的最适温度为 38~40℃,低于杂色鲍,而栉孔扇贝(Chlamys Azumapecten farreri)[8]蛋白酶的最适温度为60℃,远高于其他贝类。杂色鲍肝胰腺和消化道中淀粉酶的最适温度分别为 40、30℃,与皱纹盘鲍[16]淀粉酶的最适温度 30℃相接近,高于栉孔扇贝[8]淀粉酶的最适温度 25℃,而缢蛏[7]淀粉酶的最适温度为 65℃,远高于杂色鲍,表明杂色鲍淀粉酶的耐热性较差,适宜在较低的温度下发挥酶活力。杂色鲍肝胰腺和消化道中纤维素酶的适宜温度范围分别为40~50℃、40℃,与缢蛏[7]纤维素酶的最适温度45℃相近。不同贝类各消化酶最适温度的差异可能与种的特异性有关,因为不同贝类的生态习性和摄食对象不同,其所含的消化酶的组成和性质也会有所差异,从而导致消化酶的最适温度因种而异。
由本研究结果还可发现,杂色鲍各消化酶的最适温度均高于栖息环境的生长适温 20~28℃,这在鱼类[30]、甲壳类[31-32]、贝类[8,13,16]中都有类似的报道。究其原因,可能是本实验所得数据是在规定时间、pH及离体条件下测得的,故与杂色鲍正常生理条件下各消化酶的最适温度存在差异。实际上,消化酶的最适温度受底物、反应时间、pH等多种因素的影响,其中最适温度与反应时间成反比,反应时间延长,最适温度就会降低[30]。消化酶在动物体内的作用时间至少长达 4~5 h,而实验中反应时间仅为 15~30 min,这可能是导致反应最适温度远高于生理适温的一个重要原因。虽然最适反应温度不能完全反映杂色鲍正常生理状态下消化酶的最适温度,但在一定条件下能在一定程度上反映各消化酶的热稳定性和温度对酶活力的影响规律[28]。
3.2 pH与消化酶活力的关系
pH是影响酶活力的另一重要因子,主要通过改变酶与底物的结合及酶的构象来影响酶活力。pH对杂色鲍4种消化酶活力均有显著影响,在设定的pH范围内,均呈现先升高后降低的趋势。每种酶都有其特定的 pH范围和最适 pH,受酶活性中心的性质、底物、温度、反应时间等影响。杂色鲍肝胰腺和消化道中胃蛋白酶的适宜 pH范围分别为 2.6~3.0和2.6~3.4,表明胃蛋白酶在强酸条件下活力最高,西施舌[13](2.6)、泥蚶[3-4](2.6)、栉孔扇贝[8](2.61)、皱纹盘鲍[16](2.6)蛋白酶的最适 pH与杂色鲍相一致,蓝鲍[33]与杂色鲍差异较大;杂色鲍肝胰腺和消化道中类胰蛋白酶的适宜pH分别为8.6~9.0和8.2,说明类胰蛋白酶在碱性条件下活力最高,略低于缢蛏[7](9.2),与皱纹盘鲍[15](7.8~10.0)差别较大。杂色鲍肝胰腺和消化道中淀粉酶的最适pH分别为6.8和7.2,与栉孔扇贝[8](6.5)、皱纹盘鲍[17](6.24)、缢蛏[7](6.3和 7.7)的结果相似。张硕等[8]比较了大量贝类和甲壳类,认为这些动物淀粉酶的最适pH只有一个,一般出现在pH 5~7之间,呈弱酸性。杂色鲍淀粉酶最适pH基本符合这一范围,但偏中性,说明杂色鲍淀粉酶在近中性条件下活力最强。但是不同种之间还是存在一些差异[34],可能与动物的生态习性和摄食对象不同有关。纤维素酶普遍存在于甲壳动物和低等无脊椎动物中[35],杂色鲍肝胰腺和消化道中纤维素酶的最适pH分别为5.2和4.8,说明纤维素酶在酸性条件下活力最强。缢蛏[7]纤维素酶的最适 pH(5.2)与杂色鲍一致。海洋无脊椎动物胃肠的 pH范围一般为5.5~7.9[16],杂色鲍淀粉酶和纤维素酶的最适pH与此相符,而蛋白酶的最适pH与此有显著差异,说明杂色鲍消化道内的酸碱环境更利于淀粉酶和纤维素酶活力的发挥,这可能也是淀粉酶和纤维素酶活力高于蛋白酶的原因之一。
蛋白酶适宜pH范围的个数因种而异。有些种类只有一个,如缢蛏[7](9.2)、西施舌[13](2.6)。多数种类具有两个适宜范围,如美国龙虾(Homarus americanus)幼体[31](5.3,6.4),栉孔扇贝[8](2.6、7.7),泥蚶[3-4](2.6、4.6或2.6、5.8)。李太武[15]报道皱纹盘鲍胃蛋白酶适宜 pH范围为 2.8~3.5,类胰蛋白酶适宜 pH范围为7.8~10.0,杨惠萍等[16]测得皱纹盘鲍蛋白酶适宜 pH范围为2.6和5.0,虽然与李太武报道的pH值有差异,但至少说明皱纹盘鲍蛋白酶的适宜 pH范围不止一个。本研究结果表明杂色鲍蛋白酶与大多数种类一致,也有两个适宜pH范围,分别为2.6~3.4,8.2~9.0。有的种类蛋白酶有3个适宜pH范围[32]。导致这种差异的原因,除种类不同外,测定条件的设置可能也是重要原因之一,因为蛋白酶活力主要包括胃蛋白酶活力和类胰蛋白酶活力,有些学者直接测量总蛋白酶的最适 pH,可能只得一个最适值,实际上,两种蛋白酶的最适pH差异很大,一种是在强酸性范围而另一种则是在碱性范围,总酶最适pH的研究体现不出这种差异,且易丢失适宜pH范围。此外,很多种类[3-4,8,13,31]蛋白酶的最适pH都在酸性范围内,是这些种类只有胃蛋白酶而不含类胰蛋白酶还是实验设计缺陷而造成,有待深入研究。
3.3 杂色鲍消化酶活力的分布
杂色鲍各消化酶的活力分布存在一定的器官特异性。在最适温度和最适pH范围内,肝胰腺中淀粉酶、纤维素酶活力均显著高于消化道中,表明肝胰腺是杂色鲍合成、分泌淀粉酶和纤维素酶的主要器官,对淀粉和纤维素起着主要的消化作用。Fange等[36]也指出肝胰腺是胰蛋白酶、淀粉酶、脂肪酶等酶类的中心生成器官。杂色鲍蛋白酶活力在肝胰腺和消化道中差异不显著,表明肝胰腺和消化道对蛋白质的消化能力相近。皱纹盘鲍[15]肝中的消化酶活力均高于消化道中,与杂色鲍有所差异,这可能与食性、栖息环境等有关,具体原因尚待进一步研究。
同一消化器官内各消化酶的活力也存在差异,主要是由于其对不同物质消化能力的大小不同而造成的。在最适温度和最适pH范围内,杂色鲍肝胰腺和消化道内均以纤维素酶活力最高,表明杂色鲍具有很强的纤维素消化能力,这与杂色鲍喜食江蓠等富含纤维素的饵料的摄食习性相一致[26]。无论在肝胰腺还是消化道中杂色鲍胃蛋白酶的活力都很低,这可能与杂色鲍饵料中蛋白含量低且体内 pH偏高不利于胃蛋白酶活力的发挥有关。这种现象在其他贝类中也有发现[3,5,11-12]。本研究结果与黄勃等[24]报道的一致,均是纤维素酶活力最高,与费志良等[12]对淡水蚌类消化酶活力研究的结果不同(淀粉酶活力>纤维素酶活力>蛋白酶活力)。而缢蛏[7]中则是淀粉酶和蛋白酶活力较高,纤维素酶活力极低。皱纹盘鲍[15]肝脏中与杂色鲍类似,也是纤维素酶活力最高,但消化道内则是胃蛋白酶活力最高,与杂色鲍和其他贝类明显不同。引起这些差异的原因可能主要与物种和饵料有关,因为动物的消化酶组成具有种的特异性,且与其食性密切相关。刘万顺等[9]也指出不同生物体内同一功能酶的活力与动物的遗传性及食性有关,如缢蛏[7]的主要饵料为底栖硅藻等,缺少纤维素成分,故其纤维素酶活力低,而杂色鲍成鲍主要摄食富含纤维素的江蓠等大型藻类[25-26],故同一消化器官中其纤维素酶活力显著高于其他消化酶的活力。
参考文献:
[1]杨蕙萍,童圣英,王子臣,等.国内外关于水产动物消化酶研究的概况[J].大连水产学院学报,1998,13(3):64-71.
[2]张永普,孙建礼,周化斌,等.不同年龄泥蚶几种消化酶活性的季节变化[J].动物学杂志,2003,38(4):28-31.
[3]张永普,孙建礼.温度和 pH值对广西泥蚶蛋白酶活性的影响[J].东海海洋,2004,22(1):64-69.
[4]孙建礼,张永普,高辉.温度和 pH 值对乐清养殖泥蚶蛋白酶的影响[J].水产科学,2002,21(6):7-9.
[5]倪小英,张永普,贾守菊,等.小荚蛏消化酶活性的季节变化[J].江西科学,2007,25 (3):288-291.
[6]吴众望,潘鲁青,董双林,等.9种金属离子对缢蛏消化酶活力的影响[J].中国水产科学,2003,10 (4):298-300.
[7]范德朋,潘鲁青,肖国强,等.温度、pH 对缢蛏(Sinonoraculaconstricta)消化酶活力的影响[J].海洋湖沼通报,2003,4:69-73.
[8]张硕,赵艳.栉孔扇贝蛋白酶和淀粉酶活力的初步研究[J].大连水产学报,1997,12(1):15-20.
[9]刘万顺,李濒.海洋无脊椎动物消化酶的研究 I、紫贻贝、日本鲟、滨螺消化酶的初步分析及应用[J].山东海洋学院学报,1988,18(1):54-61.
[10]魏永杰,黄斌,柯才焕,等.方斑东风螺早期发育过程中几种消化酶的活性[J].热带海洋学报,2007,26(1):55-59.
[11]安贤惠,李联泰,林春梅.几种贝类消化酶活力的比较[J].淮海工学院学报(自然科学版),2007,16(1):57-59.
[12]费志良,乔慧,赫忱,等.3种淡水蚌消化酶活力的初步研究[J].淡水渔业,2006,36(4):3-6.
[13]董志国,李家乐,李晓英,等.温度、pH和摄食作用对西施舌胃蛋白酶活力的影响[J].上海水产大学学报,2005,14(4):397-400.
[14]余方平,楼宝,王跃斌.温度和pH值对青蛤Cyclina sinensis(Gmelin)淀粉酶Amylase和蛋白酶活性Proteinase Activity的影响[J].现代渔业信息,2005,12:23-25.
[15]李太武,聂丽萍,刘金屏,等.皱纹盘鲍消化酶的研究[J].水产科学,1995,14(5):3-7.
[16]杨惠萍,童圣英,王子臣.皱纹盘鲍蛋白酶的研究[J].水产学报,1997,21(2):128-133.
[17]杨惠萍,童圣英,王子臣.皱纹盘鲍淀粉酶和褐藻酸酶的研究[J].水产学报,1998,22(4):345-351.
[18]Labara U,Fernandez R M J,Navarro J M.Enzymatic digestive activity in epfaunal(Mytiius ehilensis)and infaunal (Mulinia edulis)bivalves in response to changes in the food regimes in a natural environment[J].Marine Biology,2002,140:669-676.
[19]Zaragoza E S,Navarrete M A,Garcia-Carreflo F L.Protein-hydrolyzing enzymes in the digestive systems of the adult Mexican blue abalone,Haliotis fulgens(Gastropoda)[J].Aquaculture,1997,57:325-336.
[20]Hernandez-Santoyo A,Hernandez-Arana A,Arreguin-Espinosa R,et al.Purification and characterization of several digestive protease from the blue abalone,Haliotis fulgens[J].Aquaculture,1998,159:203-216.
[21]Erasmus J H,Cook P A,Coyne V E.The role of bacteria in the digestion of seaweed by the abaloneHaliotis midae[J].Aquaculture,1997,155:377-386.
[22]Hassett R P.Seasonal changes in feeding rate,digestive enzyme activities and assimilation eficiency ofCalanus pacificus[J].Mar Eco Pro Ser,1990,62(3):203-210.
[23]Dipadchaya S,Teerayut P,Teerasak A,et al.Digestive enzymes and in-vitro digestibility of different species of phytoplankton for culture of the freshwater pearl mussel,Hyriopsis(Hyriopsis)bialatus[J].Aquacult Int,2008(16):437-453.
[24]黄勃,王林桂,李二超,等.杂色鲍与九孔鲍消化酶活力的比较[J].水产学报,2003,27(2):119-123.
[25]马细兰,周立斌.九孔鲍无公害健康养殖技术[J].中国水产,2010,12:41-42.
[26]严正凛.九孔鲍的人工苗种生产技术[J].海洋科学,2001,25(5):8-10.
[27]潘鲁青,王克行.中国对虾幼体消化酶活力的实验研究[J].水产学报,1997,21(1):26-31.
[28]扬安刚,毛积芳,药立波.生物化学与分子生物学实验技术[M].北京:高等教育出版社,2001:247-248.
[29]周顺伍.动物生物化学[M].北京:中国农业出版社,2001:56-67.
[30]朱爱意,褚学林.大黄鱼(Pseudosciaena crocea)消化道不同部位两种消化酶的活力分布及其受温度、pH的影响[J].海洋与湖沼,2006,37(6):561-567.
[31]Biesiot P M,Capuzzo J M.Change in digestive enzyme activities during early development of the american lobsterHomarus americanus[J].Mar Biol Ecol,1990,136(2):107-122.
[32]沈文英,胡宏国,潘雅娟.温度和 pH 对南美白对虾消化酶活性的影响[J].海洋与湖沼,2002,35(6):543-548.
[33]Picos-Garcia C,Garcia-Garren F L,Serviere-Zaragoza E.Digestive Proteases in juvenile Mexican blue abalone,Haliotis fulgens[J].Aquaculture,2000(181):157-170.
[34]姜永华,颜素芬.pH值对中国龙虾消化酶活力的影响[J].动物学报,2008,54(2):317-322.
[35]Xue M X,Anderson A J,Richardson N A,et al.Characterisation of cellulase activity in the digestive system of the redclaw crayfish(Cherax quadricarinatus)[J].Aquaculture,1999,180:373-386.
[36]Fange R,Grove D.Digestion[M].New York:Academic Press,1979,8:162-260.

