两种扇贝杂交和自交家系早期生长及甲基化的比较分析
吴 彪,杨爱国,刘志鸿,周丽青,程 鹏,于 涛,2
(1.中国水产科学研究院 黄海水产研究所,农业部海洋渔业资源可持续利用重点开放实验室,山东 青岛266071;2.上海海洋大学 生命科学与技术学院,上海 201306)
杂交是动、植物种质改良的重要手段之一,通过杂交可使遗传背景不同的两个亲本遗传物质进行组合,杂合子会拥有一个全新的胞内环境和核质关系,杂合子在这种全新系统的调控下可能会产生在生长势、成活力等方面的优势。杂交育种技术已经在海水养殖贝类诸如鲍鱼[1]、牡蛎[2]、扇贝[3-4]、珠母贝[5]等多个种类中得到应用,在贝类遗传改良研究中起到了重要作用。
随着分子生物学的快速发展,研究发现DNA胞嘧啶甲基化可能与杂种优势的表达有关。所谓DNA胞嘧啶甲基化是指生物体在DNA甲基转移酶的作用下,以 S-腺苷甲硫氨酸为甲基供体,将甲基转移到胞嘧啶的5′位置上,是基因表达调控的方式之一[6]。甲基化敏感扩增多态性(methylation-sensitive amplification polymorphism,MSAP)技术由于具有简便、高效、可靠等特点逐渐成为研究DNA甲基化的主要方法之一,是利用内切酶HpaII和MspI分别与内切酶EcoRI一起对基因组 DNA进行双酶切,之后接上相应的限制性内切酶的接头,再利用接头序列设计引物进行 AFLP分析,通过扩增图谱辨别位点甲基化情况,由Reyna-López等[7]首次报道。MSAP技术已经应用到猪(Sus domesticus)[8]、牛(Bos taurus)[9]、草鱼(Ctenopharyngodon idellus)[10]、水稻(Oryza sativa)[11]等多种生物的基因组DNA甲基化研究中。
2003年以来,作者选用虾夷扇贝(Patinopecten yessoensis)与栉孔扇贝(Chlamys farreri)作为亲本进行了多年的杂交育种研究,实验结果表明,所筛选到的杂交组合虾夷扇贝♂×栉孔扇贝♀的杂交子一代成体表观性状偏向母本、遗传距离与母本相对较近,但在生长和夏季成活力方面具有明显的杂种优势[12]。作者通过一定的交配策略构建不同的家系,比较分析了扇贝杂交家系和自交家系幼虫早期生长存活差异,并运用MSAP技术分析了各家系DNA甲基化水平及其与生长性能的相关性,为研究双亲对杂交扇贝的遗传贡献,为杂种优势的研究奠定良好的基础。
1 材料与方法
1.1 亲贝来源
虾夷扇贝于2009年2月份采自于大连长海县海域,栉孔扇贝于同年3月采自于山东日照海区,于中国水产科学研究院长岛增殖实验站室内暂养育肥。
1.2 家系建立
选取性腺饱满成熟且同种类个体间大小没有差异的个体作为亲贝,以雄性虾夷扇贝(A)、雌性栉孔扇贝(B、D)、雄性栉孔扇贝(C)建立家系,交配策略如下:
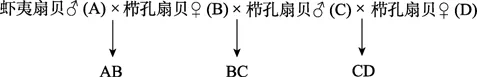
每个交配组合设3个平行组,共9个家系,分别表示为 A1B1、B1C1、C1D1、A2B2……C3D3。构建家系具体方法为,将挑选出的每个亲贝分别置于一个单独的容器内,高于育肥水温 1~2℃条件下刺激亲贝产卵排精,待精卵排出后镜检质量,并以每个卵子周围 4~6个精子的比例进行人工授精。授精在卵子排出1 h内完成,保证半同胞家系授精同步性,实验过程中杜绝交叉污染。
1.3 幼虫培育
幼虫孵化和培育过程中,每个家系幼虫都分别置于一个特制的网箱中,所有网箱放在同一个水池中以保证幼虫生长环境的统一性。授精1 h后将各个家系移入网箱中,于18℃水温下孵化。幼虫发育至D形幼虫期进行选优,并校正幼虫密度为3~5 个/mL。每天换水两次,每次1/3体积,5d倒池一次,饵料以金藻为主,配合投喂扁藻和少量硅藻。幼虫培育过程中,每2天对各家系的幼虫密度进行一次测量,根据测得的密度对各个家系进行密度均等矫正,以消除实验过程中密度因素对实验结果的影响。
1.4 数据获得及分析
用显微镜上的目微尺测量每个家系卵径;统计D形幼虫孵化情况,计算孵化率;每天从各个家系随机取样,分别测量30个个体的壳长。测量壳长时,用碘液将幼虫杀死。SPSS分析各家系间数据差异性,建立壳长与日龄的一元线性回归方程。
1.5 MSAP分析
1.5.1 DNA提取
幼虫发育至担轮幼虫、D形幼虫时,用无水乙醇固定3次,-20℃下保存。提取基因组DNA时,将幼虫置于培养皿中将无水乙醇自然挥干,1×PBS冲洗2遍后,离心去除PBS,加0.1×TE,用枪头挑取单个幼虫放在PCR管中,加入20 μL 500 μg/mL的蛋白酶K后56℃裂解1 h,95℃灭活蛋白酶K 10 min。
1.5.2 MSAP反应
参照Xiong等[11]的方法,适当优化实验条件。本实验室优化后的MASP反应步骤为:每个样品DNA设置EcoRI+MspI和EcoRI+HpaII两种酶切反应,反应体系包括400 ng DNA,3 UEcoRI(Fermentas),3 UHpaII/MspI(Fermentas),2 μL 10 × Buffer TangoTM,37 ℃水浴6 h,65 ℃酶切变性10 min。连接体系为20 μL:5 μL酶切产物,50 pmol HM接头,10 pmol E接头,5 U T4DNA Ligase(Fermentas),4 μL 5 × T4DNA Ligase Buffer,补水至20 μL,16 ℃连接过夜,产物稀释10倍用于预扩增。
预扩增体系为 20 μL:l μL 稀释连接产物,20 pmol E0和 HM0预扩引物,0.1 UTaqDNA Polymerase(Tiangen),40 pmol Mg2+,4 pmol dNTPs,2 μL 10 × Taq Buffer,补水至 20 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性30 S,56 ℃退火1 min,72 ℃延伸1 min,共进行25个循环;72 ℃10 min 。产物稀释30倍。
选择扩增体系为20 μL:3 μL稀释的预扩增产物,20 pmol HMn和5 pmol En选扩引物,其他相应组分与预扩增体系内的相同。选扩程序为:94 ℃预变性5 min;第一轮扩增为13个循环(94 ℃,30 s;65 ℃,30 s;72 ℃,1 min),退火温度每个循环降低0.7 ℃,降低到56 ℃为止;第二轮扩增为27个循环(94 ℃,30 s;56 ℃,30 s;72 ℃,1 min),72℃延伸5 min。
扩增产物与等量的变性上样缓冲液混合后,95℃变性10 min,迅速冰浴5 min,6%聚丙烯酰胺凝胶电泳60 W恒功率电泳2.5 h,电泳结束后采用银染法显色。实验所用接头及引物组合见表1。
1.5.3 甲基化率统计与分析
同一DNA分别用HpaII和MspI酶切后选扩,统计50~1500 bp的条带,计算各个家系总甲基化率,利用 SPSS 17.0进行甲基化率与壳长生长速度相关性分析。总甲基化率=(全甲基化位点数+半甲基化位点数)/总扩增位点数。
2 结果
2.1 幼虫卵径大小和孵化率
3个不同家系组合的卵径大小和孵化率统计结果如表2。结果表明,家系 AB、BC、CD卵径分别为 65.667 μm、65.778 μm、65.889 μm,没有显著差异(P>0.05);其孵化率分别为91.830 %、94.500 %、94.330 %,杂交家系稍低于自交家系,但差异不显著(P>0.05)。各家系母体来源的卵子大小在同一个水平,幼虫营养发育起点没有显著差异。

表1 所用接头和引物组合Tab.1 List of MSAP primers and adapters used
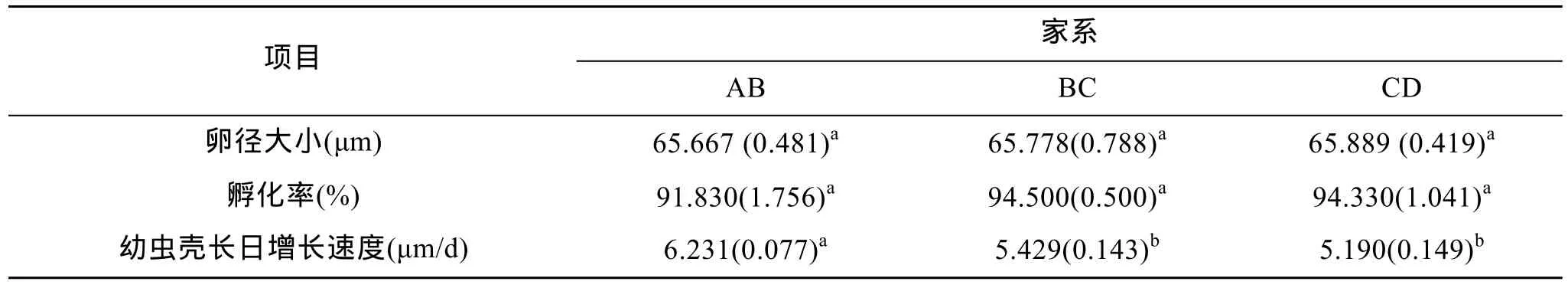
表2 不同家系卵径大小、孵化率和壳长的日增长速度Tab.2 Mean size of egg dismeter,embryonic hatching rates and daily mean growth rate of shell length for different shellfish lines
2.2 家系幼虫生长速度差异及方程建立
根据每个家系幼虫测量数据,计算各家系幼虫壳长日增长速度并建立了壳长与生长日龄的一元线性回归方程,结果如表2和表3。结果表明,家系AB、BC、CD附着前期平均生长速度分别为6.231、5.429、5.190 μm/d,杂交家系明显快于自交家系,具有显著性差异(P<0.05),而两个同父异母的半同胞自交家系幼虫间生长速度没有差异,说明杂交扇贝在生长速度方面产生了优势;各家系生长方程相关系数均达到 0.99以上,说明所建立的回归方程具有较强的代表性,符合扇贝幼虫前期生长规律。
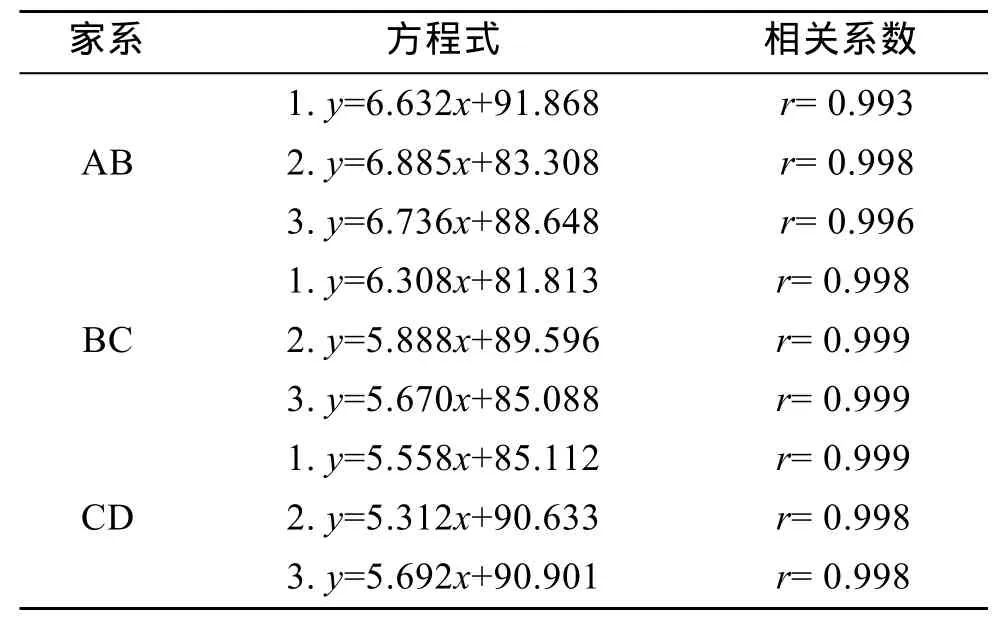
表3 各家系的壳长(y,μm)和培育时间(x,d)的线性回归方程Tab.3 Linear regression equation between shell length(y,μm) and larvae reared day (x,d) for all lines
2.3 各家系 DNA甲基化水平及其与生长速度的相关性
在40对引物组合中筛选到扩增效果好的4对组合,分别为 E2HM3、E3HM1、E3HM3、E5HM3。对各家系 20个幼虫进行扩增,各家系日生长速度及甲基化率结果见表4。AB、BC、CD的平均 DNA甲基化率分别为18.672 %、22.661 %、22.303 %,杂交家系甲基化率低于自交家系,而两个自交家系的甲基化率在同一水平。SPSS对9个家系进行DNA甲基化水平和壳长生长的相关性分析得到它们的相关系数为-0.934(表5),达到了极显著水平的负相关(P<0.01)。杂交使后代 DNA甲基化水平降低,壳长生长表现出的杂种优势与DNA甲基化水平有一定的关系。
3 讨论
3.1 构建家系的必要性
运用家系材料进行种质改良、实验研究已经在诸如合浦珠母贝(Pinctada fucata)[13]、菲律宾蛤仔(Ruditapes plilippinarum)[14]、虾夷扇贝[15]等多种贝类中得到应用。多数家系建立目的是获得某个目的性状基因的纯合系进而进行后续培育或杂交育种,如Beattie等[16]对太平洋牡蛎(Crassostreagiga)抗夏季死亡的亲本进行选择,通过建立家系进行选育耐高温太平洋牡蛎新品系,获得了耐高温能力显著提高的家系;Haskin等[17]对美洲牡蛎(Crassostrea virginica)抗孢子病(MSX)能力进行了连续4代选择,最终使得选择系抗该病能力比野生群体提高了 8~9倍。另一方面,家系材料具有明晰的亲缘谱系关系,是进行遗传研究的良好素材,比如遗传连锁图谱的构建、特定性状遗传特性的研究等都需要家系材料。群体杂交过程中,有人会质疑杂交子代身份的真实性,建立家系可以有效保证每个家系子代的双亲遗传物质来源的唯一性,杜绝“交叉污染”,为遗传研究提供可靠保障。同时,半同胞之间的差异比较能够明确父母遗传对子代的影响作用。
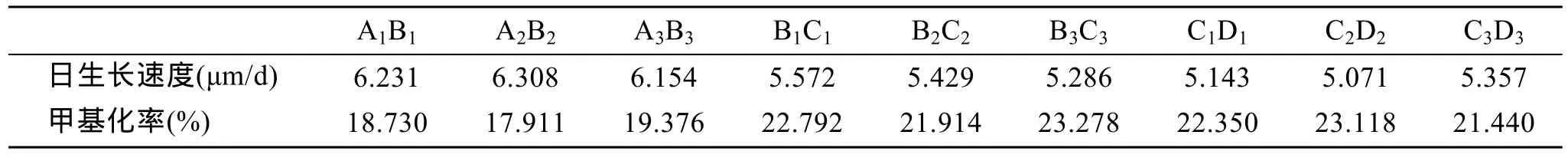
表4 各家系壳长生长速度与甲基化率Tab.4 Daily growth rate of shell length and methylation rate for all the lines
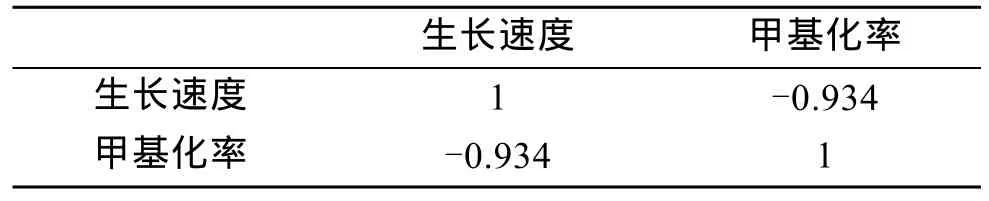
表5 生长速度与甲基化率的相关性Tab.5 The phenotype correlation coefficient between growth rate and methylation rate
3.2 幼虫前期生长及双亲对生长势的影响
贝类家系幼虫早期生长性能的研究在虾夷扇贝[15]、青蛤(Cyclina sinensis)[18]、海湾扇贝(Argopecten irradians)[19]、菲律宾蛤仔[14]等种类中已有报道。在自交家系研究中,家系幼虫在附着前期一般没有生长速度上的显著差异,但杨凤等[18]在青蛤的研究中发现有些家系前期的生长速度与其他家系存在显著差异,认为幼虫浮游期间生长速度主要是受母本影响,这种差异可能主要来自于母本。贝类杂交研究中,郑怀平等[19]对海湾扇贝杂交家系与自交家系生长的比较结果表明,杂交家系在 3日龄开始表现出显著的杂种优势而且随时间的推进逐步放大。本研究结果表明,杂交组在浮游期间壳长生长表现出杂种优势,其日平均生长速度为6.231 μm/d,比BC组提高14.77 %,与两个自交组相比均有显著性提高。自交组 BC与 CD为同父异母半同胞,它们之间卵径大小、孵化率和生长速度都没有显著性差异,说明不同的母本没有对后代造成生长发育上的显著差异。杂交组AB与自交组BC为同母异父半同胞,与CD组没有亲缘关系,杂交组卵径、孵化率均比自交组小但是差异不显著,而在生长速度上却产生了极显著的优势,说明杂交组生长速度的主要影响因素来自于父本,杂交种在浮游前期就表现出显著的杂种优势,这与郑怀平等[19]研究海湾扇贝的结果相似。本研究中,可以认为杂种的父本虾夷扇贝影响了它们的前期生长,但双亲遗传物质进行了怎样的重组融合,之后发育过程中又以什么样的方式在子代中传递来影响了子代,还需要作者今后在分子生物学方面做更多的研究。
3.3 壳长生长与DNA甲基化的相关性
除了显性效应、超显性效应、上位效应、加性效应、互补效应等,基因的差异表达也成为杂种优势形成原因的一个解释。对家畜、农作物的一些研究表明 F1代基因表达的变化决定了杂种的形状表现,而DNA甲基化作为基因调控机制之一可能会导致基因的差异表达,所以DNA甲基化在杂种优势机理研究中具有重要的意义。
很多有关动植物的研究认为杂种优势与DNA甲基化有一定的关系。Tsaftaris等[20-21]对玉米杂交种及其亲本DNA甲基化程度进行研究,发现两个亲本胞嘧啶甲基化比例分别为28.3 %和31.4 %,杂交子代为 27.4 %,基因表达活性与 DNA甲基化显著相关;蒋曹德等[8]研究猪DNA甲基化与杂种优势关系时发现,有 3种甲基化差异类型与杂种表现相关;Xiong等[11]对水稻的研究发现,某些特异位点上的甲基化程度改变会对杂种优势产生显著影响。贝类杂种优势的研究中,尚未涉及 DNA甲基化角度的研究,作者实验室尝试从DNA甲基化角度研究杂种优势,现已经取得了一些实验结果。本研究运用MSAP技术分析了扇贝杂交家系组和自交家系组DNA甲基化水平差异及幼虫早期生长性能与其相关性,其结果为杂交使得DNA甲基化比例降低,DNA甲基化与生长速度显著负相关。结合本实验室杂交扇贝群体研究结果,虾夷扇贝、栉孔扇贝的总甲基化率约为32.79%、24.13%[22],可以认为甲基化率的降低确实发生在杂交效应上,杂种优势与甲基化率具有一定的关系,与蒋曹德[8]、Xiong[11]等研究结果一致。初步认为,本杂交组合后代DNA甲基化的改变可能调控了某些基因的差异表达,在表观性状上表现的杂种优势为生长速度的加快。当然,杂种优势是一种非常复杂的遗传学效应,作者不能依此断定DNA甲基化水平的改变必然产生种优势,它们之间的联系还需要更多分子生物学方面的研究来阐释,以提升杂种优势机理的理论研究水平,让更多的杂种优势为人类应用。
[1]燕敬平,孙慧玲,方建光,等.日本盘鲍与皱纹盘鲍杂交育种技术研究[J].海洋水产研究,1999,20(1):35-39.
[2]周茂德,高允田,吴融,等.太平洋牡蛎与近江牡蛎、褶牡蛎人工杂交的初步研究[J].水产学报,1982,6(3):235-241.
[3]常亚青,刘小林,相建海,等.栉孔扇贝中国种群与日本种群杂交子一代的早期生长发育[J].水产学报,2002,26(5):385-390.
[4]陈来钊,王子臣.温度对海湾扇贝与虾夷扇贝及其杂交受精、胚胎和早期幼体发育的影响[J].大连水产学院学报,1994,9(4):1-9.
[5]王爱民,阎冰,叶力,等.马氏珠母贝不同地理种群内自繁和种群间杂交子一代主要性状的比较[J].水产学报,2003,27(3):200-206.
[6]李金梅,赵威军.作物杂种优势遗传机理的新进展[J].杂粮作物,2006,26(3):182-184 .
[7]Reyna-Lopez G E,Simpson J,Ruiz-Herrera J.Differences in DNA methylation patterns are detectable during the dimorphic transition of fungi by amplification of restriction polymorphism [J].Mol Gene Genet,1997,253(6):703-710.
[8]蒋曹德.猪DNA甲基化与杂种表现的关系及遗传多样性分析[D].武汉:华中农业大学,2004.
[9]万亚琴.DNA甲基化与肉牛杂种优势关系的初步研究[D].重庆:西南大学,2008.
[10]曹哲明,丁炜东,俞菊华,等.草鱼全同胞鱼苗不同个体甲基化位点的差异[J].动物学报,2007,53(6):1083-1088.
[11]Xiong L Z,Xu C C,Saghai M A,et al.Patterns of cytosine methylation in an elite rice hybrid and its parental lines,detected by a methylation-sensitive amplification polymorphism technique[J].Mol Gen Genet,1999,261(3):439-446.
[12]杨爱国,王清印,刘志鸿,等.栉孔扇贝与虾夷扇贝杂交及子一代的遗传性状[J].海洋水产研究,2004,25(5):1-5.
[13]陈丹群,张殿昌,李有宁,等.合浦珠母贝家系的建立及生长性状的比较[J].安徽农业科学, 2008,36(35):15493-15496.
[14]张跃环,闫喜武,杨凤,等.菲律宾蛤仔(Ruditapes plilippinarum)大连群体两种壳型家系生长发育比较[J].生态学报,2008,28(9):4246-4252.
[15]张存善,杨小刚,宋坚,等.虾夷扇贝家系的建立及不同家系的早期生长研究[J].南方水产,2008,4(5):44-50.
[16]Beattie J H,Chew K K,Hershberger W K.Differential survival of selected strains of Pacific oysters(Crassostrea gigas) during summer mortality[J].Proc Natl Shellfish Ass.1980,70:184-189.
[17]Haskin H H,Ford S E.Development of resistance to minchinianelsoni (MSX) mortality in laboratory-reared and native oysterstocks in Delaware Bay[J].Mar Fish Rev,1978,41(1-2):54-63.
[18]杨凤,张跃环,赵越,等.青蛤家系的建立及早期生长发育比较[J].水产科学,2008,27(8):390-396.
[19]郑怀平,张国范,刘晓,等.海湾扇贝杂交家系与自交家系生长和存活的比较[J].水产学报,2004,28(3):267-272.
[20]Tsaftaris A S,Polidoros A N.Studing the expression of genes in maize parental inbreds and their heterotic and nonheterotic hybrids in Proc XII Eucarpia Maize and Sorghum Conferenee[J].Bergamo,Italy,1993,283-292.
[21]Tsaftaris A S,Kafka M,Polidoros A,et al.Epigenetic changes in maize DNA and heterosis.In:Book of abstracts.The genetics and exploitation of heterosis in crops[J].An Intenational Symposium,Mexico,1997:112-113.
[22]于涛,杨爱国,吴彪,等.栉孔扇贝、虾夷扇贝及其子代的MSAP分析[J].水产学报,2010,34(9):1335-1343.

