小题大做探酸性
张 斌
(甘肃省会宁一中 甘肃 会宁 730700)
近日,笔者在高三第一轮复习“硫酸的性质”教学中,通过组织学生个别板演、集体讨论、归纳总结等形式很快完成了对硫酸酸性、吸水性、脱水性和强氧化性的再认识。为了巩固浓硫酸的强氧化性,选了一个很常见的小题,师生分析、讨论、解答后,一位同学的提问使课堂出现了意外,在一波三折的探究学习中,尽管教学没按事先预设的方案进行,但却收获了“无心插柳柳成荫”的意外之喜。尤其是课后笔者查阅各种资料和一些高规格的考试题,并和同事们进行讨论交流时发现,课例中出现的对“酸性”理解的误区,在中学化学老师中具有普遍性,于是撰文以期和同行们商榷。
一、课堂实录
……
【例题】 向25mL 18.4mol/L 的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4物质的量为( )
A.小于0.23mol B.等于0.23mol
C.0.23mol—0.46mol 之间 D.等于0.46mol
师生:一起分析:根据刚才内容复习知道,铜和浓H2SO4发生如下反应:Cu+2H2SO4(浓)=△ CuSO4+SO2↑+2H2O,由于铜片是足量的,随着反应的进行,浓H2SO4浓度逐渐下降,降到一定程度反应就会停止,本题中H2SO4的物质的量为:n=0.025L×18.4mol/L=0.46mol,如果这些硫酸全部反应,做氧化剂被还原的占其中的一半,应为0.23mol,但H2SO4消耗不完,因此被还原的H2SO4小于0.23mol。
师生讨论结束后,本该进行下一个教学环节,但有学生提问了。
生:老师,刚才分析题时说参加反应的硫酸有一半的显了氧化性的被还原了,那另一半怎么了?
因为这样的问题新授课时讨论过很多遍,所以笔者没有仔细考虑学生产生这个问题的症结所在,便随口将问题转给了全班学生。
师:同学们看,另一半的硫酸到哪儿去了?
生1:浓H2SO4和金属反应时既显酸性又显氧化性,既然一半显了氧化性,那另一半当然显了酸性。
大多数学生附和,有些学生疑惑,做思考状。
生2:(试探性的说)我一直不理解这种说法,该反应中硫酸提供的SO42-是有一半在生成物CuSO4中,另一半被还原成了SO2,但能否说参加反应的H2SO4显酸性和显氧化性的各占一半,我很困惑,老师再解释一下。
这时候笔者很奇怪,显酸性和显氧化性的各占1/2简单明了,以前阐述了好多次,怎么还困惑呢? 由于无法再做深层次的讲解,便又将问题抛给了学生。
师:那么,请大家讨论看,能否说参加反应的硫酸中显酸性的和显氧化性的各占一半?
(学生讨论很热烈,两、三分钟后,有人举手发言)
生3:我们认为,要澄清这个问题,首先要从什么是酸性(学生语气很重以示强调)的理解上来解决。所谓“酸性”就是酸的通性,刚才我们复习硫酸酸性时已经涉及,但还要仔细琢磨,为什么不同的酸具有相同的性质呢? 因为所有酸电离时产生的阳离子全部是H+,这一结构上的共同点决定了性质上的相似点,因此,我们认为酸性是酸类物质参加反应时表现在H+上的性质,既然该反应中H2SO4中的H+全部生成了H2O,应该说参加反应的H2SO4全部显了酸性(强调是H+),其中一半的被还原(强调是SO42-),所以被还原的这一半显了氧化性。
听了他的表述,笔者也恍然大悟,原来一直以来我对这个知识点没有吃透,欣喜之余又想听听其他看法,便继续引导。
师:同学们听懂他的观点了吗?
生4:老师,我同意他的观点,但这样一来,您前面写的化学方程式中就出现了错误。
她指着黑板上刚才复习H2SO4酸性时的一个方程式(BaCl2+H2SO4=BaSO4↓+2HCl)说,这个反应中H+没被消耗,所以它是硫酸的个性而非酸的通性,您刚才是把它作为酸的通性来举例的。
一石激起千层浪,这下教室里热闹了,学生们不等我引导就开始议论了。此时,我知道再也不能按既定方案教学了,干脆就让学生好好表达一下自己的观点。
师:(示意学生安静)没想到这个“小题”引出了大问题,现在请同学们畅所欲言,就“酸性”问题继续讨论,并发表看法,让别人听听你的高见。
几分钟后,学生陆续发言。
生5:化学的学习中一直强调结构决定性质,结构上的共同点决定了性质的相似点,结构上的不同点决定了性质上的递变性或不同点。各种酸电离时产生的阳离子全部是H+,这是结构上的共同点,所以表现了酸的通性,但硫酸之所以区别于其他的酸,就是它电离还产生了SO42-这一个性,因此我们要在结构的共性和个性上认识酸的通性和个性。
生6: 是啊,我们以前把BaCl2+H2SO4=BaSO4↓+2HCl;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑两个反应都当做酸的通性了,事实上前一个反应的本质是SO42-+Ba2+=BaSO4↓,是含SO42-的物质的性质,而后一个反应的本质是CO32-+2H+=H2O+CO2↑,体现了酸的通性。所以我个人认为把前者纳入酸的通性是不恰当的。类似的问题很多,现在应该厘清了。
生7: 这个问题不仅仅是浓H2SO4和Cu 等金属反应的问题,其他强氧化性的酸如浓、稀硝酸和金属反应时,也既显酸性又显氧化性。
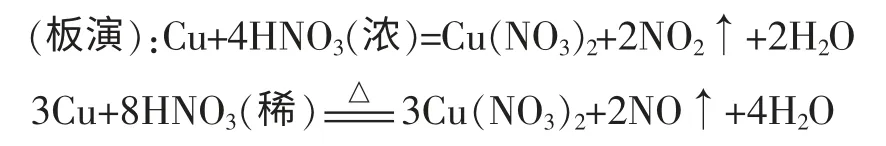
两个反应中,前者被还原的硝酸占参加反应硝酸的1/2,后者占1/4,但两个反应中参加反应的硝酸中全部H+都消耗了,不能说前者显酸性的硝酸占了总参与反应的硝酸的一半,后者占了3/4。改写成离子方程式其实更清 楚。Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;3Cu+8H++显然两个反应中酸全部消耗。
生9:这样说来,还原性的酸也有类似的问题! 请看Cl2的实验室制备中两个典型的反应原理。
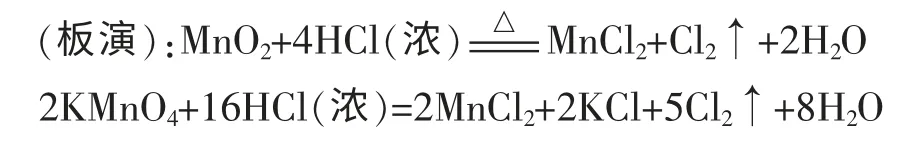
两个反应中浓盐酸都既显了酸性又显了还原性(强调和前面不一样),但前者被氧化的HCl 占了参加反应的HCl 的1/2,而后者占了5/8,但两个反应中参加反应的HCl 提供的H+全部消耗。不能说前者显酸性的HCl 占总反应的HCl 的1/2,后者占3/8。这两个反应改写成离子方程式也能清楚看到这点。
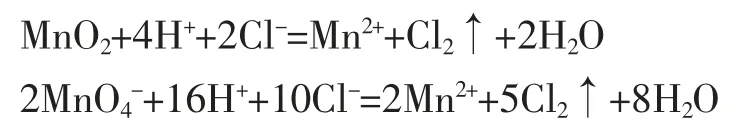
生10:以前学习了酸溶液和酸性溶液的区别,自以为对酸的通性搞清楚了,现在看来还是处于半懂的状态,刚才讨论收获挺大的。类推一下,碱的通性其实也有类似的问题,像下面这个反应(板演):
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,我一直当碱的通性中盐和碱的反应来理解,现在看来有误,因为其本质是Ca2++CO32-=CaCO3↓,该反应没发生在碱的本质特征“OH-”上,应该不能当做碱的通性的代表,但以前没想那么多。
生11:我们几个还有如下猜想,先写在黑板上,老师和同学们评判一下是否有理。
四个学生上了讲台,每人在黑板上写下了一组方程式:

离子方程式:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
写完之后该同学(生11)作了如下解释:
我们刚才讨论做了猜想,这些反应都分两步完成。第一、三组中,Ⅰ式强氧化性的酸H2SO4(浓)、HNO3(稀)把铜氧化成碱性氧化物CuO,而自身被还原成SO2、NO,碱性氧化物CuO 不能和酸共存,生成之后马上被消耗,Ⅱ式便是碱性氧化物CuO 和酸反应,两式加和就是总方程式。明显Ⅰ式中强氧化性酸被还原,但酸根离子和氢离子都被消耗,既显酸性又显氧化性,而Ⅱ式只是碱性氧化物和酸之间的复分解反应,酸根离子没被消耗,消耗的是H+,只体现了酸的酸性;第二组方程式把氧化性酸换成了还原性酸,原理一样;第四组,氧化性的碱和还原性的酸反应,第一步中和,酸显酸性、碱显碱性,但生成的Fe3+和I-不能共存,在中和的同时发生第二步反应,加和起来就是总方程式。这样想是否违背了客观事实,请老师给予评价。
(这时下课铃响了)
师: 本节课同学们对酸性的理解和探究的深刻程度,远远超越了老师的期望,但主要的观点还比较零散,希望大家课后归纳、整理,咱们在辅导课上再做探讨。
二、两点反思
1.酸性问题在中学化学课程体系中涉及知识点很多,但对于酸这类化合物体现在“酸根离子”和“H+”上的个性和共性问题,很少有人去论证,好多老师引导学生学习酸的通性时把由“酸根离子”参与的反应和由“H+”参与的反应一概算作“酸的通性”,这是有误的。本节课后笔者和同事们探讨、查阅教辅资料和专业杂志,发现好多老师对于氧化性酸(或还原性酸)既表现氧化性(或还原性)又表现酸性时的比例问题理解有误,如《化学教学》2010年第3 期上刊登杨剑老师的《化学教学中课程资源的生成性策略》一文谈到二氧化锰和浓盐酸反应时认为一半的HCl 做还原剂,另一半作酸用[1],这是值得商榷的。再如2011年甘肃省普通高中学业水平考试化学试卷选择题第10 题也犯了同样的错误,题目如下:
下列反应中酸只表现出强氧化性的是( )
A.铜与热浓硫酸 B.铜与浓硝酸
C.铜与稀硝酸 D.碳与热的浓硫酸
很显然命题人的意图是考查学生对浓硫酸、浓硝酸强氧化性的理解,认为D 选项中浓硫酸全部被还原只显了强氧化性,在前三个选项中SO42-、NO3-部分被还原成了SO2、NO2、NO,还有部分在盐CuSO4、Cu(NO3)2中出现显了酸性,所以似乎正确答案为D。岂不知,四个反应中H+都被消耗,所有酸都既显氧化性又显酸性,故该题无正确答案。
2.这是一节没有完成教学任务的课,但笔者课后将提前预设的方案和实际的课堂教学过程进行了对比,本课如果按原设计的方案展开,只是多了几个训练题,针对高考完成这些训练题是必须的,但完成这些训练题对人的培养却远远达不到这次“意外”所产生的效果,本节课学生探究学习时参与课堂的热情、讨论辨析时的语言组织、交流倾听时对别人的尊重、阐述观点时采用的方式方法、猜想假设时的灵活多变、对概念理解的深刻程度以及对概念的类比延伸等等,都是我备课时没预设到的。这就使我想到了高三的复习课,大多数老师都把课预设得十分紧凑,知识点与知识点、板块与板块、环节与环节之间过渡严谨,言简意赅,师生的大多数时间都在匆匆忙忙的知识点归纳小结、热点难点的强化训练中度过。规范严谨的预设使课堂程式化,缺乏生气和乐趣,缺乏智慧的挑战,师生的主观能动性得不到充分的发挥。其实把握住稍瞬即逝的生成性资源,耐着性子引导学生发现问题、探索问题、归纳学法、揭示规律的创造性教学,更能使学生的潜能得到充分的挖掘,个性得到充分的张扬,这是教育对老师智慧的呼唤。
[1] 杨剑.化学教学中课程资源的生成性策略[J].化学教学.2010,(3):35

