黄瓜单倍体培养的研究进展
喻艳,王辉,2(.内江师范学院生命科学学院,四川,642;2.四川省高等学校特色农业资源研究与利用重点实验室)
黄瓜单倍体培养的研究进展
喻艳1,王辉1,2
(1.内江师范学院生命科学学院,四川,641112;2.四川省高等学校特色农业资源研究与利用重点实验室)
综述了近几年来人工培养诱导产生黄瓜单倍体的研究进展,包括黄瓜单倍体的主要获得途径、影响黄瓜单倍体培养的主要因素和黄瓜单倍体培养中存在的问题,并对黄瓜单倍体培养前景进行了展望。
黄瓜;单倍体培养;影响因素;研究进展
单倍体培养是一种缩短有性育种周期、提高育种效率、快速选育植物新品种的途径,其中花药培养是人工诱导获得单倍体和纯合多倍体的有效途径之一。近年来花药离体培养的研究进展很快,目前已经有多种植物通过花药培养获得单倍体植株,其中以十字花科、茄科和禾本科植物居多[1,2]。在葫芦科蔬菜中,从20世纪80年代初开始,国内外已有不少研究单位相继开展了西瓜和甜瓜的花药培养研究。1974年,西贞夫首先对黄瓜花药培养进行了研究,并诱导出愈伤组织,分化出茎叶器官[3]。谢淼等[4]、谷佳南等[5]也相继开展了黄瓜花药培养愈伤组织诱导及再生的研究。综述了近几年国内外黄瓜单倍体培养的主要途径、影响因素及存在的问题,为进一步开展黄瓜单倍体培养提供理论参考。
1 黄瓜单倍体的获得途径
1.1 体内发生途径
体内发生即从胚囊内产生单倍体,包括自发产生、假受精、半受精、孤雄生殖和孤雌生殖等。自发产生单倍体的现象,在油菜中经常出现[6]。假受精即雌配子或雌性细胞经花粉或雄核刺激后未受精而产生单倍体植株,如玉米品种间杂交,马铃薯、苜蓿、烟草和杨树等的种间杂交都有此现象。半受精是雌雄配子都参与胚胎发生,但不发生核融合,因而产生具父母本来源的嵌合体植株。孤雄生殖是卵细胞不受精,卵核消失,或卵细胞在受精前失活,由精核在卵细胞内单独发育成单倍体,因此只含有一套雄配子染色体,这类单倍体的发生频率很低。孤雌生殖即精核进入卵细胞后未与卵核融合而退化,卵核未经受精而单独发育成单倍体,在远缘杂交中有时会出现。体内发生途径都是由不正常的受精作用而产生,育种工作中极少通过体内发生途径获得单倍体,主要通过离体诱导途径获得。
1.2 离体途径
①花药、花粉培养 a.外植体的采集时间和预处理。外植体的采集时间是决定单倍体是否能诱导成功的关键。不同种类的植物进行花药培养,其外植体的采集时间不同。单核期之前的花药结构较小、质地幼嫩易破碎,不易取材;单核期之后的花药因花瓣开始松动,微生物可能侵入花药,给材料消毒带来困难,所以一般选择处于单核期的花药进行单倍体诱导。而黄瓜花药培养外植体的采集时间多为单核中后期[4,7]。
采摘的花蕾经镜检合格后还需要进行预处理,以改变小孢子的发育方向,使尽可能多的小孢子从配子体发育途径转向孢子体发育途径,即成为具胚胎发生潜力的小孢子。不同植物预处理的方法各不相同,主要包括:低温、高温、化学物质、离心、射线等。谷佳南等[5]的研究表明,在4℃低温条件下预处理72 h的黄瓜花药培养效果最佳。
b.愈伤组织和胚状体的诱导。预处理后的花药经常规灭菌后要进行再生植株诱导。而愈伤组织和胚状体的诱导是形成再生植株的2条途径:即花药→愈伤组织→分化丛生芽→再生苗;花药→胚状体→分化丛生芽→再生苗。在黄瓜花药培养上多采用第一条途径形成再生植株。
②子房—胚珠培养 a.外植体的采集时间和预处理。外植体的采集时间一般为开花前1 d或2 d,在诱导效率上没有明显差异[7]。外植体的预处理根据基因型不同而不同,一般华北型和腌渍型可直接进行诱导[7]。
b.胚状体诱导。胚状体诱导选择MS培养基,附加NAA 0.1mg/L、2,4-D 4.0mg/L、6-BA 1.0mg/L和3%蔗糖[7]。胚状体形成过程中的关键因素除了培养基的配比外,还要注意光照条件和温度条件。可调节光周期为14 h/10 h,温度以25℃为宜。叶永亮等[7]将未完全成熟的黄瓜种子绿胚接种在MS+6-BA 0.2mg/L的培养基上,成功诱导形成了胚状体。
2 影响黄瓜单倍体培养的因素
2.1 外植体的采集时间
不同植物或同一种植物的不同品种,选择小孢子的发育时期各不相同。一般认为,黄瓜单倍体诱导多选择单核中后期的小孢子进行培养[7,8]。但谷佳南等[5]对自交7代的10个黄瓜品种的花药小孢子不同发育时期进行了诱导,结果表明,单核中期的小孢子诱导率最高,且品种间有较小的差异。分析原因可能与品种的基因型及植株的生长环境有关。
2.2 接种前的预处理
接种前的预处理对愈伤组织诱导有明显的影响,特别是在诱发小孢子脱分化方面作用十分明显。是否适时适温预处理对黄瓜愈伤组织诱导率有一定影响[8]。苏华等[8]的研究发现(表1),供试黄瓜花药经4℃低温处理24 h的诱导率较对照 (CK)略高,但差异不明显,且随着处理时间的增加,其诱导率逐渐下降,但对照下降得更快;经过48 h预处理的花药愈伤组织的诱导率比对照48 h的显著提高;而经32℃高温处理的花药材料诱导率均低于对照,其结果表明,黄瓜花药经低温预处理24~48 h有利于愈伤组织的诱导,高温预处理不利于黄瓜愈伤组织的诱导,一般以低温预处理24 h为好。
2.3 生长调节物质
研究表明,花药离体培养过程中,生长调节物质配比及其含量对愈伤组织的诱导具有重要作用,能显著影响诱导率,对愈伤组织的起源有重要调控作用[9~11]。其中代表性的激素为细胞分裂素(TDZ、6-BA、KT等)和生长素类(NAA、IAA、IBA、2,4-D等)。在使用过程中,一般几种生长调节物质配合使用比单独使用效果显著。
谷佳南等[5]对10个品种的黄瓜花药培养愈伤组织诱导时开展了6-BA、NAA和2,4-D的浓度配比试验,结果表明,在6-BA浓度相同的情况下,B5培养基上添加2,4-D的诱导效果优于NAA,其中以0.25 mg/L 6-BA+1.0 mg/L 2,4-D的诱导效果较好,愈伤组织诱导率达54.39%,但有小部分愈伤组织老化并变褐,而在上述培养基中添加1.0mg/L AgNO3对抑制愈伤组织老化有明显效果,愈伤组织诱导率增加到72.82%,其中M25和M7品种的诱导率分别为100%和93.33%。说明在B5培养基中添加1.0 mg/L 2,4-D和1.0 mg/L AgNO3诱导愈伤组织效果较好,且有明显抑制其变褐老化的作用。这可能与AgNO3抑制乙烯的形成,促进多胺的合成,从而提高胚性愈伤组织的形成有关[12]。
2.4 其他培养基成分
基本培养基种类、无机成分及配比、有机成分等的变化对黄瓜离体培养中愈伤组织的产生同样具有重要作用。有机碳源不但可以提供能源,还可作为渗透调节物质,对培养效果影响明显。多个试验结果表明,用麦芽糖替代蔗糖常常能取得更好的培养效果[13~15],但对同源四倍体水稻而言,以60 g/L蔗糖为碳源时诱导效果最好[3]。在黄瓜单倍体培养方面,以蔗糖为碳源时诱导效果较好[5,7]。
2.5 消毒方法
乔奇等[15]的研究发现,消毒方法对花药愈伤组织的形成有一定影响。一般采用的消毒方法是用75%的乙醇浸泡30 s后再用无菌水冲洗3~5次,谷佳南等[5]在进行黄瓜花药培养愈伤组织诱导及再生的研究时即采用的这种方法。
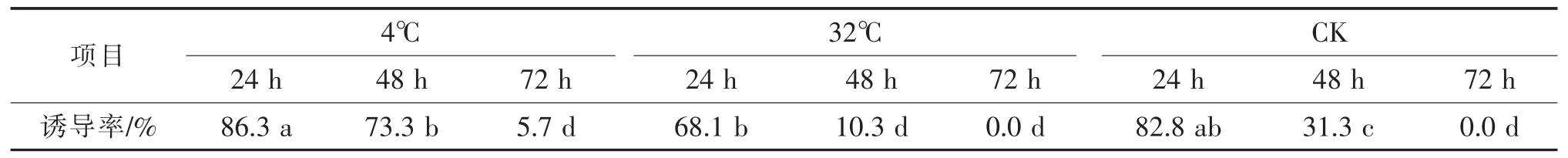
表1 不同处理方式对黄瓜花药愈伤组织诱导率的影响
2.6 其他因素
单倍体培养中,愈伤组织的诱导还受多种生理及环境因子的影响。供试植株的生理状况对愈伤组织诱导有一定影响,通常情况下幼年植株的花药对诱导的反应能力较强[8]。另外,组织学研究证实,花药壁在花粉产生愈伤组织和形成胚的过程中对其有一定影响,只有贴靠在花药壁附近的花粉才能顺利实现脱分化。这说明绒毡层起源的某些重要物质的梯度变化对愈伤诱导有重要影响[16],但其作用机理仍有待进一步深入研究。
3 黄瓜单倍体培养中存在的问题及展望
目前通过花药培养已获得成功黄瓜单倍体,并取得了可喜的进展,但仍然存在诱导率低、重复性差等问题,离建立一套成熟的培养体系还有一定距离。造成以上问题的原因主要有3点:其一,基因型差异较大;其二,培养基中外源调节剂的种类及其配比关系较难掌握;其三,愈伤组织诱导率及分化率低。
单倍体培养在黄瓜倍性育种、种质资源创新、亲本鉴定及分子生物学研究方面具有重大意义[17,18],但是单倍体育种工作道路艰难,仍需相关研究者不断努力,探索出愈伤组织诱导效率高且重复性较好的培养基配方,创造利于单倍体生长的优越环境,为黄瓜单倍体育种的后续研究打下坚实的基础。
[1]张晓晴,杨际双,郑志兴.仙客来花药培养胚状体诱导影响因素的研究[J].江苏农业科学,2009(1):57-58,108.
[2]王辉,肖小君,齐泽民,等.水稻花药愈伤组织诱导的多因子正交试验研究[J].广西植物,2011,31(4):545-549.
[3]沈海龙.植物组织培养[M].北京:中国林业出版社,2003.
[4]谢淼,秦丽颖,潘俊松,等.黄瓜花器形态发生、小孢子发育与花药培养[J].西北植物学报,2005,25(6):1 096-1 100.
[5]谷佳南,司龙亭,高兴,等.黄瓜花药培养愈伤组织诱导及再生的研究[J].江苏农业科学,2009(3):38-39.
[6]田保明.油菜单倍体培养研究进展[J].中国农学通报,1994,10(5):26-30.
[7]叶永亮,杜波,鹿娜.黄瓜单倍体育种研究进展[J].黑龙江农业科学,2009(6):160-162.
[8]苏华,金宝燕,任华中.黄瓜花药培养中若干影响因素的研究[J].沈阳农业大学学报,2006,37(3):470-471.
[9]张冰玉,苏晓华,周祥明,等.林木花药培养研究进展及展望[J].植物学通报,2003(6):656-663.
[10]张馨宇,王永成,刘爱群,等.辣椒花药培养研究新进展[J].中国农学通报,2007,23(8):331-334.
[11]张玉芳,岳岚,何松林,等.观赏植物花药培养的主要影响因素[J].中国农学通报,2008,24(6):58-61.
[12]朱迎春,孙治强,孙德玺,等.西瓜花药培养研究技术进展[J].中国瓜菜,2010(1):28-31.
[13]Dolcet-Sanjuan R,Claveria E,Huerta A.Androgenesis in Capsicum annuum L.—Effects of carbohydrate and carbon dioxide enrichment[J].JAmer Sor Hort Sci,1997,122(4): 468-475.
[14]王立浩,张宝玺,郭佳珍,等.辣椒花药培养中若干影响因素的研究[J].园艺学报,2004,31(2):232-237.
[15]乔奇,张振臣,靳秀兰等.消毒方法对草莓花药愈伤组织形成的影响[J].河南农业科学,1999(7):29.
[16]周毓君,朱宝成,郭明申,等.草莓花药愈伤组织的形成及形态发生[J].园艺学报,1996,23(2):119-122.
[17]李晓丽,徐跃进,田福发,等.秋水仙素诱导菠菜和黄瓜四倍体方法的筛选[J].湖北农业科学,2003(1):68-69.
[18]房超,林佩德,张兴平.西瓜多倍体育种新方法——利用组织培养诱导四倍体西瓜[J].中国西瓜甜瓜,1996(4):7-9.
Research Progress on Cucumber Haploid Culture
YU Yan1,WANG Hui1,2
(1.School ofLife Science,Neijiang Normal University,Sichuan,641112;2.Key Laboratory ofColleges and Universities in Sichuan forResearch and Utilization ofDistinctive Agricultural Undertakings)
This paper briefly reviewed the research progress on producing cucumber haploid by the artificial culture, including themain ways to get cucumber haploid,main factors influencing the cucumber haploid culture,existing problems and prospects of cucumber haploid culture.
Cucumber;Haploid culture;Influencing factors;Research progress
10.3865/j.issn.1001-3547.2012.18.002
四川省教育厅科研项目(10ZA014),内江市科技支撑计划项目(2010)
喻艳(1990-),女,本科在读,专业为生物技术,电话:18728102967,E-mail:yuyanmwc@163.com
王辉(1982-),男,硕士,助理研究员,研究方向为植物遗传育种,E-mail:whscnj@126.com
2012-06-28

