基因芯片方法快速检测MDR-TB及利福平和异烟肼耐药基因的研究
张海英,高会霞,许 怡
(1.河北省石家庄市第五医院皮肤科,河北石家庄050021;2.河北省石家庄市第五医院检验科,河北石家庄050021)
基因芯片方法快速检测MDR-TB及利福平和异烟肼耐药基因的研究
张海英1,高会霞2,许 怡2
(1.河北省石家庄市第五医院皮肤科,河北石家庄050021;2.河北省石家庄市第五医院检验科,河北石家庄050021)
目的使用基因芯片结合仪器法液体快速培养分析耐多药(multidrug resistant,MDR)结核分枝杆菌(mycobacterium tuberculosis,MTB)的耐药基因和表型特征。方法应用聚合酶链反应(polymerase chain reaction,PCR)扩增-基因芯片杂交法检测耐多药结核分枝杆菌(multidrug resistant tuberculosis,MDR-TB)菌株中利福平(rifampin,RFP)和异烟肼(isoniazid,INH)耐药基因的突变位点及类型,平行用BD MGIT960系统检测所选菌株对RFP和INH的敏感性。结果以MGIT960药敏结果作为参考标准,34株MDR-TB中,基因芯片检测MTB对RFP、INH药的符合率分别为85.29%和94.11%;32株RFP耐药突变株中22株为rpoB基因531位密码子突变,29株INH耐药突变株中24株为katG基因315位密码子突变。结论基因芯片技术可快速、有效地检出MDR-TB,可以在未获得传统细菌表型药敏结果前指导临床用药治疗。
分枝杆菌,结核;利福平;异烟肼;寡核苷酸序列分析
中国每年发生耐多药(multidrug resistant, MDR)结核病患者为全球最高,约占全球病例的1/4。结核分枝杆菌(mycobacterium tuberculosis,MTB)是慢生长分枝杆菌,常规的药敏试验需3~4周的时间,液体快速培养法也需要8~14d,因此结核患者通常不能得到及时有效的治疗,导致耐多药结核患者结核菌的增殖和传播。因此,创建快速、简便、准确的检测方法是实现对结核病及时有效治疗的前提条件。基因芯片是近年发展起来的一种新方法。这种方法是利用MTB耐药性与基因突变有关的分子机制,对其与耐药性相关的突变位点进行检测,根据检测位点的突变情况判断MTB的耐药性,将耐药性检测的时间缩短到3~4h。达到快速、灵敏、准确检测耐药性的目的。本研究用基因芯片技术检测MDR情况,并与液体快速培养法药敏结果进行比较。
1 材料与方法
1.1 菌株来源:34株MDR临床分离株由本院保存,已按全国结核病细菌学检验标准化规程进行菌种鉴定证实为Mtb,并用BD MGIT960系统检测所选菌株对利福平(rifampin,RFP)和异烟肼(isoniazid,INH)药均耐药。同时选取10株对RFP和INH敏感株作为对照。
1.2 试剂和仪器:美国BD公司生产的BACTEC MGIT 960 system及其配套试剂,包括MGIT 7mL培养管、含有生长因子的抗生素添加剂、药敏所需添加的抗生素。Mtb耐药检测试剂盒(芯片法)、扩增仪和微阵列芯片扫描仪等均为博奥生物有限公司提供。
1.3 基因芯片技术检测
1.3.1 样品制备:采用Extractor 36核酸快速提取仪提取核酸,置-20℃保存备用。
1.3.2 PCR扩增:每管PCR反应体系总体积为20μL,第1管为Mtb分离株DNA模板20μL和180μL PCR扩增剂1,产物为对照产物,与2种微阵列都进行杂交;第2管为Mtb分离株DNA模板20μL和180μL PCR增剂2,为rpoB基因的扩增产物,与RFP微阵列相对应;第3管为Mtb分离株DNA模板20μL和180μL PCR扩增剂3,为katG基因及inhA的扩增产物,与INH微阵列相对应;将反应体系放置基因扩增仪上进行扩增,并将扩增产物4℃保存。
1.3.3 芯片杂交及洗干:每管杂交反应混合物总体积为15μL,杂交反应混合物R为PCR扩增产物1和PCR扩增产物2各3μL及杂交缓冲液9μL,杂交反应混合物H为PCR扩增产物1和PCR扩增产物3各3μL及杂交缓冲液9μL,将杂交反应混合物加热至95℃变性5min,再冰浴3min。将杂交反应混合物R加入到HybSet基因微阵列芯片点阵1或3中,杂交反应混合物H加入到HybSet基因微阵列芯片点阵2或4中;然后放入晶芯Biomixer芯片杂交仪进行芯片反应。再将完成杂交的芯片放入晶芯SlideWasher TM芯片洗干仪中进行洗干。对于RFP耐药相关基因rpoB基因检测6个位点,包括531位TCG→TTG、531位TCG→TGG、526位CAC→GAC、526位CAC→TAC、526位CAC→CTC、526位CAC→CGC、511位CTG→CCG、513位CAA→CCA、513位CAA→AAA、516位GAC→GTC、516位GAC→TAC、516位GAC→GGC及533位CTG→CCG等13种突变型,对于INH耐药相关基因katG基因及inhA基因启动子各检测1个位点,分别为katG基因315位AGC→ACC和AGC→AAC 2个突变型,inhA基因启动子-15位C→T突变型。
1.3.4 结果判读:将洗干的芯片载入晶芯LuxScan 10KB微阵列芯片扫描仪中,自动进行结果判读。
2 结 果
2.1 基因芯片技术检测MDR-TB对RFP、INH耐药的评价结果:基因芯片技术对RFP、INH耐药情况的检测效果与金标准差异有统计学意义(P>0.05)。基因芯片技术检测RFP的灵敏度和特异度分别为94.11%和100.00%,Kappa值为0.88,阳性预测值(positive predictive value,PPV)和阴性预测值(negative predictive value,NPV)分别为100.00%和83.30%。基因芯片技术检测异烟肼的灵敏度和特异度分别为85.29%和90.00%,Kappa值为0.88,阳性预测值和阴性预测值分别为96.67%和64.28%。见表1,2。

表1 基因芯片技术检测RFP耐药情况的评价结果Table 1 The evaluation of the gene chip detection of rifampicin drug resistance
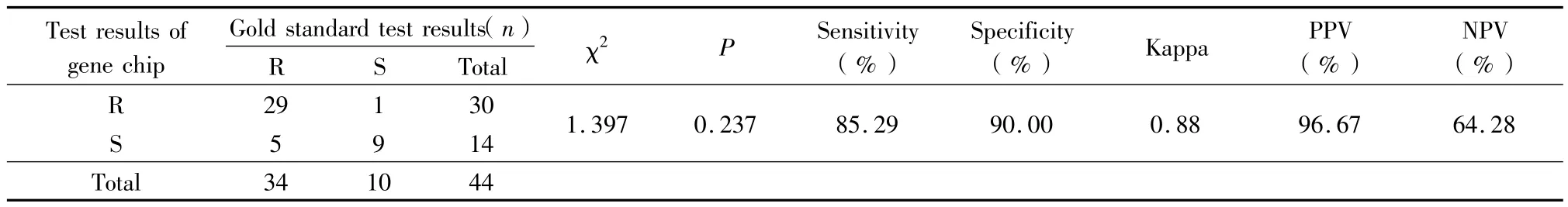
表2 基因芯片技术检测INH耐药情况的评价结果Table 2 The evaluation of the gene chip detection of isoniazid drug resistance
2.1 MDR-TB的rpoB、katG和inhA基因突变谱的分布情况:32株RFP耐药突变株中22株(68.75%)为rpoB基因531位突变,其中21株为TCG→TTG突变,1株为TCG→TGG突变;4株(12.50%)为526位突变,其中3株为CAC→GAC突变,1株为CAC→GGC突变;3株(9.37%)为516位突变,其中2株GAC→GTC突变,1株GAC→TAC突变;1株(3.12%)为511位突变,为CTC→CCG突变;1株(3.12%)为513位突变,为CAA→AAA突变;1株(3.12%)为双位点突变。29株IMH耐药突变株中24株(82.76%)为katG基因突变,其中23株为315位AGC→ACC突变,1株为AGC→AAC突变;4株(13.79%)为inhA突变的分离株均为-15位C→T突变;其中1株既有katG基因突变又有inhA突变。部分基因芯片结果见图1,2。

图1 MDR-TB利福平rpoB基因部分芯片杂交图A.516(A→T),526(C→T),531(C→T)突变型;B.513(C→A),526(A→G)突变型Figure 1 The result of rpoB gene in MDR-TB by gene chipA.516(A→T),526(C→T),531(C→T)mutant type;B.513(C→A),526(A→G)mutant type

图2 MDR-TB异烟肼katG基因部分芯片杂交图A.315(G→A)突变型inhA野生型;B.315(G→C)突变型inhA野生型Figure 2 The result of katG gene in MDR-TB by gene chipA.315(G→A)mutant type inhA wild type;B.315(G→C)mutant type inhA wild type
3 讨 论
MDR-TB是指结核病患者排出的结核分枝杆菌对至少包括INH和RFP在内的2种或以上药物产生耐药。MDR-TB比MTB敏感株引起的结核病更加难治,且病死率更高。中国的耐药性结核病情况严重,中国耐药结核患者数占世界病例总数的24%,在新增病例中MDR结核病流行比例达到了5.7%,是世界平均水平的近2倍[1]。
96%~98%的RFP耐药菌都是由于编码RNA聚合酶b亚基(rpoB)基因(RNA polymerase subunit gene)的507~533位密码子的81bp高变区域发生突变,从而不再与RFP结合而产生耐药性[2]。如此高的突变率发生在此区域内,而单耐RFP菌株又极罕见,使rpoB基因突变成为检测MDR-TB的重要标志。INH耐药株主要与katG基因和inhA启动子突变有关,katG基因主要是315位密码子AGC→ACC的突变,该突变引起过氧化氢酶活性降低导致INH耐药[3]。因此,这些区域是RFP和INH耐药株分子检测的主要靶位[4-5],应用基因芯片技术快速检出katG、inhA和rpoB基因的突变进行INH和RFP的耐药性检测,可以作为耐多药结核病的诊断指标。但同时耐药基因突变特点也因国家和地区而有所差异。因此,耐多药结核病快速诊断试剂盒在不同地区对RFP和INH耐药敏感度差异有统计学意义。有研究[6-7]显示,与DNA测序相比,基因芯片技术检测INH耐药的灵敏度和特异度均为100.00%;与传统药敏试验相比,检测RFP耐药的灵敏度和特异度分别为76.3%和80.0%。本研究结果显示检测RFP的灵敏度和特异度分别为94.11%和100.00%,检测INH的灵敏度和特异度分别为85.29%和90.00%,与我国的研究结果接近[8]。而且,本研究发现,与金标准相比,检测RFP耐药的PPV和NPV分别为100.00%和83.30%,检测INH耐药的PPV和NPV分别为96.67%和64.28%,检测RFP和INH耐药的Kappa值均为0.88,根据Kappa值判定标准,0.41~0.80为中高度,0.81~1.00为最强度,说明基因芯片技术检测RFP耐药和INH耐药的一致性为最强度。Guo等[9]研究发现,以痰标本为检测对象,与传统药敏试验相比,基因芯片技术检测INH和RFP耐药的一致率分别为787.1%和94.6%,与本研究结果相似。因此,以灵敏度、Kappa值和PPV为评价指标进行综合评价,结果发现基因芯片技术对MDR的检测效果理想,在实际应用中基因芯片技术对MDR检测结果均具有较高的可靠性和真实性。
本研究所用基因芯片可检出MDR-TB常见的基因突变位点,包括MTB耐药特定基因rpoB的8l bp核心区域、katG315密码子和inhA启动子基因突变。rpoB基因中最常见的突变位点是531位、526位和516位,并且531>526>516[10-11],本研究中检测到的最常见的突变位点也是531位、526位和516位,与报道一致。此外,6株在分析的部位未发现基因突变,有可能在本检测范围外的其他位点存在突变,或者是存在其他耐药机制,或者传统药敏试验误差所致。而耐INH主要与315位的密码子AGC→ACC的突变有关[12]。在本研究中29株INH耐药突变株中,24株(82.76%)为katG基因突变,其中23株为315位AGC→ACC突变,与张俊仙等[12]的报道一致。inhA基因编码脂肪酸转运蛋白(NADH依赖的enoyl-ACP还原酶)是分枝菌酸细胞壁合成的必需成分,活化的INH结合到NADH上抑制了依赖NADH酶的活性,抑制了分枝菌酸的合成而导致了细胞的死亡,inhA基因的突变修改了该酶,使它失去了与NADH的亲和力,导致INH耐药[13]。在本研究中4株(13.79%)INH耐药突变株与inhA基因-15位C→T突变,与报道一致[14]。
综述所述,耐多药结核病快速诊断试剂盒可以检测到绝大多数耐RFP和INH菌株,从而有效指导临床用药,且该方法以基因型为基础,重复性好,操作简便,结果判断比较容易。
[1]WHO.Multidrug and extensively drug-resistant TB(M/XDRTB):2010 global report on surveillance and response[J].WHO/ HTM/TB,2010,1(3):1-19.
[2]MUSSER JM.Antimicobial agent resistance in mycobactera: molecular gentic insights(Review)[J].Clin Micro Biol Rev,1995,8(4):465-514.
[3]MUSSERR JM,KAPUR V,WILLIAMS DL,et al.Characterization of the catalase-peroxidase gene(katG)and inhA locus in isoniazid-resistant and susceptible strains of Mycobacterium tuberculosis by automated DNA sequencing:restricted array of mutations associated with drug resistance[J].J Infect Dis,1996,173(1):196-202.
[4]DROBNIEWSKI FA,WATTERSON SA,WILSON SM,et al.A clinical,microbiological and economic analysis of a national service for the rapid molecular diagnosis of tuberculosis and rifampicin resistance in Mycobacterium tuberculosis[J].J Med Microbiol,2000,49(3):271-278.
[5]CHAOUI I,SABOUNI R,KOUROUT M,et al.Analysis of Isoniazid,StreptomycinandEthambutolresistancein Mycobacterium tuberculosis isolates from Morocco[J].J Infect Dev Ctries,2009,3(4):278-284.
[6]BANERJEE A,DUBNAU E,QUEMARD A,et al.InhA,a gene encoding a target for isoniazid and ethionamide in Mycobacterium tuberculosis[J].Science,1994,263(5144):227-230.
[7]李锋,李凫坚,陈园园,等.应用基因芯片快速检测结核分枝杆菌利福平耐药基因的研究[J].中国防痨杂志,2011,33(1):188-189.
[8]戎奇吉,吕火祥,孙爱华.基因芯片快速检测结核分枝杆菌katG基因突变及其与异烟肼耐药相关性[J].中国人兽共患病学报,2011,27(3):233-237.
[9]GUO Y,ZHOU Y,WANG,C,et al.Rapid,accurate determination of multidrug resistance in tuberculosis isolates and sputum using a biochip system[J].J Tubere Lung Dis,2009,13(2):914-920.
[10]JOU R,CHEN HY,CHIANG CY,et al.Genetic diversity of multidrug-resistant Mycobacterium tuberculosis isolates and identification of 11 novel ropB Alleles in Taiwan[J].J Clin Microbiol,2005,43(3):1390-1394.
[11]BOLOTIN S,ALEXANDER DC,CHEDORE P,et al.Molecular characterization of drug-resistant Mycobacterium tuberculosis isolates from Ontario,Canada[J].J Antimicrob Chemother,2009,64(2):263-266.
[12]张俊仙,吴雪琼,阳幼荣,等.应用基因芯片方法检测结核分枝杆菌利福平和异烟肼的耐药性[J].中国防痨杂志,2011,33(10):680-685.
[13]LUCKNER SR,LIU N,AM ENDE CW,et al.A slow,tight binding inhibitor of InhA,the enoyl-acyl carrier protein reductase from Mycobacterium tuberculosis[J].J Biol Chem,2010,285(19):14330-14337.
[14]范齐文,郭建,张慧涨,等.M/XDR-TB的快速分子检测和耐药特征分析[J].中华微生物学和免疫学杂志,2011,31(12):1133-1137.
(本文编辑:赵丽洁)
RAPID DETECTION OF DRUG RESISTANT RELATED GENES IN MULTIDRUGRESISTANT TUBERCULOSIS BY GENE CHIP AND RIFAMPIN AND ISONIAZID RESISTANCE GENE
ZHANG Haiying1,GAO Huixia1,XV Yi2
(1.Department of Dermatology,the Fifth Hospital of Shijiazhuang City,Hebei Province,Shijiazhuang 050021,China;2.Department of Laboratory,the Fifth Hospital of Shijiazhuang City,Hebei Province,Shijiazhuang 050021,China)
ObjectiveTo analyze the characteristics of phenotype and genotype of multidrug resistant tuberculosis(MDR-TB)by gene chip and liquid culture.MethodsGene chip MDR-TB kits were used for identifying the types of rifampin(RFP)and isoniazid(INH)antituberculosis drug resistant genes partly and BD MGIT960 was used for detecting the drug susceptibility.ResultsCompared with MGIT960,the coincidence rate of gene chip MTBDR plus was 85.29%and 94.11%in RFP-resistant strain and INH resistant strain in 34 MDR-TB strains;Among 32 RFP-resistant mutation strains,S531L of rpoB gene accounted for 22 strains.MTB resistant to INH was caused by the mutation of katG chiefly and the S315T1 accounted for 24 strains in 29 INH-resistant strains.ConclusionGene chip might be a rapid and effective method for the detection of MDR-TB.So,it could be used as an assistant method to guide the therapy on clinic.
mycobacterium tuberculosis;rifampin;isoniazid;oligonucleotide array sequence analysis
2012-05-16;
2012-09-27
石家庄市科技局攻关项目(11146643)
张海英(1973-),女,河北南宫人,河北省石家庄市第五医院主治医师,医学学士,从事皮肤科疾病诊治研究。
10.3969/j.issn.1007-3205.2012.12.021
R378.911
A
1007-3205(2012)12-1421-04

