百脉根ISSR-PCR反应体系的建立与优化
富新年,师尚礼,王 赞,李 俊,闫洪唯
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070;2.中国农业科学院 北京畜牧兽医研究所,北京100193)
百脉根(Lotus corniculatus)又名牛角花,是豆科百脉根属多年生草本植物,原产于欧亚温暖地区,目前,在世界各地广泛种植,具有优质、高产、抗逆性强、适口性好等特点,是一种优良牧草[1]。我国华南、西南、西北、华北等地均有分布,是温暖湿润地区极具潜力的牧草之一[2,3]。百脉根具有重要的经济、生态和社会效益,研究和开发百脉根属植物的种质资源具有十分重要的意义。目前,对百脉根种质资源遗传多样性的研究主要集中在形态学[4,5]、细胞学[6-8]以及基因工程方面的应用[9],侧重于百脉根属植物ISSR(Intersimple Sequence Repeats)分子标记的研究报道较少。因此,本试验旨在研究ISSR-PCR反应中各参数变化对实验结果的影响,并对反应体系进行优化,建立适于百脉根的ISSR反应体系,为进一步研究百脉根种群遗传多样性奠定基础。
ISSR标记是基于SSR标记技术开发出来,它避免了SSR标记开发难的缺点,是Zietkiewicz等[10]在1994年创立。基于真核生物基因组中含有大量的简单重复序列,利用单一的通用引物扩增基因组DNA,进而检测2个微卫星间DNA片段的多样性。其基本原理是在微卫星序列的一端加锚1~4个随意碱基,以此进行引物设计,PCR扩增引物两端一段反向排列的SSR序列,通过琼脂糖电泳和溴化乙锭染色,根据条带的位置和有无,进行多态性分析。凭借其稳定性强、多态性高、节约时间、财力和物力等优点,现已是广泛应用于牧草的分子标记技术之一[11,12]。
1 材料和方法
1.1 材料
选取15份来自俄罗斯的百脉根种质为实验材料。供试的种质材料均由中国农业科学院北京畜牧兽医研究所提供,于2010年10月育苗,12月采样。
1.2 基因组DNA的提取与检测
采用改进的CTAB法[13],从采集的百脉根叶片中提取DNA。用1%的琼脂糖凝胶对DNA质量进行检测,用1×TE缓冲液稀释DNA原液至50ng/mL,-20℃保存以备后用。
1.3 ISSR扩增反应
实验选取BUC811号为固定引物,其序列为GAGAGAGAGAGAGAGAC,由华大基因科技股份有限公司合成,Taq polymerase、dNTP、Mg2+缓冲液均来源于TIANGEN公司。
PCR扩增程序为:94℃预变性4min;94℃变性45s,52℃复性60s,72℃延伸1min,共35个循环;72℃延伸7min,4℃保存。
1.4 正交表的设计
采用正交设计L16(45)在4个水平上进行实验,对实验结果进行直观分析(表1,2)。根据每个组合产生条带的丰富度、清晰度,对PCR扩增结果进行打分。最高计为10分,最低计为1分。根据分数的不同,求出每因素同一水平下的实验值之和Ki以及平均值ki,并求得同一因素不同水平间平均值的极差R,从而得出百脉根ISSR-PCR反应各因素的最佳处理。
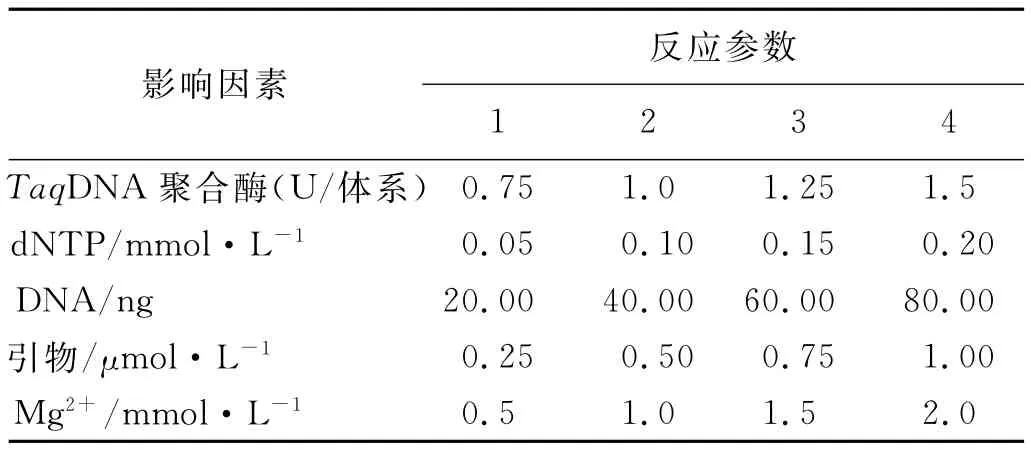
表1 ISSR-PCR反应的因素与水平Table 1 Factor-levels in ISSR-PCR reaction
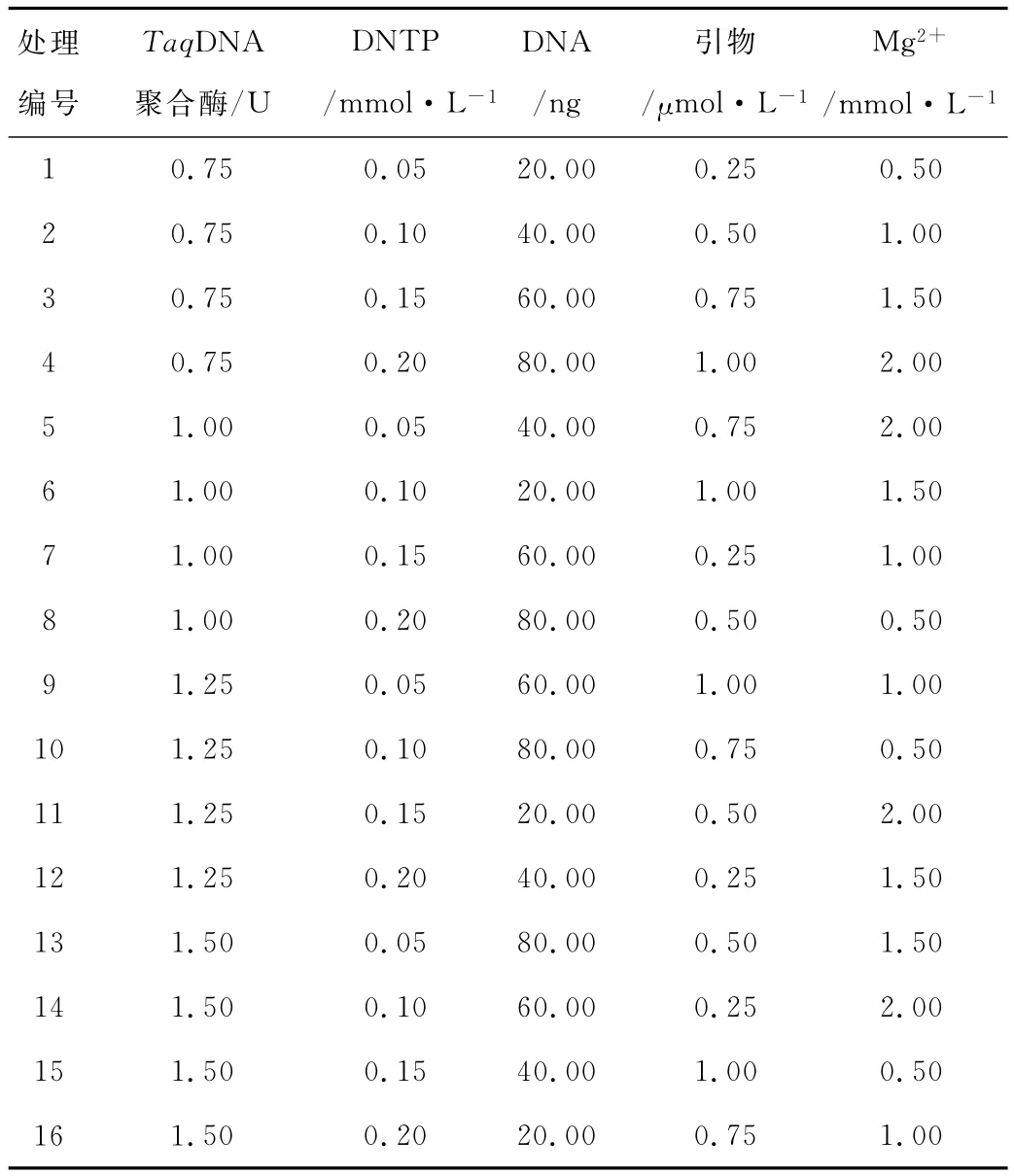
表2 ISSR-PCR正交试验设计方案Table 2 Orthogonal design in ISSR-PCR
1.5 退火温度、循环次数筛选以及体系稳定性检测
根据正交实验结果,选择最优的反应体系对退火温度和循环次数进行梯度实验,以Tm值为基准,上下浮动3℃,依次为47℃、50℃、53℃、56℃,循环次数设为30次、35次和40次。随机选取2个引物用此体系对不同模板DNA进行PCR扩增,然后用1.5%琼脂糖凝胶电泳检测,验证所得最佳反应体系的可靠性和稳定性。
2 结果与分析
2.1 正交实验结果及直观分析
正交实验PCR产物电泳16个组合的分数依次为8,8,4,1,3,9,6,6,7,7,3,7,8,7,9,8(图 1)。极差 R反应影响因素对反应体系的影响,R值越大,影响越显著。影响百脉根PCR反应的因素从大到小依次为:Mg2+>TaqDNA聚合酶>dNTPs>引物>模板DNA;单个因素的最佳反应水平分别为:TapDNA聚合酶为第2水平,Mg2+为第3水平,模板DNA为第2水平,dNTPs为第3水平,引物为第3水平。即理论最适反应水平组合为TaqDNA聚合酶1U+0.15 mmol·L-1dNTP+1.5mmol/L Mg2++20ng模板DNA+0.75μmol/L。但这一组合在正交表中并没有出现,与分值最高的6号组合比较接近,仅dNTP和引物的用量不同。ISSR-PCR反应体系中,各个因素的变化都会造成扩增结果的不同,通过对优化方案的分析,从实验效果以及经济上来综合考虑,最终确立的20μL百脉根ISSR-PCR的反应体系为:40ng模板DNA、2μL 10×PCR Buffer、0.15mmol·L-1dNTP、0.75μmol/L ISSR 引 物、1.5mmol/L MgCl2、1U TaqDNA聚合酶。
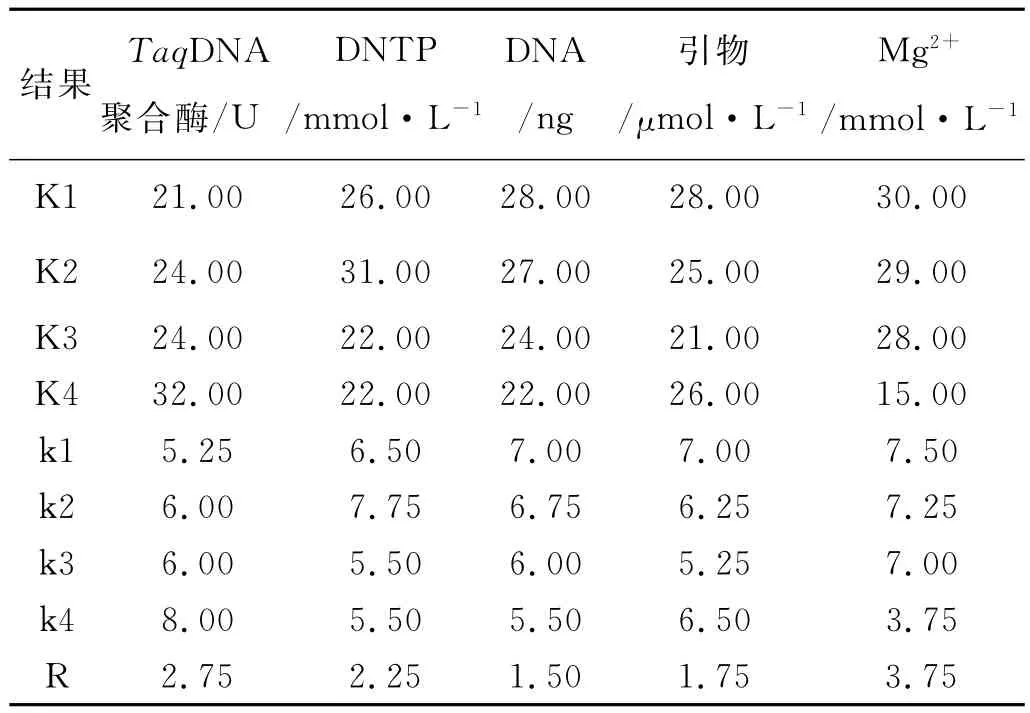
表3 正交设计直观分析Table 3 The orthogonal design of intiutive analysis
2.2 退火温度以及反应循环次数的筛选
退火温度和循环次数对ISSR扩增条带均有明显的影响(图2)。在30次循环时条带较少(泳道1~4),从泳道5~8可以看出,在循环次数相同时,随着退火温度的升高,PCR产物的亮度增加,特异性增强,最佳退火温度集中在50~55℃。从泳道2,6,9可以看出,在温度相同时,循环次数太少,产物量低,条带较弱,次数太多,导致引物二聚体增加,亲戚非特异性扩增。由图2可见,泳道7的条带最清晰,特异性最强,故以53℃退火,35次循环为最佳反应条件。
2.3 优化反应体系的稳定性检测
随机选取ISSR引物BUC817和BUC825,采用最优体系对部分百脉根种质材料进行PCR扩增(图3),能够扩增出比较清晰的条带,且稳定性较好,说明该反应体系适合于百脉根的ISSR-PCR反应。
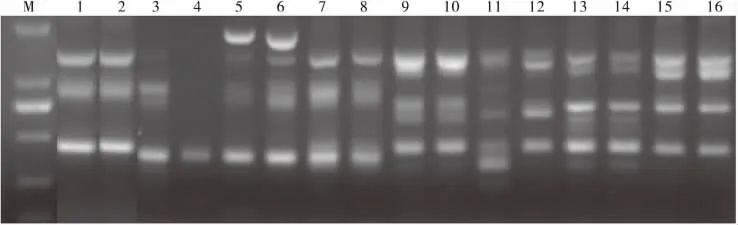
图1 ISSR反应体系正交设计扩增结果Fig.1 Amplified results of ISSR orthogonal designed reaction system
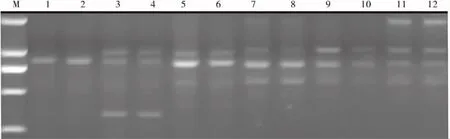
图2 不同退火温度和循环次数的扩增结果Fig.2 Effect of annealing temperatures and cycles on PCR amplification
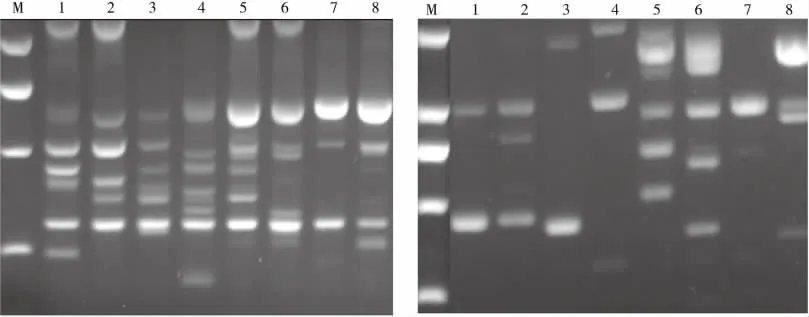
图3 不同引物在8份百脉根种质材料的ISSR扩增结果Fig.3 ISSR fingerprinting of some Lotus corniculatus germplasm
3 讨论
PCR反应是ISSR检测过程中最重要的环节,反应体系中各因素的变化均会对扩增结果造成影响。本研究采用正交设计L16(45)方法进行ISSR反应体系优化,获得适合百脉根的ISSR-PCR最适反应条件。结果表明:Mg2+浓度对反应体系的影响最大,这与王彦华等[14]研究的结果一致。Mg2+是TaqDNA聚合酶产生聚合反应的必要条件,浓度过低,则对聚合酶的活化作用不够,浓度过高又会抑制酶的活性;除此以外,Mg2+浓度与模板DNA以及dNTPs的用量均有关系[15,16],特别是dNTPs,因为dNTPs分子中的磷酸基团能定量地与Mg2+结合[17],从而产生拮抗作用,使实际反映中的Mg2+浓度下降,从而影响聚合酶的活性。而Taq DNA聚合酶则受到酶活性、反应体积等多方面的影响,酶量过小,使得扩增产量降低,甚至没有扩增,过大则出现非特异性扩增。对于dNTPs,作为PCR反应的重要底物,其用量的多少直接影响产物的产量,浓度过低就会影响PCR反应,浓度过高则会产生错误渗入,容易形成二聚体,从而影响扩增效率,并导致非特异性扩增的发生。在PCR反应体系中,引物和模板DNA的浓度过小,就会导致两者结合的机率降低,导致扩增产物的稳定性降低;浓度过大则导致扩增过量,出现弥散现象,同时有可能带入更多的杂质。因此,采取正交实验筛选法,对百脉根ISSR-PCR反应各组成成分的适宜浓度进行了研究,最终确立20μL百脉根ISSR-PCR的反应体系为:40ng模板DNA、2μL 10×PCR Buffer、0.15mmol/L dNTP、0.75μmol/L ISSR引物、1.5mmol/L MgCl2、1UTaqDNA 聚合酶。
在ISSR扩增中,退火温度和循环次数对扩增结果好坏具有明显影响。退火温度过低,容易出现背景重,弥散的条带且扩增产物少;退火温度过高,则引物与模板结合差,容易造成非特异性扩增,产物的丰富度降低。因此,只有在合适的温度下才会产生清晰的、特异性的PCR条带,在选择最佳退火温度时,如果扩增结果相近,宜选择较高退火温度以提高反应的特异性[18]。此外,不同的引物具有不同的退火温度,要根据实际情况逐一筛选,从而获得稳定可靠的标记结果。
相对于单因素设计和完全组合设计,正交设计减少了处理组合,而且考虑了各因素间的相互作用,节省了人力财力,能够较快地获得最优体系,但对结果的判断存在一定的主观性,因此,在后续的实验中还需进一步优化,提高稳定性和可靠性。研究获得ISSR反应体系可以为百脉根的后续工作提供参考,为运用ISSR分子标记技术进行百脉根种质资源的遗传多样性分析奠定一定的基础,也为百脉根种质资源鉴定,亲缘关系分析和优良品种选育等方面提供了有益参考。
[1] Davia R.Managing the Maniototo[M].Lincoln,New Zealand,AgResearch,1994:27-29.
[2] 王明玖.百脉根的优缺点及其利用管理—与紫花苜蓿比较[J].国外畜牧学-草原与牧草,1999(2):122.
[3] Duke J A.Handbook of Legumes of World Economic Importance[M].London:Plenum Press,1981.
[4] 闫向忠,曹致中,冯玉兰,等.百脉根早熟品系农艺性状初报[J].甘肃农业大学学报,2007,42(4):92-96.
[5] 崔亚飞,曹致中,马乐元.百脉根单株产量主要农艺性状的相关和通径分析[J].甘肃农业大学学报,2009,8(4):103-106.
[6] 李玉株,陶蓉,师尚礼,等.百脉根原生质体的分离和酶解条件的研究[J].草地学报,2010,18(6):798-804.
[7] 吕德扬,邓秀叶,王超,等.豆科牧草百脉根原生质体和外植体植株的再生[J].科学通报,1986,10:770-772.
[8] 刘明志.百脉根愈伤组织原生质体再生植株[J].西北植物学报,1993,16(4):403-406.
[9] 程星,包爱科,王锁明,等.百脉根基因工程研究进展[J].生物技术通报,2009,4(2):1-6.
[10] Zietkiewicz E,Rafslski A,Labuda D.Genome finger print-ing by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[11] 冯鹏,刘荣堂,张蕴薇.分子标记技术在植物空间诱变育种机理研究中的应用[J].草坪与草坪,2008(2):1-4.
[12] 李志勇,孙启忠,王小丽,等.分子标记技术在牧草种质资源研究中的应用[J].草原与草坪,2010,30(5):91-96.
[13] Saghai-Maroof M A,Soliman K M,Jorgensen R A.Ribosomal DNA spacer length polymorphism in barley[J].Proeeedings of the National Aeademy of Seiences of the United States of Ameriea,1984,81:8104-8108.
[14] 王彦华,侯喜林,徐明宇.正交设计优化不结球白菜ISSR反应体系研究[J].西北植物学报,2004,24(5):899-902.
[15] 邹喻苹,葛颂,王晓东.系统与进化植物学中的分子标记[M].北京:科学出版社,2001:16.
[16] 王家保,王令霞,刘志媛,等.芒果DNA提取方法比较及ISSR反应体系的优化[J].生物技术,2005,15(5):37-41.
[17] 杨水莲,刘卫东,马涛,等.假俭草ISSR-PCR反应体系的建立与优化[J].草原与草坪,2009(1):11-14.
[18] 穆立蔷,刘赢男,冯富娟,等.紫椴ISSR-PCR反应体系的建立与优化[J].林业科学,2006,42(6):26-31.

