α-甘露糖苷酶研究进展*
王姗姗,徐向军,路 浩*,赵宝玉*,荣 杰,庞 龙,宋岩岩,张 樑,温伟利
(1西北农林科技大学动物医学院,陕西杨凌 712100;2内蒙古阿左旗乌力吉动物卫生监督站,内蒙古阿左旗 750322)
真核细胞中蛋白质合成后需经糖苷水解酶家族加工、修饰才能发挥生物活性,目前已知的糖苷水解酶家族超过100个[1-2]。α-甘露糖苷酶多为含38、47家族保守序列的糖苷水解酶,有文献报道在糖苷水解酶92、99、125家族中也存在α-甘露糖苷酶。目前已测序的α-甘露糖苷酶基因序列超过2 000多种,主要存在于人、鼠、牛、禽类、昆虫、细菌和植物的内质网、高尔基体、溶酶体、胞浆和其他细胞器中[3-5]。α-甘露糖苷酶主要参与蛋白质糖基化和糖蛋白聚糖水解修饰。糖基化和糖蛋白聚糖水解与新生糖蛋白的折叠、成熟、分拣、运输、构象维持、半衰期和生物活性关系密切,进而对细胞的黏附作用、炎症反应、激素活性、关节炎、免疫监视和癌细胞转移等发挥作用[6]。
1 α-甘露糖苷酶的分类
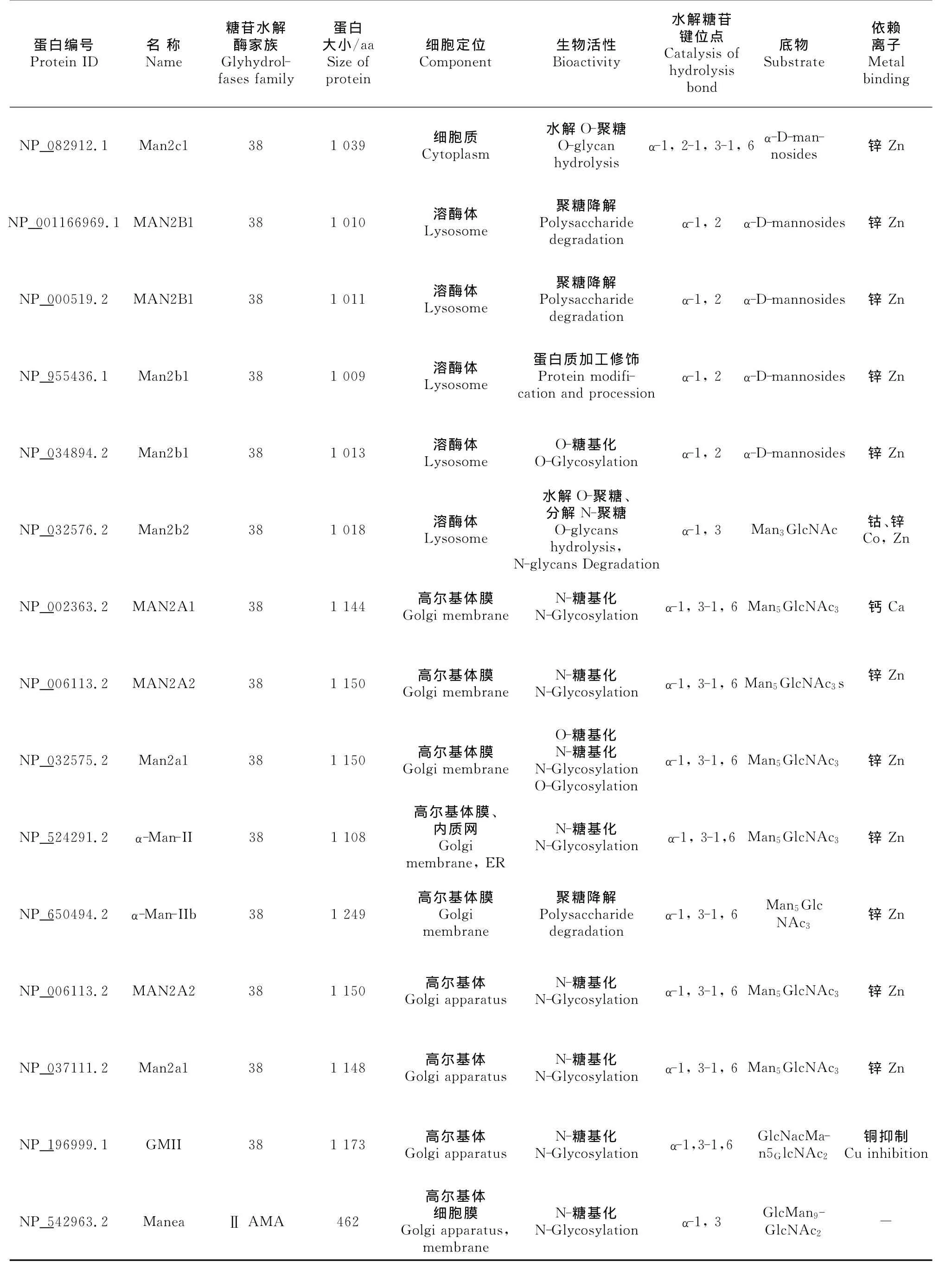
α-甘露糖苷酶分类经历了3个阶段,以酶发挥最佳活性的pH条件可分为酸性α-甘露糖苷酶、弱酸性α-甘露糖苷酶和中性α-甘露糖苷酶;以亚细胞器可分为细胞质α-甘露糖苷酶、高尔基体α-甘露糖苷酶、溶酶体α-甘露糖苷酶、内质网α-甘露糖苷酶、细胞膜α-甘露糖苷酶等。目前普遍以基因保守序列进行分类,根据α-甘露糖苷酶的基因保守序列分为3类,即Ⅰ类α-甘露糖苷酶、Ⅱ类α-甘露糖苷酶和未分类α-甘露糖苷酶[7]。部分已知的α-甘露糖苷酶见表1。
1.1 Ⅰ类α-甘露糖苷酶
Ⅰ类α-甘露糖苷酶具有糖苷水解酶47家族保守序列[8],分子质量为63ku~73ku,主要分布于内质网、高尔基体和部分细胞膜,主要是参与N-聚糖的分泌和蛋白监控[9-11]。内质网Ⅰ类α-甘露糖苷酶分为 MAN1A1/MAN1A3、MAN1B1、EDEM1、EDEM3等不同的亚型,主要作用于甘露糖α-1,2糖苷键或α-1,3糖苷键;高尔基体Ⅰ类α-甘露糖苷酶可分为 MAN1A、MAN1B/MAN1A2、MAN1C1、α-Man-Ⅰ等亚型,仅作用于甘露糖α-1,2糖苷键。
Ⅰ类α-甘露糖苷酶能将底物Man9GlcNAc2或Glc-Man9GlcNAc2水解成 Man8GlcNAc2,最终产物为Man6GlcNAc2或Man5GlcNAc2,其催化活性对钙离子具有依赖性,能被基夫碱(kifunensine)和脱氧野尻霉素(deoxymannojirmycin,dMNJ)抑制,高尔基体Ⅰ类α-甘露糖苷酶还受DMM/KIF的抑制。Ⅰ类α-甘露糖苷酶一般不受苦马豆素的抑制,或抑制作用较弱。
1.2 Ⅱ类α-甘露糖苷酶
Ⅱ类α-甘露糖苷酶具有糖苷水解酶38家族保守序列[12],分子质量为107ku~136ku,主要分布于内质网、高尔基体、溶酶体、胞质等,参与糖蛋白的合成和降解[13-15]。内质网Ⅱ类α-甘露糖苷酶主要为alpha-Man-Ⅱ,alpha-Man-Ⅱ也同时存在于高尔基体中,作用于甘露糖α-1,3糖苷键或α-1,6糖苷键;高尔基体Ⅱ类α-甘露糖苷 酶 包 括 GMⅡ、MAN2A1、alpha-Man-Ⅱb、Manea、MAN2A2等,特异性作用于甘露糖α-1,3、α-1,6糖苷键;溶酶体Ⅱ类α-甘露糖苷酶包括 MAN2B1、MAN2B2两种,特异性作用于甘露糖α-1,2、α-1,3、α-1,6糖苷键;胞质Ⅱ类α-甘露糖苷酶主要为Man2c1,能特异性作用于甘露糖α-1,2、α-1,3、α-1,6糖苷键。
Ⅱ类α-甘露糖苷酶底物为 Man5GlcNAc2、GlcNAMan5GlcNAc2,部 分 作 用 于 Man3GlcNAc2,但 对Man3GlcNAc无催化作用。Ⅱ类α-甘露糖苷酶催化活性依赖于锌离子,部分对钴离子具有依赖性,而铜离子能抑制某些Ⅱ类α-甘露糖苷酶的活性。Ⅱ类α-甘露糖苷酶活性受苦马豆素(swainsonine,SW)抑制,但抑制程度不同,其部分受dMNJ抑制。
1.3 未分类α-甘露糖苷酶
近年来,人们发现α-甘露糖苷酶不仅存在于糖苷水解酶38、47家族中,糖苷水解酶92、99、125家族中也存在α-甘露糖苷酶,这些新发现的α-甘露糖苷酶作用基本与Ⅰ类或Ⅱ类α-甘露糖苷酶作用相同,主要是催化低聚糖反应。含糖苷水解酶92家族保守序列的α-甘露糖苷酶,发现于棒状杆菌(Microbacteriumsp.M-90)和多形杆菌(Bacteroidesthetaiotaomicron),对甘露糖α-1,2、1,3、1,4、1,6糖苷键具有水解作用,且酶催化活性对钙离子具有依赖性[17]。含糖苷水解酶99家族保守序列的α-甘露糖苷酶发现亚马逊斯瓦尼菌(Shewanellaamazonensis),能水解 GlcMan9GlcNAc2-PA,Glc3Man9GlcNAc2-PA,主要作用于α-1,2糖苷键[17]。含糖苷水解酶125家族保守序列的α-甘露糖苷酶发现于肺炎链球菌(Streptococcuspneumoniae)和产气荚膜梭菌(Clostridiumperfringens),特异性作用于甘露糖α-1,6糖苷键,且对金属离子无依赖性[1](表1)。
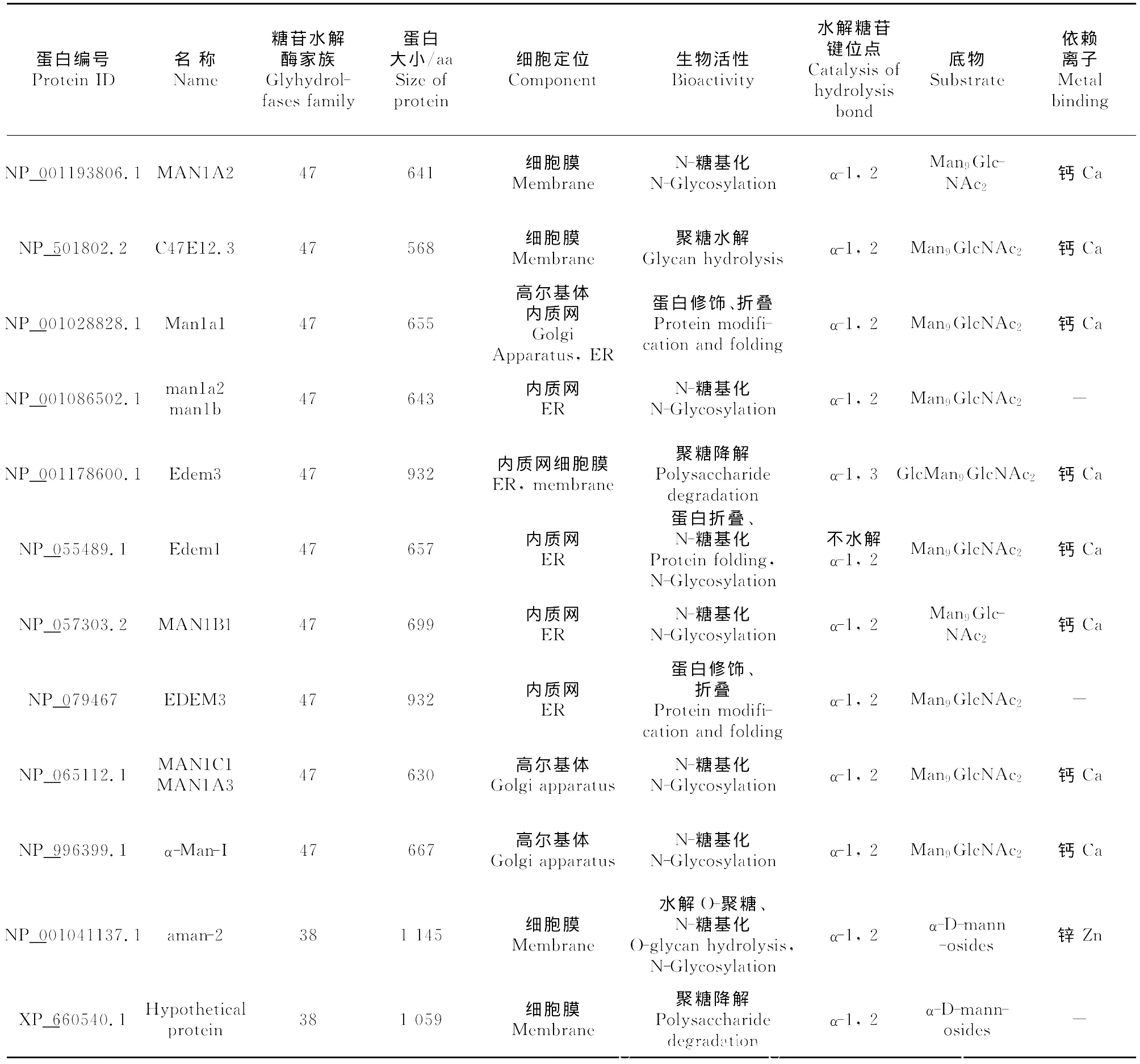
表1 部分已知的α-甘露糖苷酶Table 1Partial knownα-mannosidase
续表1
2 α-甘露糖苷酶在糖基化过程中的作用
N-糖基化是在糖基转移酶催化作用下,内分泌蛋白和膜结合蛋白结合寡糖的过程,起始阶段依赖于两个条件,即粗面内质网上核糖体合成蛋白肽链和糖基化位点的形成。当肽链进入内质网腔,内质网腔膜上的加工酶对N-糖链进行修剪、加工形成高甘露糖型,再经高尔基体膜结构上的酶加工。α-甘露糖苷酶主要负责N-糖基化过程中糖蛋白糖链上不同类型甘露糖的修剪、加工,它既是N-聚糖成熟的必要酶,同时也参与N-聚糖的降解[18]。
2.1 α-甘露糖苷酶在成熟阶段的作用
N-聚糖成熟过程中的寡聚糖前体为GLc3Man9GlcNAc2,其远端3个葡萄糖基首先被葡萄糖苷酶特异性切除,生成 Man9GlcNAc2然后经Ⅰ类α-甘露糖苷酶水解去掉4个甘露糖形成Man5GLcNAc2。Man5GLcNAc2又被N-乙酰葡糖胺转移酶Ⅰ修饰,连接一个N-乙酰葡萄糖形成GLcMan5GlcNAc2,被运输到高尔基体腔面,经Ⅱ类α-甘露糖苷酶剪切,去掉两个甘露糖形成GLcMan3GlcNAc2,再由糖酰基转移酶把单糖转运至该寡聚糖分支糖链末端,N-聚糖加工完成,加工完成的N-聚糖再被转运到特定组织及器官发挥生理功能[19](图1)。
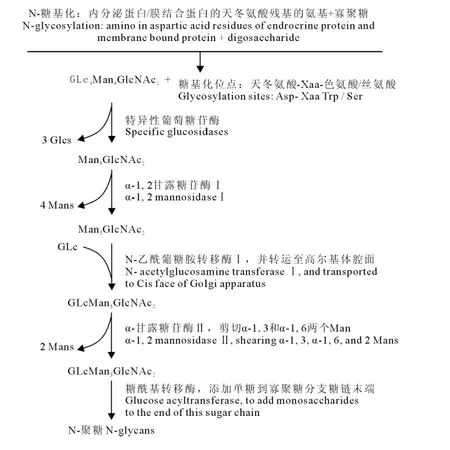
图1 N-聚糖加工过程Fig.1The N-linked glycosylation process
2.2 α-甘露糖苷酶在降解阶段的作用
当蛋白质在内质网中发生折叠错误、变异以及加工、修饰异常时,就会被选择性的降解[20-21]。糖蛋白降解主要是在溶酶体中完成,异常糖蛋白被转运到溶酶体内后,经一系列水解酶进行分解,也有部分经过细胞质途径进行降解[22]。溶酶体α-甘露糖苷酶作用于 Man5GLcNAc2上的甘露糖α-1,3和α-1,6糖苷链,对甘露糖苷残基进行剪切,产物再被糖基化或作为合成寡糖的供体。
3 α-甘露糖苷酶活性抑制的相关疾病
α-甘露糖苷酶代谢异常可引起多种疾病,目前较为常见的由α-甘露糖苷酶功能障碍引起的疾病有两种,即α-甘露糖苷贮积症(α-mannosidosis)和先天性红细胞生成异常性贫血Ⅱ型(congenital dyserythropoietic anemia typeⅡ,HEMPAS)。
3.1 α-甘露糖苷贮积症
α-甘露糖苷贮积症是由于溶酶体α-甘露糖苷酶-MAN2B1功能异常引起的[23]。当 MAN2B1出现异常时,低聚糖代谢出现功能紊乱,糖蛋白水解无法进行,导致低聚糖蓄积于溶酶体中,病理组织学变化主要表现为细胞出现广泛空泡变性,临床表现为神经、骨骼发育不全,面部粗糙、听力障碍、反复感染、肝脾肿大等症状。若患先天性溶酶体α-甘露糖苷酶功能障碍,会引起婴儿踝骨畸形、发育迟缓、运动失调、智力障碍,甚至死亡,一般无法治愈[24]。
3.2 先天性红细胞生成异常性贫血Ⅱ型
先天性红细胞生成异常性贫血属遗传性红细胞系无效造血家族性疾病,其临床特点为慢性、难治性、轻或重度贫血,伴持续或间断性黄疸,骨髓表现为红细胞系无效造血、多核、核碎裂和形态异常,主要采取支持疗法治疗。根据血细胞骨髓形态和血清学检查,先天性红细胞生成异常性贫血又分为Ⅰ、Ⅱ、Ⅲ型,Ⅱ型是一种常染色体隐性遗传疾病,因高尔基体α-甘露糖苷酶功能紊乱导致N-糖蛋白成熟过程发生异常,引起以红细胞生成障碍、骨髓红细胞多形核、红细胞膜异常、溶血为特征的疾病[25]。一般多发生于幼儿,表现为正细胞性贫血、黄疸、肝脾肿大,成熟红细胞出现PNH红细胞样改变。
4 结语
甘露糖酶在机体低聚糖代谢中起着重要的作用,代谢异常时则会导致严重疾病,近年关于通过调节α-甘露糖苷酶实现肿瘤治疗也有文献报道,这为人类战胜肿瘤提供新的研究方向。随着苦马豆素对α-甘露糖苷酶抑制作用的发现,研究人员先后利用苦马豆素成功诱导了牛和小鼠α-甘露糖苷贮积症模型,从而为进一步探索α-甘露糖苷贮积症的机制和治疗方法提供了新途径。
[1]Gregg K J,Zandberg W F,Hehemann J H,et al.Analysis of a new family of widely distributed metal-independent{alpha}-mannosidases provides unique insight into the processing of N-linked glycans[J].J Biol Chem,2011,286(17):15586-15596.
[2]Wikipedia.2011.List of glycoside hydrolase families.http://en.wikipedia.org/wiki/List_of_glycoside_hydrolase_families[2011-04-10].
[3]Shashidhara K S,Gaikwad S M.Class II alpha-mannosidase fromAspergillusfischeri:Energetics of catalysis and inhibition[J].Int J Biol Macromol,2009,44(1):112-115.
[4]Dohi K,Isoyama-Tanaka J,Misaki R,et al.Jack bean alphamannosidase digestion profile of hybrid-type N-glycans:Effect of reaction pH on substrate preference[J].Biochimie,2011,93(4):76-771.
[5]Intra J,De Caro D,Perotti M E,et al.Glycosidases in the plasma membrane of Ceratitis capitata spermatozoa[J].Insect Biochem Mol Biol,2011,41(2):90-100.
[6]Moremen K W.Golgi alpha-mannosidaseⅡ deficiency in vertebrate systems:implications for asparagine-linked oligosaccharide processing in mammals[J].Biochem Biophys Acta,2002,1573(3):225-235.
[7]刘红霞,苏卫,张连峰.α-甘露糖苷酶研究进展[J].中国比较医学杂志,2006,16(11):697-720.
[8]Liebmingera E,Hüttnera S,Vavraa U,et al.Class Iα-mannosidases are required for N-glycan processing and root development in arabidopsis thaliana[J].The Plant Cell,2009,21:3850-3867.
[9]Zhou J,Lin C Z,Zheng X Z,et al.Functional analysis of an alpha-1,2-mannosidase from magnaporthe oryzae[J].Current Genetics,2009,55(4):485-496.
[10]Hosokawa N,Tremblay L O,Sleno B,et al.EDEM1accelerates the trimming of alpha 1,2-linked mannose on the C branch of N-glycans[J].Glycobiology,2010,20(5):567-575.
[11]Mora-Montes H M,Robledo-Ortiz C I,Gonzalez-Sanchez L C,et al.Purification and biochemical characterisation of endoplasmic reticulum alpha 1,2-mannosidase fromSporothrix schenckii[J].Memorias Do Instituto Oswaldo Cruz,2010,105(1):79-85.
[12]Cobucci-Ponzano B,Conte F,Strazzulli A,et al.The molecular characterization of a novel GH38alpha-mannosidase from the crenarchaeonSulfolobussolfataricusrevealed its ability in de-mannosylating glycoproteins[J].Biochimie,2010,92(12):1895-1907.
[13]Hossain M A,Nakano R,Nakamura K,et al.Molecular characterization of plant acidic alpha-mannosidase,a member of glycosylhydrolase family 38,involved in the turnover of N-glycans during tomato fruit ripening[J].J Biochem,2010,148(5):603-616.
[14]Shashidhara,K S,Gaikwad S M.Conformational and functional transitions in class II alpha-mannosidase fromAspergillusfischeri[J].J Fluorescence,2010,20(4):827-836.
[15]Uno Y,Hashidume S,Kurita O,et al.DioscoreaoppositaThunb.alpha-mannosidase belongs to the glycosyl hydrolase family 38[J].Acta Physiologiae Plantarum,2010,32(4):713-718.
[16]Zhu Y P,Suits M D L,Thompson A J,et al.Mechanistic insights into a Ca2+-dependent family ofα-mannosidases in a human gut symbiont[J].Nat Chem Biol,2010,6(2):125-132.
[17]Matsuda K,Kurakata Y,Miyazaki T,et al.Heterologous expression,purification,and characterization of an alphamannosidase belonging to glycoside hydrolase family 99of shewanella amazonensis[J].Biosci Biotechnol Biochem,2011,75(4):797-799.
[18]Zeng Y C,Pan Y T,Asano N,et al.Homonojirimycin and N-methyl-homonojirimycin inhibit N-linked oligosaccharide processing[J].Glycobiology,1997,7(2):297-304.
[19]Daniel P F,Winchester B,Warren C D.Mammalian alphamannosidases--multiple forms but a common purpose?[J].Glycobiology,1994,4(5):551-566.
[20]Kukuruzinska M A,Lennon K.Protein N-glycosylation:molecular genetics and functional significance[J].Crit Rev O-ral Biol Med,1998,9(4):415-418.
[21]Schroder S,Matthes F,Hyden P,et al.Site-specific analysis of N-linked oligosaccharides of recombinant lysosomal arylsulfatase A produced in different cell lines[J].Glycobiology,2010,20(2):248-259.
[22]Bernon C,Carre Y,Kuokkanen E,et al.Overexpression of Man2C1leads to protein underglycosylation and upregulation of endoplasmic reticulum-associated degradation pathway[J].Glycobiology,2011,21(3):363-375.
[23]Damme M,Morelle W,Schmidt B,et al.Impaired lysosomal trimming of N-linked oligosaccharides leads to hyperglycosylation of native lysosomal proteins in mice with alpha-mannosidosis[J].Mol Cell Biol,2010,30(1):273-283.
[24]Malm D,Nilssen O.Alpha-mannosidosis[J].Orphanet J Rare Diseases,2008,3(1):doi:10.1186/1750-1172-3-21.
[25]Bianchi P,Fermo E,Vercellati C,et al.Congenital dyserythropoietic anemia type II(CDAII)is caused by mutations in the SEC23Bgene[J].Hum Mutat,2009,30(9):1292-1298.

