白介素-1β在缓激肽开放血脑屏障过程中的作用及其机制
秦丽娟,薛一雪,谷艳婷,张志勇,张 田,孙 娜,王东春,宋鸿艳
(1.中国医科大学基础医学院神经生物学教研室,辽宁沈阳 110001;2.河北联合大学基础医学院生理学教研室,河北唐山063000;3.沈阳药科大学生命科学与生物制药学院生理学教研室,辽宁沈阳 110016;4.河北联合大学附属医院神经外科,
5.河北联合大学附属唐山工人医院神经外科,河北唐山 063000;6.赤峰市松山医院内科,内蒙古赤峰 024005)
化学疗法在人体其他部位肿瘤的治疗中取得了肯定的效果,但在脑胶质瘤的治疗中却存在着很多问题。最主要的原因在于脑组织中存在血脑屏障,且在肿瘤组织中同样存在血肿瘤屏障,使得化疗药物不易达到肿瘤部位,从而给临床上脑胶质瘤的治疗带来了很大困难[1-2]。目前对于胶质瘤的化疗主要集中在先将血脑屏障和血肿瘤屏障打开,再将化疗药物注入体内,使化疗药物能够通过开放的屏障进入肿瘤组织。打开血脑屏障可以用高渗性药物如甘露醇等,但是经研究发现,这种高渗性药物虽然可以使血脑屏障开放,但其开放不具选择性,甚至往往只能开放正常血脑屏障,而对血肿瘤屏障影响不大[3]。最近,国外研究[4-7]发现,将缓激肽 B2 受体激动剂与卡铂联合作用于脑组织可选择性开放血肿瘤屏障,并在临床Ⅱ期试验中得到了证实。但有关缓激肽(bradykinin,BK)选择性开放血脑屏障的确切机制迄今尚不明了。
1 材料与方法
1.1 C6胶质瘤细胞及分组 大鼠恶性胶质瘤细胞株C6由美国UCLA提供。用高糖的DMEM培养基加10%胎牛血清培养C6细胞,37℃孵箱孵育,并通以5%的CO2。至细胞增殖至109·L-1,培养的C6细胞分别于给予缓激肽(1 μmol·L-1)后 10、30、60、120、180和240 min时取培养液2 ml于 EP管,-70℃冰箱保存备测IL-1β含量。细胞用胰酶消化后收集于EP管,-70℃冰箱保存备测HSF1的表达及IL-1β mRNA水平。
1.2 C6细胞培养液内和脑胶质瘤组织内IL-1β含量 用放射免疫法测定C6细胞培养液和脑胶质瘤组织中IL-1β的含量,试剂盒购自北京科美东雅生物技术有限公司。操作方法按照试剂盒内的操作指南进行。
1.3 C6细胞内HSF1蛋白表达及IL-1β mRNA水平测定 采用Western blot法检测C6细胞内HSF1的蛋白表达(rat monoclonal anti-HSF1购自Neomarkers公司),RT-PCR法测定C6细胞内IL-1β mRNA水平(试剂盒购自TaKaRa公司)。
1.4 实验动物及分组 选用Wistar健康♂大鼠,由中国医科大学实验动物中心提供,实验动物生产许可证号:SCXK(辽)2003-0009,体质量200~220 g,随机分为:注射 IL-1β 及缓激肽后 10、30、60、120、180和240 min组。
1.5 C6胶质瘤动物模型的建立及血脑屏障通透性测定 收集培养的C6细胞1×105/5 μl通过立体定向仪接种于动物大脑右侧尾状核,约15 d成瘤。
IL-1β处理组:成瘤后的动物以10%水合氯醛(3 ml·kg-1)麻醉后,首先经尾静脉注射2%的伊文思蓝(购自 Fluka公司)2 ml·kg-1,然后用微量输液泵经右侧颈内动脉给予IL-1β(每组动物给药终浓度为:给予缓激肽后相应时间点C6细胞培养液内IL-1β的增加量),并分别于给药后10、30、60、120、180和240 min时断头取脑,解剖显微镜下去除额极和枕极各2 mm,分离左右半球,称取左右半球湿重后,按0.1 ml·g-1脑组织加入甲酰胺溶液,60℃孵育24 h。提取液在分光光度计λ=632 nm处测定吸光度值。根据标准曲线计算脑组织伊文思蓝含量(μg·g-1wwt),间接测定血脑屏障通透性。
缓激肽处理组:实验操作过程同前,缓激肽注射量为 10 μg·kg-1·min-1。
2 结果
2.1 各组C6细胞培养液中IL-1β含量变化 给予缓激肽后,C6细胞培养液中IL-1β含量开始逐渐增加,120 min达高峰,以后又随时间推移而减少,且给予缓激肽后C6细胞培养液中IL-1β含量较给予生理盐水(NS)组明显增加(如Tab 1)。
2.2 C6细胞内IL-1β的mRNA水平 细胞给予缓激肽后,IL-1β的mRNA水平开始升高,60 min达高峰,以后又随时间推移而逐渐减少(如Fig 1)。
2.3 C6细胞内HSF1的表达 细胞给予缓激肽后,HSF1三聚体的表达于第30 min迅速达高峰,以后随时间推移而减少,但仍明显高于对照组(Fig 2)。表明C6细胞在缓激肽作用下,HSF1由无活性的单体形式转变为有活性的三聚体形式而被激活。
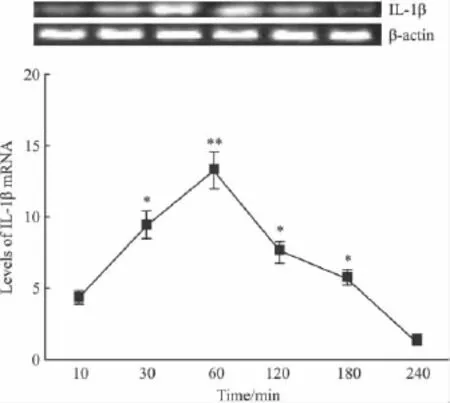
Fig 1 IL-1β mRNA levels of C6 cells after bradykinin treatment(n=15)
Tab 1Contents of IL-1β in the nutrient fluid of C6 cells by BK(μg·L-1,±s,n=15)
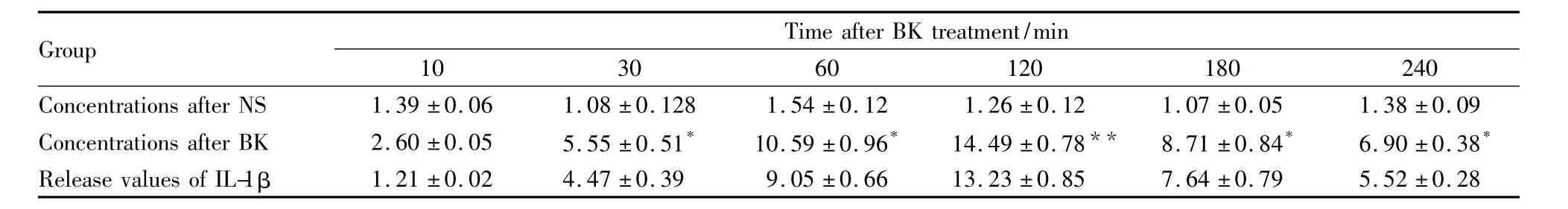
Tab 1Contents of IL-1β in the nutrient fluid of C6 cells by BK(μg·L-1,±s,n=15)
*P <0.05,**P <0.01 BK group vs NS group
Group Time after BK treatment/min 10 30 60 120 180 240 Concentrations after NS 1.39 ±0.06 1.08 ±0.128 1.54 ±0.12 1.26 ±0.12 1.07 ±0.05 1.38 ±0.09 Concentrations after BK 2.60 ±0.05 5.55 ±0.51* 10.59 ±0.96* 14.49 ±0.78** 8.71 ±0.84* 6.90 ±0.38*Release values of IL-1β 1.21 ±0.02 4.47 ±0.39 9.05 ±0.66 13.23 ±0.85 7.64 ±0.79 5.52 ±0.28
2.4 缓激肽组与对照组大鼠的肿瘤组织内IL-1β含量 实验大鼠注射缓激肽后,瘤组织内IL-1β含量开始增加,于120 min时达高峰后开始减少。而对照组动物脑组织内的IL-1β含量未见明显变化(Fig 3)。
2.5 血脑屏障通透性 动物注射IL-1β及缓激肽后伊文思蓝含量增加,且均于120 min时达高峰,其后随时间推移而减少,但仍高于对照组(Fig 4),说明缓激肽引起血脑屏障开放程度最大时,肿瘤组织内IL-1β含量也最多。
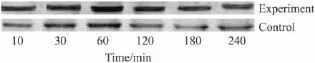
Fig 2 HSF1 trimer expression in C6 cell after bradykinin treatment(n=15)
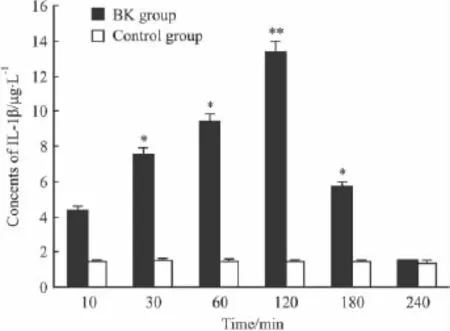
Fig 3 IL-1β concentrations of neurospongioma after BK treatment(n=8)
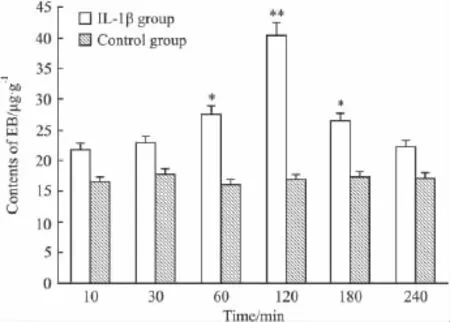
Fig 4 Evans blue concentrations of neurospongioma after BK/IL-1β treatment(n=8)
3 讨论
缓激肽是近年发现的可选择性开放血脑屏障的药物[8-10]。实验证实,给RG2脑胶质瘤大鼠颈内动脉注射小剂量缓激肽(10 μg·kg-1·min-1)可选择性地增加脑肿瘤对示踪剂(分子质量100~70 000 u)的通透性,且分子越大,作用越强[11]。在临床观察中也证实了其选择性开放血脑屏障的作用[4],但有关其开放血脑屏障的确切机制目前尚不十分明了。
本研究发现,经颈内动脉小剂量缓慢注射缓激肽,可选择性增加C6胶质瘤模型大鼠的血脑屏障通透性,且缓激肽作用于培养的C6细胞后,培养液中IL-1β含量增加,于120 min达高峰,这与缓激肽开放血脑屏障峰值相一致。由此推测缓激肽开放血脑屏障可能与缓激肽促进脑胶质瘤细胞释放IL-1β有关。为此我们又测定了C6大鼠给予缓激肽后肿瘤组织内IL-1β含量,发现脑胶质瘤内IL-1β含量随给予缓激肽时间的延长而增加,同样于120 min达高峰,以后又随时间推移而减少,进一步说明缓激肽开放血脑屏障可能与IL-1β有关,而且很可能是缓激肽通过刺激C6细胞释放IL-1β所引起。其后我们应用了C6细胞给予缓激肽后培养液中不同时间点的IL-1β浓度来观察动物模型血肿瘤屏障通透性,发现以最大IL-1β浓度(即给予缓激肽后120 min时培养液的IL-1β增加量)作用于胶质瘤大鼠,其血肿瘤屏障的通透性最大,进一步证实缓激肽开放血脑屏障的机制可能是通过刺激胶质瘤细胞释放IL-1β所引起的。
有关缓激肽是如何能引起胶质瘤细胞释放IL-1β的,我们通过查阅文献发现其可能与HSF1有关。众所周知,任何应激都会引起机体产生一种保护性蛋白质HSP70,缓激肽作为一种应激刺激同样会引起体内HSP70的产生。合成HSP70受HSF1的调控,HSF1通过与热休克元件(HSE)结合并使之发生磷酸化,激活hsp70基因,HSP70表达增多。通过对hsp70和IL-1β基因启动子同源性调查发现,IL-1β基因启动子中也含有与hsp70基因上游相同的完整HSE序列。HSF1能特异性结合到IL-1β基因启动子的“HSE”序列上,且亲和力与HSF1对hsp70基因的 HSE 结合类似[12],HSF1与 IL-1β 基因启动子的“HSE”序列结合同样会影响IL-1β基因的表达。因此,我们在实验研究中观察了C6细胞在给予缓激肽后的HSF1表达情况,发现给予缓激肽后的C6细胞,其HSF1的表达于30 min达高峰,而IL-1β基因的表达于60 min达高峰,推测这可能是由于缓激肽作为一种应激刺激首先引起HSF1蛋白表达增加,增加的HSF1蛋白再与IL-1β基因启动子的“HSE”序列结合,从而使IL-1β基因的表达和释放增多,进而引起血脑屏障开放。
有关缓激肽开放血脑屏障的机制研究正在一步步展开,我们也一直在致力于此方面的研究工作。相信随着对此方面研究的进一步深入,一定会使缓激肽开放血脑屏障的机制更加明了,从而实现在临床工作中控制并最终治愈胶质瘤的目的。
[1] Harford-Wright E,Lewis K M,Vink R.Towards drug discovery for brain tumours:interaction of kinins and tumours at the blood brain barrier interface[J].Recent Pat CNS Drug Discov,2011,6(1):31 -40.
[2] Thompson E M,Frenkel E P,Neuwelt E A.The paradoxical effect of bevacizumab in the therapy of malignant gliomas[J].Neurology,2011,76(1):87 -93.
[3] Pan G Y,Liu X D,Liu G Q.Intracarotid infusion of hypertonic mannitol changes permeability of blood-brain barrier to methotrexate in rats[J].Acta Pharmacol Sin,2000,21(7):613 - 6.
[4] Borlongan C V,Emerich D F.Facilitation of drug entry into the CNS via transient permeation of blood brain barrier:laboratory and preliminary clinical evidence from bradykinin receptor agonist,Cereport[J].Brain Res Bull,2003,60(3):297 -306.
[5] Uchida M,Chen Z,Liu Y,et al.Overexpression of bradykinin type 2 receptors on glioma cells enhances bradykinin-mediated bloodbrain tumor barrier permeability increase[J].Neurol Res,2002,24(8):739-46.
[6] Easton A S,Abbott N J.Bradykinin increases permeability by calcium and 5-lipoxygenase in the ECV304/C6 cell culture model of the blood-brain barrier[J].Brain Res,2002,953(1-2):157 - 69.
[7] Emerich D F,Dean R L,Osborn C,et al.The development of the bradykinin agonist labradimil as a means to increase the permeability of the blood-brain barrier:from concept to clinical evaluation[J].Clin Pharmacokinet,2001,40(2):105 -23.
[8] Lumenta D B,Plesnila N,Klasner B,et al.Neuroprotective effects of a postischemic treatment with a bradykinin B2 receptor antagonist in a rat model of temporary focal cerebral ischemia[J].Brain Res,2006,1069(1):227 -34.
[9] Warren K,Gervais A,Aikin A,et al.Pharmacokinetics of carboplatin administered with lobradimil to pediatric patients with brain tumors[J].Cancer Chemother Pharmacol,2004,54(3):206 -12.
[10]秦丽娟,谷艳婷,薛一雪.缓激肽开放血瘤屏障过程中诱发快速耐受性的机制探讨[J].中国药理学通报,2006,22(12):1466-70.
[10] Qin L J,Gu Y T,Xue Y Y.Mechanism of achyphylaxis to bradykinin in opening blood-brain barrier[J].Chin Pharmacol Bull,2006,22(12):1466 -70.
[11] Emerich D F,Snodgrass P,Dean R,et al.Enhanced delivery of carboplatin into brain tumours with intravenous Cereport(RMP-7):dramatic differences and insight gained from dosing parameters[J].Br J Cancer,1999,80(7):964 - 70.
[12] Cahill C M,Waterman W R,Xie Y,et al.Transcriptional repression of the prointerleukin 1beta gene by heat shock factor 1[J].J Biol Chem,1996,271(40):24874 -9.

