利用甲醇厂CO2 尾气培养小球藻*
陈霖,李林声,王明兹,李兴龙,郑行,陈必链
1(福建师范大学 工业微生物教育部工程研究中心,福建 福州,350108)2(福建师范大学生命科学学院,福建 福州,350108)3(江苏索普集团有限公司,江苏 镇江,212000)4(福清市新大泽螺旋藻有限公司,福建 福清,350300)
近年频发的全球温度升高、海平面上升、洪水泛滥和暴风雨等极端灾害性气候都与温室气体的过量排放密切相关,由此引起的生态系统的改变将严重影响人类的各项活动。其中电厂、水泥厂等工业锅炉的烟道尾气是CO2等温室气体的主要排放源[1]。在诸多控制大气污染的技术中,微藻生物技术固定CO2被认为是一种经济高效和具有前景的新方法[2]。采用工业烟道气替代纯净CO2作为微藻生长的碳源,将大大降低微藻生产成本,同时又能够降低烟道气CO2的环境排放量,对于减缓温室效应和控制全球变暖具有重要意义[3]。
目前国内外对利用微藻进行CO2尾气吸收和利用的研究集中在火电厂、水泥厂和酒精发酵车间等的烟道气[4-8],但是对甲醇厂排放的高浓度CO2尾气进行研究的文章尚未见报道。江苏索普集团有限公司甲醇厂所产生的高浓度CO2尾气每年有1.8 ×105t 用于生产醋酸,但仍有7.4 ×105t CO2直接排向大气,增加环境压力。小球藻为绿藻门单细胞藻类,光合效率高,富含蛋白质、不饱和脂肪酸、类胡萝卜素、叶黄素、虾青素和多种维生素,具有较高的营养价值和提高免疫力的功能;它是国内外用于研究CO2固定的常用微藻种类,如Borkenstein[6]等用小球藻固定水泥厂尾气CO2的效果与利用纯净的CO2进行培养时的效果基本相当;Douskova[9]等利用小球藻固定CO2含量为10% ~13%的工业尾气时效果比利用纯净的CO2培养时的效果更好,同时还降低了生产成本;Matsukawa[10]等利用小球藻固定CO2的同时获得较高含量的抗氧化剂;Keller[11]等利用小球藻脱除空气中的CO2,脱除速率达到63.9 g/(m3·h);高春燕[12]等利用小球藻在光生物反应器中脱除空气中的CO2,其脱除CO2的能力约为118 g/(m3·h)。本文利用江苏索普集团有限公司甲醇厂所产生的高浓度CO2尾气作为碳源并结合不同的通气和培养方式培养小球藻,为以甲醇厂CO2尾气为碳源的微藻规模化养殖奠定基础。
1 材料与方法
1.1 藻种
小球藻(Chlorella sp. )由福建省福清市新大泽螺旋藻有限公司提供。
1.2 CO2 尾气
CO2尾气直接来源于江苏索普集团有限公司甲醇厂生产车间排放的高浓度CO2尾气,尾气气体组成为:99.13% CO2、0.65% O2和0.22% CO。
1.3 小球藻的培养和实验条件设置
将生长至对数生长期的藻种接种到1 L 的三角烧瓶中,装液量为800 mL,起始OD 约为0.150,培养温度(26 ±1)℃,光照由3 组30 W 荧光灯提供,光照强度约为3 000 lux,光暗周期为24 h∶0 h。
进行CO2浓度对小球藻生长的影响实验时,高浓度CO2尾气通过微型空气泵和气体流量计配成CO2浓度分别为10%、20%、30%、40%、50%、60%、80%和纯尾气的气体,以通空气组为对照组,通气流速均为300 mL/min。每个处理均设置2 个平行样,下同。
进行气体流速实验时,保持培养温度、光照强度和装液量不变,通入CO2浓度为10%的混合气体,气体流速设置为200、300、400 和500 mL/min,以300 mL/min 空气组做对照。
进行通气方式实验时,保持培养温度、光照强度和装液量不变,通入CO2浓度为10%的混合气体,通气方式分别采用连续、间歇和递增通气3 种方式。间歇通气方式设置为5、10、20 和30 min/h;连续通气为持续通气;递增通气方式设置为每两天递增10 min/h,起始通气流速为5 min/h。
进行分批补料培养实验时,保持培养温度、光照强度和装液量不变,通入CO2浓度为10%的混合气体,通气速率为300 mL/min。培养基中的氮源(尿素)和磷源(KH2PO4)采用流加方式添加,其余营养物质基础料中投入。尿素和KH2PO4的起始添加量分别设置为总量的30%、40%、50%和60%,从培养第3 天开始流加,连续流加4 天。以一次性投入全部氮源和磷源的分批培养为对照。
进行半连续培养实验时,保持培养温度、光照强度和装液量不变,通入CO2浓度为10%的混合气体,通气速率为300 mL/min。当小球藻生长到对数期末期时开始进行半连续培养,更新周期为24 h,更新率R 设置为10%、20%、30%、40%、50%。
进行冰醋酸实验时,保持培养温度、光照强度和装液量不变,通入CO2浓度为10%的混合气体,通气速率为10 mL/min。进行一次性添加和流加试验,一次性添加冰醋酸浓度分别为0 μL/L、50 μL/L、75 μL/L、100 μL/L、125 μL/L 和150 μL/L。以通空气并不添加冰醋酸组为对照。流加冰醋酸试验,冰醋酸流加量分别为10、15、20、25 μL/(L·d)和一次性添加100 μL/L 的分批培养,连续添加5 d,以通入300 mL/min 空气并不添加冰醋酸组为对照。
1.4 藻细胞干重测定
将15 mL 小球藻液加入烘干至恒重的离心管中,4 000 r/min 离心15 min,倒去上清液,用蒸馏水清洗2 次,离心所得藻泥敞口放置于80 ℃烘箱,约烘至恒重,每个梯度3 个重复样,称重后取平均值。
1.5 比生长速率的测定
比生长速率μ(d-1)的计算:

其中,X1和X0分别指培养结束和起始细胞浓度(g/L);t1和t0分别指培养结束和开始的时间(d)。
1.6 生产率(biomass productivity)[g/(L·d)]的测定[13]
生产率的计算:

其中,X1和X0分别指培养结束和起始细胞浓度(g/L);t1和t0分别指培养结束和开始的时间(d)。
1.7 日采收量(Y)和产率(P)的测定[13]

其中,V 为培养液总体积;R 为更新率;C 为细胞浓度(g/L)。
其中,Y'为总采收量;V 为培养液总体积;R 为更新率。
2 结果与分析
2.1 不同CO2 浓度对小球藻生长的影响
小球藻在通入较高CO2浓度气体的条件下具有较好的耐受性并且能够正常生长,具体见表1。由表1 可知,小球藻可以在CO2浓度为80%条件下生长。而通入100%的高浓度CO2尾气时则完全抑制小球藻的生长并且在培养2 d 后死亡,并且在培养的第1天pH 值下降至4.9(图1 未显示),这可能是由于通入的CO2浓度过高导致培养液的pH 下降太多从而抑制小球藻的生长。而通入其他浓度的CO2虽然在培养初期也会有所抑制,但是随着培养时间的延长和小球藻浓度的增加,小球藻对环境pH 逐步适应,培养几天后抑制作用逐渐减弱。在10% CO2浓度下生长最快且生物量最高,因此选用10% CO2作为后续实验的浓度。
通入不同CO2浓度的气体对培养液pH 的影响较大(图1)。图1 显示,CO2导致培养液pH 下降,在培养初期尤其严重,通入的CO2浓度越高pH 值下降越大,随着培养时间的延长,小球藻对CO2利用量的增加,pH 值开始缓慢上升,培养10 d 后通10% CO2组的pH 升至中性左右,而通空气的对照组pH 值基本维持在7 左右。

表1 不同浓度CO2 通气对小球藻生长的影响
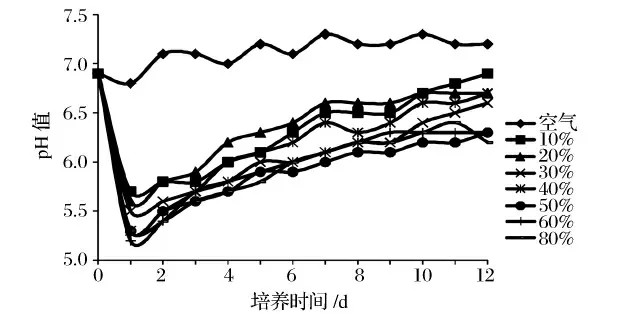
图1 不同CO2 浓度通气对培养液pH 值的影响
2.2 CO2 流速对小球藻生长的影响
CO2气体流速对小球藻生长的影响见图2。由图2 可知,当CO2气体流速为300 mL/min 时,小球藻生物量达到最高为0.502 g/L,而500 mL/min 时获得生物量最低,仅为0.409 g/L。
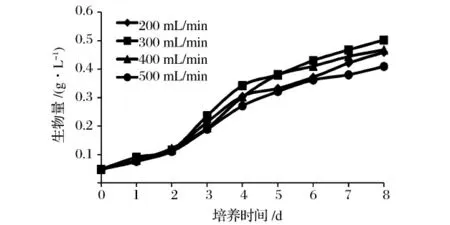
图2 CO2 流速对小球藻生长的影响
2.3 通气方式对小球藻生长的影响
图3 表明不同通气方式对小球藻生长的影响较为明显,由图3 可以看出,当采用10 min/h 的通气方式下获得生物量和产率分别为0.681 g/L 和0.082 g/(L·d),为连续通气组的1.42 倍和1.44 倍;其次是递增通气方式获得较高生物量为0.667 g/L,连续通气下获得生物量和产率略高于对照组。当采用10 min/h 时通入的CO2能够在培养的前5 天满足小球藻生长的需要,5 天后可能由于小球藻浓度增加和对CO2需求量的增加从而导致生长速率有所减缓。而采用更高的CO2通入量时可能因通入的CO2过多从而对小球藻的生长具有一定的抑制作用;采用递增通气方式时随着小球藻浓度的增加,CO2的通入量也增加,从而能为小球藻生长提供充足的碳源,因此培养效果也较理想。
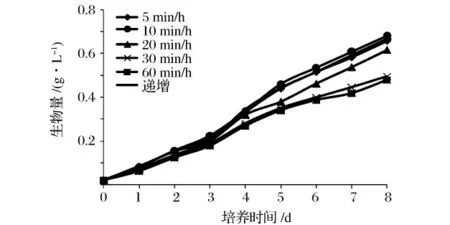
图3 CO2 通气方式对小球藻生长的影响
2.4 分批补料培养对小球藻生长的影响
不同分批补料培养方式对小球藻生长的影响见表2。由表2 可知,当尿素和KH2PO4的起始添加量为总量的50%时,获得最大的生物量为0.709 g/L,分批培养时的生物量最低,仅为0.557 g/L。这说明起始添加的氮和磷浓度过高从而抑制小球藻的生长,通过流加培养可消除氮和磷起始浓度高所引起的抑制作用,使小球藻不断吸收充足营养而旺盛生长,从而取得更高的生物量。
2.5 不同培养基更新率对小球藻生长的影响
为了得到较稳定的连续培养体系,本文研究了不同更新率下小球藻的生长情况,具体见表3 和图4。
从图4 可以看出,当更新率为10%和20%时,在培养初期就能够维持在较高的生物量,随着培养时间的延长生物量略微有下降。当更新率高于20%时,在培养的前几天生物量持续下降,直到第5 天开始才维持稳定,而且生物量明显比更新率为10%和20%的低。由表3 可以看出,生物量随着更新率的增加而减小,产率也随着更新率的增大而减小,总采收量随着更新率的增加而增加。结果与徐志标等[13]半连续培养培养绿色巴夫藻所得结果不一致,这可能是由于 藻种和培养条件不一样造成的。

表2 分批补料培养对小球藻生长的影响
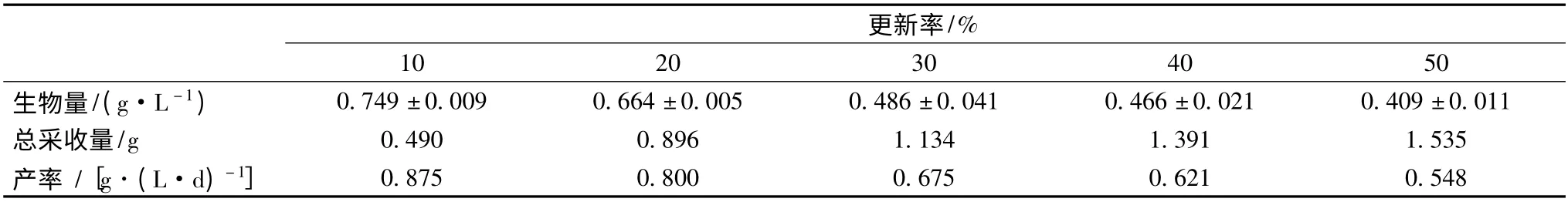
表3 不同更新率对小球藻生长的影响

图4 不同更新率对小球藻生长的影响
2.6 冰醋酸对小球藻生长的影响
当藻类利用CO2作为其唯一碳源时。只能依赖光能作为全部的能量来源进行生物物质的合成;而当光照成为限制因子时,微藻生长即变得缓慢。如果微藻能以有机物作为碳源,有机物亦同时充当了能量提供者的角色,藻类则可以在无光的条件下进行同化作用;微藻既利用光能,同时又利用有机物作为能源的光能异养(混合营养)的同化作用方式将有利于提高其生长率。其中醋酸作为小分子酸类物质,既可以调节微藻培养液的pH 值,也可以作为碳源被微藻利用,对微藻的生长可以具有双重作用。冰醋酸对小球藻生长的影响见图5。
由图5a 可看出,一次性添加5、50、100 和125 μL/L 冰醋酸能不同程度地促进小球藻生长,并在100 μL/L 时最为显著并获得最高生物量和产率,分别为0.723 g/L 和0.088 g/(L·d)。由图5b 可以看出,以流加方式添加冰醋酸比一次性添加冰醋酸对小球藻的生长更有利,以15、20、25 μL/(L·d)时均能获得较好效果,尤其是25 μL/(L·d)时获得0.933 g/L 的生物量,产率也达到0.111 g/(L·d),分别是空气对照组的1.3 倍和1.4 倍。在本实验中微量冰醋酸的促生长作用更多的是由于冰醋酸对碳源和能量的补充作用,微量冰醋酸所起的pH 值调节作用是有限的。这与朱明[14]等一次性添加10 ~100 mg/L醋酸都可促进海链藻生长,每日1 次添加5 ~60 mg/L 的醋酸时,可明显提高海链藻生长率的结果相一致。
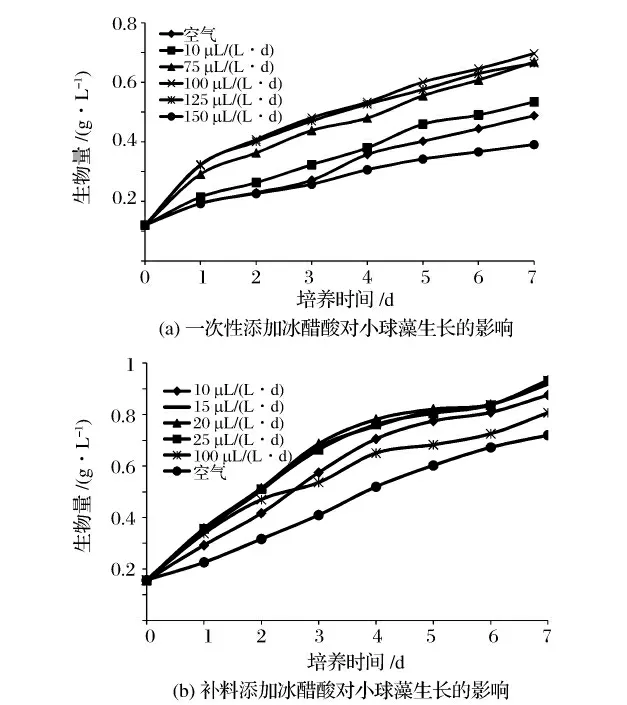
图5 冰醋酸对小球藻生长的影响
3 讨论
目前大部分研究烟道气CO2浓度在10% ~20%,并且煤炭燃烧排放的烟道气含有NOX和SOX,其中SO2、NOx等对微藻都具有明显毒害作用[15]。SOx、NOx等酸性气体通过对pH 的影响而对微藻生长有显著影响,SO2是SOx中主要污染成分,溶于水后以HSO3-、SO32-形式存在,SO32-可降低植物的光合作用,增加其氧化损伤,降低叶绿素含量,使植物叶片出现脱绿漂白现象[16]。岳丽宏[17]等的研究表明,当SO2体积浓度大于50 μL/L 时,需要进行烟气脱硫或控制培养液pH 值变化来消除其影响;烟气中NOX的体积浓度不高于300 μL/L 时,不影响小球藻的生长及其对CO2的固定,可作为氮源供小球藻生长。而本文利用甲醇厂排放的尾气CO2,其CO2含量高达99.13%,并且不含有NOX和SOX,这就不用担忧NOX和SOX对小球藻生长的负面影响,同时也省去了烟气除硫的步骤,因此是一种更为理想的尾气。Matsudo[8]等的研究表明,螺旋藻在管状光生物反应器中利用尿素做氮源,同时以酒精发酵车间产生的CO2为碳源培养时获得的最大生物量为(2.661 ±0.071)g/ L,最大细胞生产率0.839 g/(L·d)。Borkenstein[6]等的研究表明,利用水泥厂产生的废气培养蛋白核小球藻时获得2.00 g/L 生物量和0.13 d-1的平均生长速率。岳丽宏[18]等的研究表明,当CO2浓度为10%,小球藻的生长率最高,CO2固定率平均值为0.397%。本文利用甲醇厂尾气培养小球藻获得最高生物量0.933 g/L 和产率0.111 g/(L·d)。由此可以看出,利用甲醇厂高浓度CO2尾气进行微藻培养是可行的。
De Morais[19]等的研究表明,采用15 min/h 的方式通入高浓度CO2气体时小球藻、栅藻和螺旋藻生长良好,小球藻的最大生物量为1.31 g/L。本文的结果也表明,采用间歇通入高浓度CO2的方式能够促进小球藻的生长。岳丽宏[20]等的研究表明,在CO2浓度渐增的条件下比固定CO2浓度条件下小球藻对CO2固定速率高。本研究采用CO2浓度固定但是通气时间渐增的通气方式,对小球藻生长的促进作用没有通气时间固定的方式下明显,这可能是通气时间太长导致通入的CO2过多从而导致pH 值下降太多以至于对小球藻产生抑制作用。
采用流加技术可以使流加培养基中的氮、磷浓度维持在较低起始浓度,从而使藻体生长的延迟期缩短,延长小球藻对数生长期;同时,在藻的培养过程中采用流加技术可消除或缓冲藻体生长中代谢产物引起的培养液老化[21],维持藻体的高生长速率,获得高的藻体生物量。在半连续培养过程中,由于定时采用新鲜培养液替代等量的原培养液,使培养液中营养成分增加,生物密度下降,透光率增加,因此,藻体光合效率增强,生长速率增快,有利于藻细胞保持良好的生长状态[22]。本文中所得20%更新率可使小球藻生物量维持在较高的水平。
[1] 刘小澄,刘永平.光生物反应器对工业锅炉烟道尾气中二氧化碳的利用[J].现代化工,2010,30(7):70 -74.
[2] Miura Y,Yamada W,Hirata K,et al. Stimulation of hydrogen production in algal cells grown under high CO2concentration and low temperature[J]. Appl Biochem Biotechnol,1993,39/40(1):753 -761.
[3] 孟范平,谢爽,于腾,等.耐酸性和耐高浓度CO2的海洋微藻筛选[J].化工进展,2009,28:310 -317.
[4] 刘玉环,阮榕生,孔庆学,等.利用市政废水和火电厂烟道气大规模培养高油微藻[J]. 生物加工过程,2008,6(3):29 -33.
[5] Negoro M,Hamasaki A,Ikuta Y,et al. Carbon dioxide fixation by microalgae photosynthesis using actual flue gas discharged from a boiler[J]. Applied Biochemistry and Biotechnology,1993,39/40(1):643 -653.
[6] Borkenstein CG,Knoblechner J,Frühwirth H,et al. Cultivation of Chlorella emersonii with flue gas derived from a cement plant[J]. J Appl Phycol,2011,23(1):131 -135.
[7] Rosenberg JN,Mathias A,Korth K,et al . Microalgal biomass production and carbon dioxide sequestration from an integrated ethanol biorefinery in Iowa:a technical appraisal and economic feasibility evaluation[J]. Biomass and Bioenergy,2011,35:3 865 -3 876.
[8] Matsudo MC,Bezerra RP,Converti A,et al. CO2from alcoholic fermentation for continuous cultivation of Arthrospira(Spirulina)platensis in tubular photobioreactor using urea as nitrogen source[J]. Biotechnol Prog,2011,27(3):650 -656.
[9] Douskova I,Doucha J,Livansky K,et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs[J]. Appl Microbiol Biotechnol,2009,82(1):179 -185.
[10] Matsukawa R,Hotta M,Masuda Y,et al. Antioxidants from carbon dioxide fixing Chlorella sorokiniana[J]. J Appl Phycol,2000,12(3 -5):263 -267.
[11] Keffer J E,Kleinheinz GT. Use of Chorella vulgaris for mitigation in a photobioreator [J ]. J Ind Microbio &Biotech,2002,29:275 -280.
[12] 高春燕,程丽华,张林,等.小球藻光生物反应器脱除空气中二氧化碳的研究[J]. 膜科学与技术,2008,4(25):8 -12.
[13] 徐志标,裴鲁青,骆其君,等. 绿色巴夫藻的光生物反应器半连续培养研究[J]. 海洋水产研究,2005,26(4):64 -69.
[14] 朱明,张学成,茅云翔.醋酸对海链藻生长的影响[J].中国海洋大学学报,2005,35(3):499 -502.
[15] Kurano N,Ikemoto H,Miyashita H. Fixation and utilization of carbon dioxide by microalgal photosynthesis[J].Energy Conversion and Management,1995,36(6):689 -692.
[16] 钱永常,余叔文.SO2对植物的氧化作用和植物的抗氧化作用[J].植物生理学通讯,1991,27(5):326 -331.
[17] 岳丽宏,陈为公. 环境因子对小球藻生长及其CO2固定的影响[J].安全与环境学报,2005,5(3):19 -22.
[18] 岳丽宏,陈宝智,王黎,等.利用微藻固定烟道气中CO2的实验研究[J]. 应用生态学报,2002,13(2)∶ 156 -158.
[19] De Morais MG,Costa JAV. Carbon dioxide fixation by Chlorella kessleri,C. vulgaris,Scenedesmus obliquus and Spirulina sp. cultivated in flasks and vertical tubular photobioreactors[J]. Biotechnol Lett,2007(29):1 349 -1 352.
[20] 岳丽宏,陈宝智,钱新明.供气条件对小球藻固定二氧化碳的影响[J]. 安全与环境学报,2001,1(5):49 -52.
[21] 杨雪梅.培养密度和培养液“老化”对盐藻生长和胡萝卜素累积的影响[J].海洋科学,1996(6):39 -43.
[22] 王彩理,任建国. 密封袋半连续培养新月菱形藻[J].信阳师范学院学报(自然科版),2004,17(1):88 -91.

