新城疫病毒RT-PCR 一步法的建立及应用
耿 岗
(青海省海西州乌兰县畜牧兽医工作站,青海乌兰817100)
新城疫病毒属于副黏病毒科(Paramyxoviridae)副黏病毒亚科(Paramyxovirinae)中的禽腮腺炎病毒属(Avulavirus),是一种不分节段的单链、负链RNA病毒[1-2]。由NDV引起的新城疫(Newcastle disease,ND)是一种多病型的高度接触性、急性、烈性传染病,可感染火鸡、家禽以及野禽类,具有传播速度快、发病率高、病死率高等特征,已经在世界范围内引起了4次大流行,给全球养禽业带来了巨大的经济损失[3-8]。该病也是困扰我国养禽业的重要疫病,几十年来一直是我国养禽业坚持预防免疫控制的主要传染病之一[9-11]。该病的存在严重制约着我国养禽业的健康发展,同时对我国禽类产品的出口、食品安全以及人类健康都存在着潜在的危害[11]。因此,加强NDV诊断技术的研究,对预防和控制本病以及人类健康都具有十分重要的现实意义。NDV常规的病毒分离技术和免疫血清学检测方法存在操作复杂、费时费力、检测周期较长等缺点,不能满足快速、准确诊断的需要。鉴于此,本研究建立了一种敏感、特异、准确、简单、快速的一步法RT-PCR方法,为ND的早期诊断、流行病学调查等提供一种有效的检测技术手段。
1 材料与方法
1.1 材料
1.1.1 病毒 新城疫病毒(NDV)、传染性支气管炎病毒(IBV)、传染性喉气管炎病毒(ILTV)、传染性法氏囊病病毒(IBDV)均由青海省动物疾病中心实验室保存。
1.1.2 主要试剂 质粒提取试剂盒、胶回收试剂盒、Trizol为上海生工生物工程技术服务有限公司产品;一步法RT-PCR试剂盒为宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 引物设计与合成 根据已发表的NDV基因组序列,利用生物学软件设计合成一对引物,NDVP1:5′-GGCCGCAGCTCTGATACAA-3′; NDVP2:5′-TACATACAGGCCGACGTATT-3′,将 引物序列送上海生工生物工程技术服务有限公司合成。1.2.2 病毒的增殖 将NDV经尿囊腔接种10日龄SPF鸡胚,收集120h鸡胚尿囊液,于4℃以10 000 r/min离心15min,取上清,置-20℃保存备用。
1.2.3 病毒基因组RNA的提取 取上述的NDV病毒液200μL,加Trizol试剂600μL,按照Trizol试剂的使用说明提取NDV基因组RNA,紫外分光光度计测定含量。
1.2.4 RT-PCR扩增反应 根据一步法RT-PCR检测试剂盒说明书确定RT-PCR反应体系为:25 μL 2×1step buffer,2μL Prime Script 1step enzyme mix,上 下 游 引 物 NDVP1、NDVP2 (20 μmol/μL)适量,模板 RNA 适量,加水至50μL。RT-PCR反应条件为:50℃45min;94℃3min;94℃45s,适宜温度45s,72℃45s,30个循环;72℃10min,4℃终止反应。
1.2.5 RT-PCR扩增反应优化
1.2.5.1 最适模板含量的确定 测定提取的病毒基因组RNA浓度后,适当稀释,使其分别含RNA 10μg、1μg、0.1μg、10ng、1ng、0.1ng,分别以RNA为模板,保持其他反应条件不变,进行RTPCR扩增,确定最佳模板含量。
1.2.5.2 最适引物含量的确定 在RT-PCR反应体系中分别加入上下游引物(20μmol/L)0.1、0.3、0.5、0.7、0.9、1.1μL,其他反应条件不变,进行 RTPCR扩增,确定最佳引物含量。
1.2.5.3 最适退火温度的确定 RT-PCR反应的退火温度分别设50、52、54、56、58℃,进行 RT-PCR扩增,确定最佳退火温度。
1.2.6 RT-PCR扩增产物的检测及鉴定 取扩增产物5μL,在10g/L的琼脂糖凝胶上电泳,用凝胶成像系统扫描进行初步分析鉴定。然后用胶回收试剂盒回收目的片段,与pMD18-T克隆载体于4℃过夜连接,取连接产物转化大肠埃希菌感受态细胞DH5α,挑取生长的单菌落过夜培养增菌,用质粒提取试剂盒提取质粒,经EcoRⅠ/HindⅢ双酶切鉴定后得到阳性克隆,送上海生工生物工程技术服务有限公司进行序列测定。
1.2.7 RT-PCR敏感性试验 提取NDV RNA后定量,然后10倍梯度稀释提取的病毒基因组RNA,使其分别相当于含有10μg、1μg、0.1μg、10ng、1ng、0.1ng RNA,以稀释的RNA为模板分别进行RT-PCR扩增,确定该检测方法的敏感性。
1.2.8 RT-PCR交叉反应试验 分别提取新城疫病毒(NDV)、传染性支气管炎病毒(IBV)、传染性喉气管炎病毒(ILTV)、传染性法氏囊病病毒(IBDV)的RNA或DNA,用已建立的方法进行扩增,确定建立的检测方法的特异性。
1.2.9 RT-PCR重复性试验 用建立的RT-PCR检测方法,对新城疫病毒(NDV)、传染性支气管炎病毒(IBV)、传染性法氏囊病病毒(IBDV)、传染性喉气管炎病毒(ILTV)、3份NDV阳性样品、3份NDV阴性样品重复检测3次,确定本方法的重复性和稳定性。
1.2.10 RT-PCR方法的临床应用 取现地送检的鸡肝、脾、气管等组织病料样品共计68份,用建立的一步法RT-PCR方法进行检测,对检测结果为阳性和阴性的部分样品进行病毒分离鉴定,比较该RTPCR方法相对于病毒分离鉴定的符合率。
2 结果
2.1 RT-PCR扩增反应的确定
根据试验确定最适模板含量为0.1μg,最适引物含量为10μmol,最适退火温度为54℃。确定RT-PCR反应体系为:25μL 2×1step buffer,2μL prime script 1step enzyme Mix,上下游引物NDVP1、NDVP2(20μmol/μL)各0.5μL,5μL RNA,加水至50μL。RT-PCR反应条件为:50℃45min;94℃3min;94℃45s,54℃45s,72℃45s,30个循环;72℃10min,4℃终止反应。
2.2 RT-PCR扩增产物的检测
RT-PCR扩增产物经10g/L琼脂糖凝胶电泳,显示在约705bp处可见一个特异性条带,与预期的大小相符(图1)。
2.3 RT-PCR扩增产物的序列鉴定
RT-PCR扩增产物连接到pMD18-T克隆载体上,用EcoRⅠ/HindⅢ进行双酶切鉴定(图2)。将双酶切鉴定正确的克隆送上海生工生物工程技术服务有限公司测序表明,插入到T载体上的基因片段与NDV La Sota株的核苷酸序列一致。
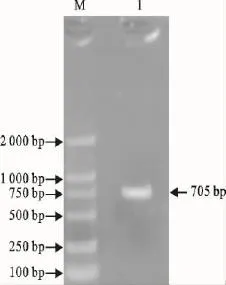
图1 RT-PCR扩增结果Fig.1 Result of RT-PCR amplification
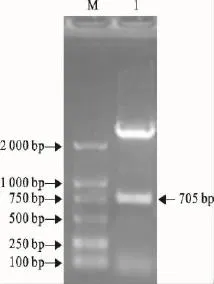
图2 RT-PCR产物的双酶切鉴定Fig.2 Identification of RT-PCR products by enzyme digestion
2.4 敏感性试验结果
不同模板含量的PCR扩增产物经10g/L琼脂糖凝胶电泳分析(图3),可以看出RT-PCR检测的灵敏度可以达到1ng RNA。
2.5 交叉反应试验结果
用该一步法RT-PCR方法仅对NDV扩增出了705bp的特异性基因片段,而对IBV、IBDV、ILTV均未扩增出基因片段(图4)。说明该检测方法具有较高的特异性。
2.6 重复性试验结果
经过3次重复检测,试验结果完全一致,说明该一步RT-PCR方法显示出了较好的稳定性和重复性(图5)。
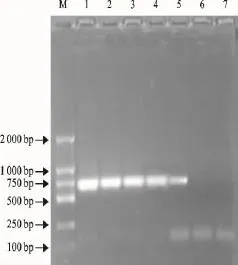
图3 敏感性试验结果Fig.3 Sensitivity test result
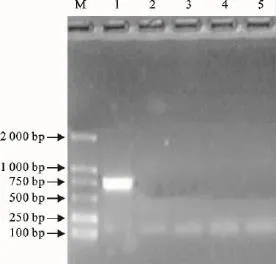
图4 特异性试验结果Fig.4 Specificity test result
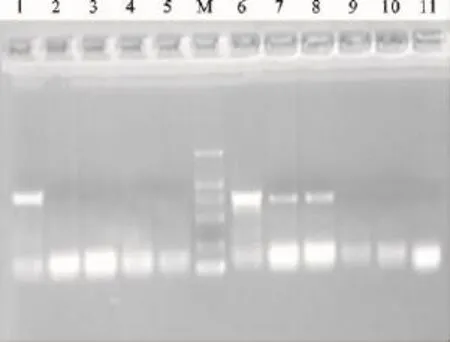
图5 一次重复性试验结果Fig.5 One reproducibility test result
2.7 RT-PCR方法的临床应用结果
用本研究建立的一步法RT-PCR方法检测了现地送检的鸡肝、脾、气管等组织病料样品共计68份,检出阳性样品53份,阳性率77.9%。选取RTPCR检测的10份阳性样品和10份阴性样品,进行病毒的分离鉴定,结果10份阳性样品中有9份成功分离到NDV,10份阴性样品中均没有分离到NDV。表明该RT-PCR方法相对于病毒分离鉴定的符合率为95%(19/20),具有较好的临床应用适用性。
3 讨论
典型的新城疫根据临床症状、病理变化、流行病学等资料可做出诊断。但目前新城疫的流行发生了变化,常常出现非典型新城疫,因非典型新城疫临床症状和病理变化不明显,呈现出非急性致病性,根据临床资料常常难以做出准确诊断,需要采用实验室方法进行确诊[12]。而且目前包括我国在内的多数国家普遍使用新城疫病毒活疫苗,家禽中往往有缓发型NDV毒株存在,给新城疫的诊断又增加了难度[12]。病毒分离鉴定是新城疫最经典、最权威的病原检测方法,但所需检测时间较长,且对感染潜伏期尚未出现临床症状的机体检测不出体内的NDV。RT-PCR技术可以检测样本中特定病原体的核酸序列,且能够检测处于潜伏期的机体中的NDV,具有常规检测方法无法比拟的优势,为NDV的早期检测提供了一种科学的模式和方法。早在2008年,温贵兰等[13]就利用RT-PCR方法鉴定分离的新城疫病毒,并应用该方法的3对新城疫特异性鉴定引物对自然发病鸡的脑、脾、咽喉试子、泄殖腔试子等组织病料进行新城疫病毒检测,其检测结果和传统病毒分离与毒力鉴定的结果相一致。魏润生等[14]建立了针对鸡传染性支气管炎病毒、新城疫病毒和禽流感病毒的多重RT-PCR鉴别诊断方法,可用于NDV与鸡传染性支气管炎病毒、禽流感病毒的快速鉴别诊断,但操作较复杂。郭浩等[15]用双抗夹心ELISA法、悬液芯片系统、RT-PCR 3种方法对新城疫病毒进行了检测,并比较了这3种检测方法的优缺点,得出PR-PCR检测方法虽然所需试剂、仪器设备较昂贵,但其在核酸水平上对病毒进行检测,灵敏度较高,具有广阔的应用前景。本研究在总结前人研究结果的基础上,根据NDV保守区序列设计一对特异性引物,建立了检测NDV的一步RTPCR方法。该RT-PCR方法使用一步法RT-PCR检测试剂盒,使操作更简单、检测更快速、耗时更少,整个检测过程在3h内即可完成。总之,本研究建立的NDV一步法RT-PCR方法敏感、特异、准确、简单、快速,适用于ND的早期快速诊断,将为ND的临床诊断及流行病学调查等提供一种简单、快速的分子生物学诊断方法,对有效预防控制ND具有重要意义。
[1] Korotetskii I S,Bogoiavlenskii A P,Prilipov A G,et al.Molecular genetic characteristics of the Newcastle disease virus velogenic strains isolated in Russia,Ukraine,Kazakhstan,and Kirghizia[J].Vopr Virusol,2010,55(4):29-32.
[2] 王善辉,池贤凤,李 安,等.新城疫病毒感染绵羊诱导免疫应答反应的实验研究[J].中国预防兽医学报,2011,33(10):808-811.
[3] Ruenphet S,Jahangir A,Shoham D,et al.Surveillance and characterization of Newcastle disease viruses isolated from northern pintail(Anas acuta)in Japan during 2006-09[J].A-vian Dis,2011,55(2):230-235.
[4] Mohamed M H,Kumar S,Paldurai A,et al.Sequence analysis of fusion protein gene of Newcastle disease virus isolated from outbreaks in Egypt during 2006[J].Virol J,2011,8:237.
[5] Jindal N,Chander Y,Primus A,et al.Isolation and molecular characterization of Newcastle disease viruses from raptors[J].Avian Pathol,2010,39(6):441-445.
[6] Ren X,Xue C,Kong Q,et al.Proteomic analysis of purified Newcastle disease virus particles[J].Proteome Sci,2012,10(1):32.
[7] 金仕强,孟春春,仇旭升,等.Class I新城疫病毒概述[J].动物医学进展,2012,33(4):102-105.
[8] 田莉莉,李 丽.新城疫病毒HN基因的截短表达及间接ELISA抗体检测方法的建立与应用[J].中国家禽,2012,34(6):29-32.
[9] Yi J,Liu C,Chen B,et al.Molecular characterization of a virulent genotypeⅦd strain of Newcastle disease virus from farmed chickens in Shanghai[J].Avian Dis,2011,55(2):279-284.
[10] 于 杨,崔佳莹,丁晴微,等.新城疫病毒HN蛋白单克隆抗体的制备[J].中国畜牧兽医,2011,38(9):94-97.
[11] 杨少华,胡北侠,许传田,等.三株新城疫病毒强毒株的生物学特性及全基因组序列分析[J].病毒学报,2012,10(2):51-58.
[12] 邹海涛,兰邹然,姜 平.新城疫病毒结构蛋白功能及检测技术研究进展[J].动物医学进展,2012,33(4):85-89.
[13] 温贵兰,瞿继红,李永明.RT-PCR对新城疫病毒(NDV)分离株的鉴定及其临床应用[J].中国兽医学报,2008,28(10):1137-1140.
[14] 魏润生,毕玉海,蒲娟鸡,等.IBV、NDV和AIV多重RTPCR检测方法的初步建立[J].中国动物检疫,2009,26(12):29-31.
[15] 郭 浩,邹明强,于东升,等.新城疫病毒3种检测方法的研究比较[J].中国生物工程杂志,2011,31(10):68-74.

