氮肥用量对药用菊花生长及其药用品质的影响
刘大会,朱端卫,郭兰萍,刘 伟,左智天,金 航,杨 雁
(1华中农业大学资源与环境学院,湖北武汉430070;2云南省农业科学院药用植物研究所,云南昆明650231;3中国中医科学院中药研究所,北京100700)
菊花为菊科植物菊(Chrysanthemum morifoliumRamat.)的干燥头状花序,是我国传统常用大宗中药材,其主要成分为绿原酸、黄酮、糖、氨基酸及矿质元素等,具有散风清热、平肝明目、清热解毒的功效,且还为药食同源的物品,被广泛用于保健茶饮和食品。绿原酸和黄酮等酚类物质是植物体莽草酸代谢途径生成的次生代谢产物,其对提高植物体自身保护和生存竞争能力起着重要的作用[1-3],光照、臭氧、温度、水分胁迫和伤害等多种环境因素的刺激都会诱导植物产生酚类物质[4-6]。在药菊次生代谢过程中,植株体内的苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下解氨生成反式肉桂酸,是生成黄酮和绿原酸等次生物质的莽草酸代谢途径的第一步反应,即关键反应步骤,这一过程对菊花药用品质举足轻重。近年来,施用氮肥对植物中酚类成分合成代谢的调控也日益受到人们的关注[7-9]。施用氮肥对药用菊花生长、产量和养分累积等也有显著影响[10-11],但关于氮肥用量对药菊绿原酸、黄酮、可溶性糖和氨基酸等活性成分及其植株相关生理指标影响的研究报道较少。为此,本文采用盆栽试验方法,研究了氮肥用量对药用菊花活性成分累积及其叶绿素含量、PAL活性和矿质元素含量的影响及其作用机理,以期为药菊规范化栽培的合理施氮提供依据。
1 材料与方法
1.1 试验设计
试验于2005年6月至12月在华中农业大学微量元素研究中心盆栽试验场进行。供试药菊种苗引自湖北麻城市福田河镇药菊种植基地,栽培品种为福田河白菊(杭菊),适合在微酸性土壤上种植。为确保肥效区分,供试土壤采自武汉狮子山黄棕壤的底土,基本理化性状为:pH 5.92、有机质含量0.26%、碱解氮21.4 mg/kg、速效磷2.6 mg/kg、速效钾60.7 mg/kg。
盆栽试验每盆装土10.0 kg(适当添加石英砂,以改善通气状况),设置5个氮肥用量,分别为N 0.05、0.10、0.20、0.30、0.50 g/kg 土,分别用 N1、N2、N3、N4和 N5表示,以硫酸铵作肥源,各处理氮肥分3次施入,底施1/2,剩余氮肥平均分成两份,分别于8月16日和9月20日追施;各处理均基施P2O50.20 g/kg土和 K2O 0.30 g/kg土,以 Ca(H2PO4)2、K2SO4作肥源;另每盆基施10 g白云石以调节土壤pH值和补充钙、镁营养;同时,每盆基施10 mL阿农微量元素混合液以补充土壤微量营养元素。每处理4次重复,每盆定植1株药菊扦插苗,定植时间为6月15日,按照常规进行管理。菊花采收期为当年11月1日~12月15日。
1.2 测定项目及方法
采用SPAD-502叶绿素计测定药菊叶片叶绿素含量。在药菊生长期,每隔一段时间在植株上随机抽取6片上部叶片(每个枝条从上向下数第5~6片叶)测定其叶绿素值,取平均值作为植株叶绿素相对含量。
参照 Lister等[12]和李合生[13]的方法测定花、叶样品的苯丙氨酸解氨酶(PAL)活性。分别于11月5日、11月17日和12月3日分三次,从各处理植株枝条顶部上随机采取8朵花瓣微开的鲜花,以及植株枝条上部的第3、4片叶,用于测定花及叶片中的PAL活性。
在药菊蕾期调查植株的分枝数和株高;在花期,当花朵的舌状花全白、管状花50%左右展开时开始采样,并按照菊花质量先后采收一水花(11月15日以前采收,对应早期)、二水花(11月15~25日采收,对应中期)和三水花(11月25日以后采收,对应末期)。在称量鲜花产量后及时将花用微波杀青,于55℃以下烘至全干称重。将制备好的菊花粉碎制样,过筛,保存待测。采用 HPLC法测定绿原酸[14],铝盐比色法测定总黄酮[14],用蒽酮比色法测定可溶性总糖,用茚三酮比色法测定可溶性总氨基酸。
将活性成分的含量乘以各期花干物质量并累加得到活性成分的累积量。
试验数据采用 Microsoft Excel(2003)和SAS9.0统计软件进行统计分析,LSD法检验差异显著性。
2 结果与分析
2.1 氮肥用量对药菊植株生长和菊花产量的影响
氮肥用量较低时(N1~N3),药菊生长发育迟缓,植株低矮,分枝少;氮肥用量增加,植株株高和分枝数大幅增加,见表1。一水花、二水花和总产的鲜花产量同氮肥用量成正比,但随着氮肥用量增加,各期花鲜花产量的增幅即氮肥增产效率将逐渐减小。一水花、二水花和总产的鲜花折干率是随着氮肥用量的增加呈逐步降低趋势,而三水花除N1处理鲜花折干率略低外,其他施氮处理间差异不显著。
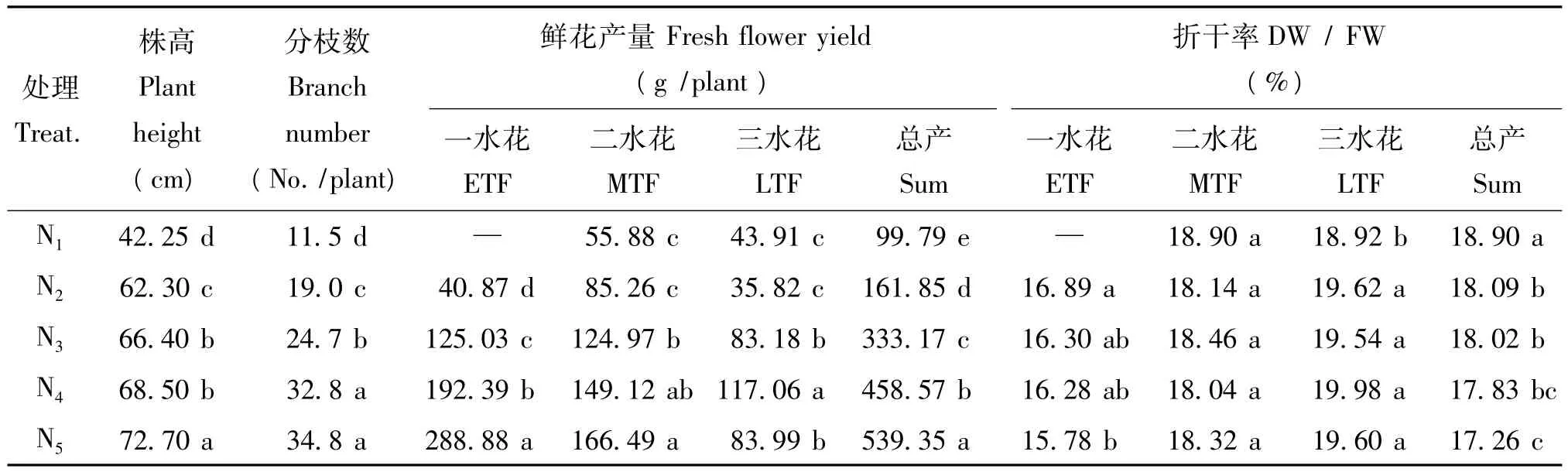
表1 氮肥用量对药菊生长和菊花产量的影响Table 1 Effects of N application rates on the growth of C.morifolium and the yield of flowers
氮肥用量也显著影响不同采收期鲜花产量占总产量的比例。N1和N2处理一水花产量占总产量的比例分别为0和25%,随着氮肥用量的增加,高氮处理一水花的比例逐步增加到54%(N5处理);而二水花的比例由N1处理的57%降至N5处理的31%,三水花的比例由N1处理的44%逐步降至N5处理的16%。上述结果表明,施用氮肥可明显提前药菊植株的开花期,而缺氮会导致药菊开花期推迟。将药菊植株全生育期鲜花总产量(Y)同氮肥用量(X)进行回归分析,可得一元二次多项式模型:Y= -19.40+2214.98X -2184.76X2(n=20,r=0.994 9**),当氮肥用量为N 0.5069 g/kg土时,其鲜花总产量最高为542.01 g/株。
2.2 氮肥用量对药菊叶片叶绿素含量的影响
从表2可知,低氮肥用量处理(N1、N2)植株叶片中(SPAD值)较低,随着氮肥用量的提高,植株叶片中叶绿素含量(SPAD值)逐步上升。不同生育期相比,各处理叶绿素含量在生育前期较高(9月16日以前),随着生长发育的进行,叶绿素的含量将逐步降低;其中,低、中氮肥用量处理(N1、N2、N3)叶绿素含量(SPAD值)较生育前期分别下降了57%、59%和42%,而高氮肥用量处理(N4、N5)仅下降了30%和18%。上述结果表明,缺氮会影响药菊植株叶片的叶绿素含量,从而影响植株的生长。
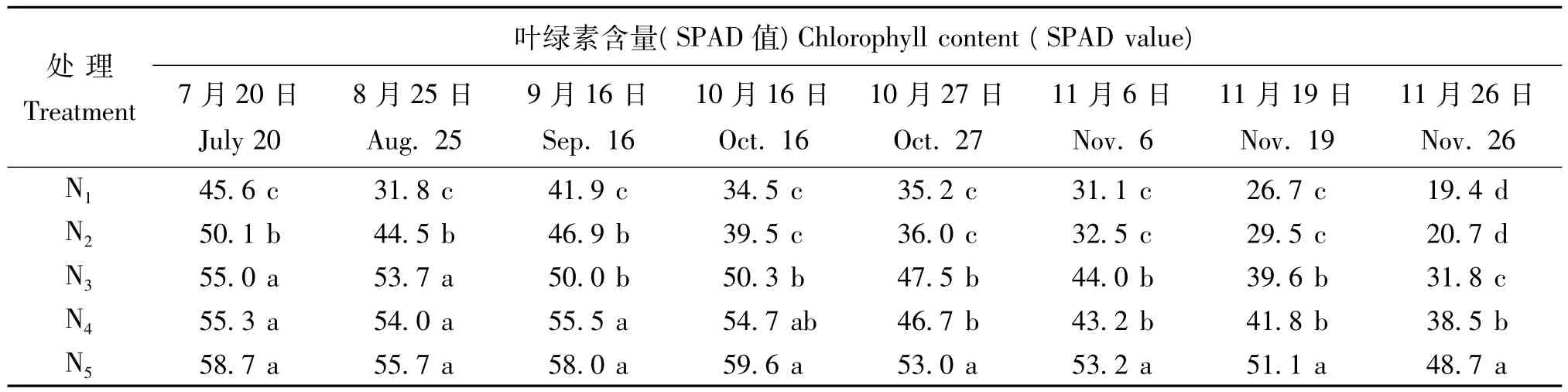
表2 氮肥用量对药菊叶片叶绿素含量(SPAD值)的影响Table 2 Effects of N application rates on leaf chlorophyll content(SPAD value)of C.morifolium
2.3 氮肥用量对药菊叶片和花中苯丙氨酸解氨酶(PAL)活性的影响
从表3可知,药菊叶片和花中的PAL活性同氮肥用量成反比,低氮肥用量处理(N1、N2)叶片和花中PAL活性高,且两处理差异不显著。随着氮肥用量提高,药菊叶片和花中的 PAL活性大幅度降低,三个时期的N5处理叶片中的PAL活性较N1处理下降了39% ~52%,花中下降了22%和40%,这表明施用氮肥会降低药菊植株的PAL活性,从而对莽草酸次生代谢途径产生一定的抑制作用。药菊叶片中的PAL活性在采收期内变化不大,而花中的PAL活性则是随着采收期的推进呈降低趋势。另外,叶片中的PAL活性则显著高于花,说明叶片是莽草酸次生代谢途径的主体。
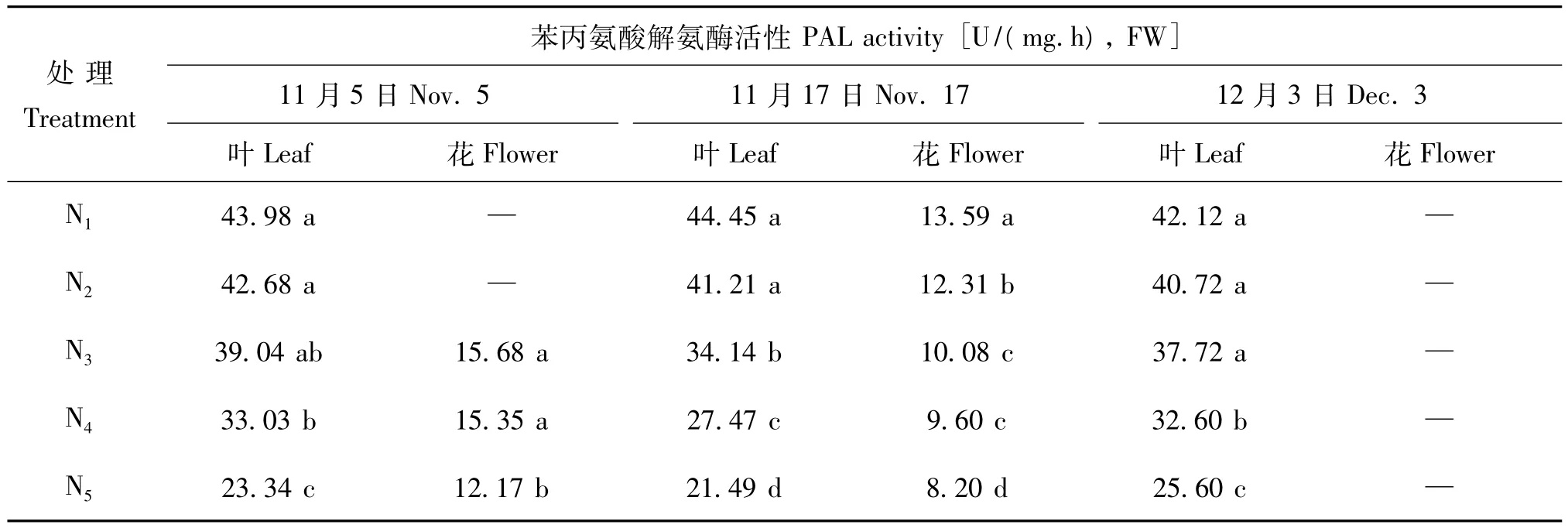
表3 氮肥用量对药菊叶片和花中苯丙氨酸解氨酶(PAL)活性的影响Table 3 Effects of N application rates on PAL activity in leaves and flowers of C.morifolium
2.4 氮肥用量对药菊花中矿质元素含量及其比例的影响
由表4可见,菊花中各矿质元素含量大小顺序为钾(K)>氮(N)>钙(Ca)>磷(P)。氮肥用量对花中矿质元素含量及其比例也有显著影响。随着氮肥用量的提高,不同花期花中氮元素含量逐步提高;而花中磷、钾、钙含量则同氮肥用量或花中氮含量成反比。不同处理花中钾含量随着采收期的推进呈逐步降低趋势,磷含量在生育期内变化不大;氮、钙含量是中、低氮处理生育期内变化不大;而高氮处理(N5)则呈逐步降低的趋势。另外,随着氮肥用量的提高,不同花期花中N/P、N/K和N/Ca均逐步升高。各处理花中N/K随采收期的推进呈逐步增加趋势,而N/P和N/Ca是先降后升趋势。
2.5 氮肥用量对菊花活性成分含量与累积量的影响
从表5可知,菊花中绿原酸、总黄酮和可溶性糖含量同氮肥用量成反比,且氮肥用量越大,降低的幅度也越大,高氮处理(N5)不同花期上述三成分含量的下降幅度分别为35% ~45%、29% ~36%和6%~10%。这一结果表明,施用氮肥会抑制药菊植株酚类物质的合成代谢,并显著降低菊花中绿原酸和总黄酮的含量。与之相反,花中可溶性氨基酸含量同氮肥用量成正比,即随着氮肥用量的提高,不同花期花中可溶性氨基酸含量逐渐增加。另外,菊花中绿原酸和总黄酮含量随着采收期推进逐渐降低,而可溶性糖和可溶性氨基酸含量则逐渐升高。
菊花中绿原酸、总黄酮、可溶性糖和可溶性氨基酸的累积总量同氮肥用量成正比,但随氮肥用量增加,花中绿原酸、总黄酮和可溶性糖累积总量的增幅逐渐降低,而可溶性氨基酸增幅则呈增加趋势。将药菊花中绿原酸、总黄酮和可溶性糖的累积总量(Y)同氮肥用量(X)进行回归分析,可分别得一元二次多项式模型:Y绿原酸=0.02+1.83X-1.99X2(n=20,r=0.9875**),Y总黄酮=0.21+35.77X -42.79X2(n=20,r= 0.9934**) 和 Y可溶性糖=-0.08 + 121.01X -132.18X2(n=20,r=0.9903**);当氮肥用量分别为 0.4598、0.4180 和0.4577 g/kg时,其花中绿原酸、总黄酮和可溶性糖的累积总量最高,可分别为0.44、7.69和27.62 g/株。
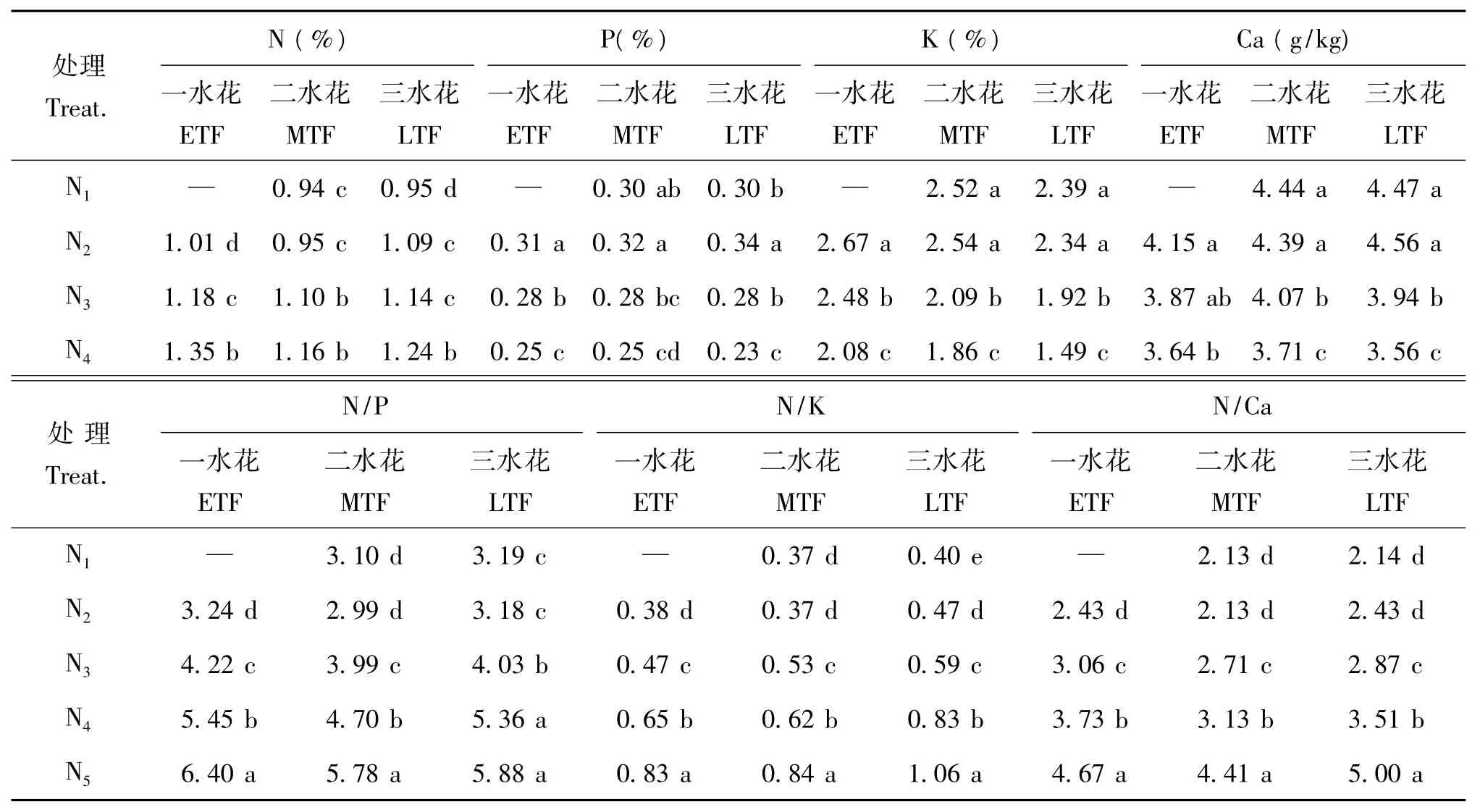
表4 氮肥用量对菊花中氮、磷、钾和钙含量及其比例的影响Table 4 Effects of N application rates on the contents of N,P,K and Ca and the ratio of N/P,N/K and N/Ca in flowers of C.morifolium

表5 氮肥用量对菊花中绿原酸、总黄酮、可溶性糖和氨基酸含量的影响Table 5 Effects of N application rates on the contents of chlorogenic acid,total flavonoids,and soluble sugar and amino acid in flowers of C.morifolium
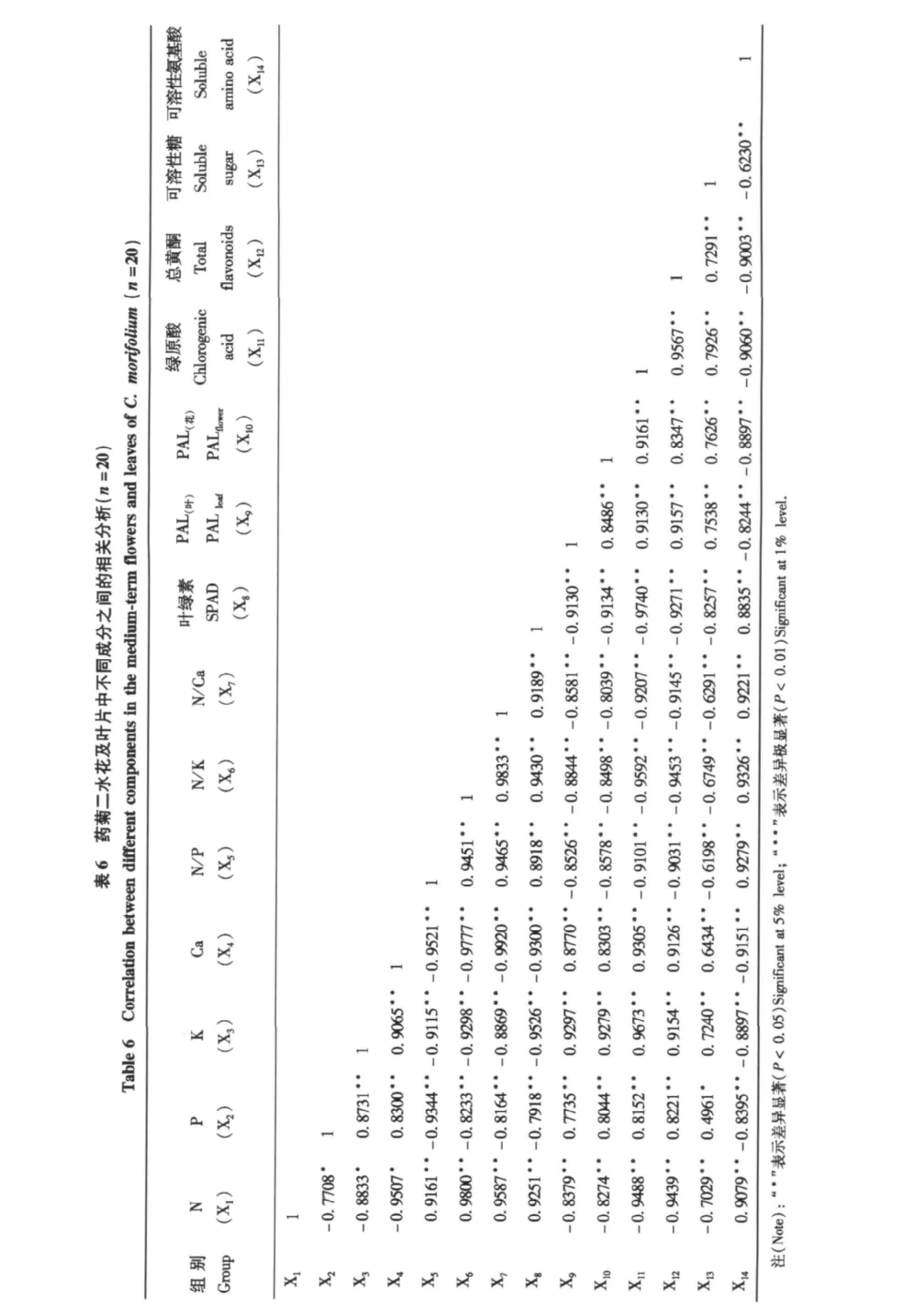
将二水花中各生理指标、矿质元素含量、活性成分含量及叶面有关指标进行相关分析,结果见表6。其中,花中氮含量及N/P、N/K和N/Ca同花中绿原酸、总黄酮和可溶性糖含量及叶片和花中的PAL活性之间呈极显著负相关,同花中可溶性氨基酸含量和叶片的叶绿素含量呈极显著正相关;磷、钾和钙含量同花中绿原酸、总黄酮和可溶性糖含量及叶片和花中的PAL活性之间呈显著或极显著正相关,同花中可溶性氨基酸含量和叶片SPAD值呈极显著负相关。叶片的叶绿素含量同花中绿原酸、总黄酮和可溶性糖含量及叶片和花中的PAL活性之间呈极显著负相关,同花中可溶性氨基酸含量呈极显著正相关;叶片和花中的PAL活性同花中绿原酸、总黄酮和可溶性糖含量之间呈极显著正相关,同花中可溶性氨基酸含量呈极显著负相关。另外,花中绿原酸、总黄酮和可溶性糖含量三者之间互呈极显著正相关,而三者同花中可溶性氨基酸含量之间均呈极显著负相关。其他两期花的相关分析结果同二水花期的研究结果也是一致的。
3 讨论与结论
本研究表明,菊花为喜氮植物,氮肥对药菊植株生长和菊花产量有着显著的促进作用。施用氮肥促进植株对氮的吸收,植株叶绿素含量也大幅增加,从而促进其光合作用和干物质的积累,并显著促进植株花芽分化,增加药材产量和外观品质。但随着氮肥用量的增加和菊花中氮含量逐步增高,花中磷、钾和钙含量降低,N/P、N/K和N/Ca比上升,从而导致植株中矿质元素间比例失调,因而氮肥的增产效率和单位氮肥用量报酬率将逐步减小直至不再增产,这同祝丽香等[11]在杭白菊上的研究结果是一致的。
绿原酸和黄酮均为植物中莽草酸代谢途径生成的次生代谢产物,是通过氮代谢产物苯丙氨酸在PAL的催化下解氨进入莽草酸代谢途径而生成,这一过程同植物体内合成蛋白质存在着竞争关系[15],故氮肥用量过高将大幅降低菊花中绿原酸和总黄酮的含量,花中氮含量以及N/P、N/K和N/Ca与其绿原酸和总黄酮含量呈显著负相关也是该过程的表现。
同化产物糖是植物体内黄酮类成分次生合成代谢的起始物质,且天然黄酮类化合物多以苷类形式存在,故糖对植物体内黄酮类成分的合成代谢影响比较大。根据碳素/营养平衡假说[16]:矿质营养胁迫(包括缺乏和毒害)时,植物生长的速率大大降低,而光合速率保持相对稳定,这样植物会积累较多的碳水化合物,体内碳素/营养比增大,以碳素为基础的次生代谢物质(如黄酮等酚类物质)就会增加。生长/分化平衡假说也认为[17],任何对植物生长与光合作用有不同程度影响的环境因子,都会导致次生代谢物质的变化,对植物生长抑制作用更强的因素将增加次生代谢产物。Singh等[18]发现,当植株氮素供应不足时,由于植物体对氮再利用能力较强,植物体内合成的苯丙氨酸将在PAL作用下解氨,释放的NH4+会经谷氨酰胺合成酶/谷氨酸合酶(GS/GOGAT)途径重新回到植物体内的氮循环过程,从而使植物体内有限的氮再循环利用,这一过程也有利于黄酮类次生代谢物的生成。前人研究也证明,高氮降低苹果叶片中总黄酮含量的机制在于使叶片PAL的活性降低[19],高氮营养条件下会促进荞麦中苯丙氨酸合成蛋白质,从而抑制黄酮类化合物的合成[20]。本研究中低氮肥用量条件下,药菊植株氮素不足,这促使其体内大部分苯丙氨酸解氨生成绿原酸和黄酮等酚类物质,并将解脱下来的氨继续用于植株体内的氮代谢。但在高氮条件下,药菊植株氮素充足,抑制了其体内绿原酸和黄酮成分的合成,从而促进苯丙氨酸转化成蛋白质。
菊花中可溶性糖和可溶性氨基酸含量随着采收期的推进而增加,花中绿原酸和总黄酮含量是随着采收期的推进而降低,这与郭巧生等[21]的研究结果是一致的,其原因可能是采收期外界环境温度逐步降低、昼夜温差加大,低温导致植株多糖和蛋白质等大分子物质分解为可溶性糖和可溶性氨基酸等小分子物质从而提高植株抗寒性有关。菊花中绿原酸和总黄酮含量是随着采收期的推进而降低,这与郭巧生等[21]的研究结果也是一致的,其原因可能与菊花采摘部位变化、花中PAL活性降低和次生代谢产物的前体底物降少等因素有关。
在药用菊花生产上,应注意合理施用氮肥。综合比较氮肥用量对菊花药材产量、外观品质、活性成分含量与累积量等因素的影响,建议菊花生育期内氮肥用量在0.30~0.40 g/kg为适宜。关于氮肥品种和氮肥运筹对菊花生长及其药用品质的影响,以及不同氮肥用量条件下菊花植株各矿质元素的吸收和分配规律,还有待进一步研究。
?
[1]Stafford H A.Flavonoids metabolism[M].Boca Raton,FL:CRC Press,1990.101 -132.
[2]Nugroho L H,Verberne M C,Verpoorte R.Activities of enzymes involved in the phenylpropanoid pathway in constitutively salicylic acid-producing tobacco plants [J].Plant Physiol.Biochem.,2002,40:755-760.
[3]Schijlen E G W M,de vos C H R,van Tunen A J,Bory A G.Modification of flavonoid biosynthesis in crop plants[J].Phytochemistry,2004,65:2631-2648.
[4]Lancaster J E.Regulation of skin color in apples[J].Crit.Rev.Plant Sci.,1992,10:487 -502.
[5]Kangasjarvi J,Talvinen J,Utriainen M,Karjalainen R.Plant defence systems induced by ozone [J].Plant Cell Environ.,1994,17:783-794.
[6]Matern U,Grimmig B.Natural phenols as stress metalites[J].Acta Hortic.,1994.381:448 -462.
[7]Bongue-Bartelsman M,Phillips D A.Nitrogen stress regulates gene expression of enzymes in the flavonoid biosynthetic pathway of tomato[J].Plant Physiol.Biochem.,1995,33:539 -546.
[8]Patil B S,Alva A K.Enhancing citrus nutraceuticals through variable nutrient rates[J].Hort Science,1999,34:520.
[9]Awad M A,de Jager A.Relationship between fruit nutrients and concentrations of flavonoids and chlorogenic acid in‘Elstar’apple skin[J].Sci.Hortic.,2002,92:265 -276.
[10]刘大会,朱端卫,周文兵,等.氮、磷、钾配合施用对福田白菊产量和品质的影响[J].中草药,2006,37(1):125-129.
Liu D H,Zhu D W,Zhou W Bet al.Effect of nitrogen,phosphorus and potassium on yield and quality of Futian,sChrysanthemum morifolium[J].Chin.Trad.Herb.Drugs,2006,37(1):125-129.
[11]祝丽香,王建华,毕建杰,等.不同氮肥用量对杭白菊养分积累、转运及产量的影响[J].植物营养与肥料学报,2010,16(4):992-997.
Zhu L X,Wang J H,Bi J Jet al.Effect of N application rates on nutrients accumulation,transformation and yield ofChrysanthemum morifolium[J].Plant Nutr.Fert.Sci.,2010,16(4):992-997.
[12]Lister C E,Lancaster J E,Walder J R L.Developmental changes in enzymes of flavonoids biosynthesis in the skins of red and green apple cultivars[J].J.Sci.Food Agric.,1996,71:313-320.
[13]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.186.
Li H S.Principles and technique plant physiological biochemical experiment[M].Beijing:Higher Education Press,2000.186.
[14]刘大会,杨特武,朱端卫,等.不同钾肥用量对福田河白菊产量和质量的影响[J].中草药,2007,38(1):120-124.
Liu D H,Yang T W,Zhu D Wet al.Effect of potassium application at various rates on yield and quality of flower inChrysanthemum morifoliumfrom Futianhe region[J].Chin.Trad.Herb.Drugs,2007,38(1):120-124.
[15]Faust M.Physiology of anthyocyanin development in McIntosh apple.Ⅱ.Relationship between protein synthesis and anthyocyanin development[J].J.Am.Soc.Hortic.Sci.,1965,87:10-20.
[16]Bryant J P,Chapin F S III,Klein D R.Carbon/nutrient balance of boreal plants in relation to vertebrate herbivory [J].Oikos,1983,40:357-368.
[17]Wareing P F,Phillips I D J.Growth and differentiation in plants(3rded.) [M].Oxford:Pergamon Press,1981.133.
[18]Singh S,Lewis N G,Towers G H N.Nitrogen recycling during phenylpropanoid metabolism in sweet potato tubers[J].J.Plant Physiol.,1998,153:316 -323.
[19]Strissel T,Halbwirth H,Hoyer U et a1.Growth-promoting nitrogen nutrition affects flavonoid biosynthesis in young apple(Malus domesticaBorkh.)leaves[J].Plant Biol.,2005,7(6):677-685.
[20]Margna U,Margna E,Vainjarv T.Influence of nitrogen on the utilization of L-phenylalanine for building flavonoids in buckwheat seedling tissues[J].J.Plant Physiol.,1989,134:697 -702.
[21]郭巧生,张志远,周黎君,等.药用白菊花主要生理特性及其与活性成分相关分析[J].中国中药杂志,2010,35(7):825-829.
Guo Q S,Zhang Z Y,Zhou L Jet al.Correlation of main physiological characteristics and active componentsin cultivars of medicinalChrysanthemum morifolium[J].China J.Chin.Material med.,2010,35(7):825 -829.

