依立雄胺对雄激素非依赖前列腺癌细胞DU-145的作用
李 涛,李玉华,李润生,桂亚平,卞崔冬,黄盛松,吴登龙
1上海市同济医院泌尿外科 200065;2上海市计划生育科学研究所
介绍前列腺癌是威胁男性健康主要疾病之一,美国2011年前列腺癌在男性新发肿瘤中排名第一位;死亡率,但近年来由于经济水平的提高和生活方式的改变以及男性平均寿命的延长,前列腺癌的发病率呈现不断上升的趋势,严重影响了男性的健康[2],目前正在探讨有效的药物治疗的方法。5α-还原酶抑制剂-非那雄胺(finasteride)已有报道对前列腺癌细胞有较好的抑制作用,另一种新型的5α-还原酶抑制剂-依立雄胺(epristeride)已在我国应用在前列腺增生的治疗,经过临床和基础研究发现其疗效快于非那雄胺,但其对前列腺癌是否有治疗和预防作用目前还缺乏实验和临床的资料,本研究主要探讨依立雄胺是否可以在体外影响雄激素非依赖型前列腺癌细胞株DU-145的增殖和凋亡,为依立雄胺应用在前列腺癌的预防和治疗中打下实验基础。
1 材料与方法
1.1 依立雄胺溶液的制备和保存
依立雄胺由中科院药物研究所提供,纯度为99.9%的白色粉末状物质,将依立雄胺粉末溶解在无水乙醇中,配成20 mmol·L-1储备液后方在-20℃的冰箱中保存备用,实验是用细胞培养液稀释成所需要的浓度。
1.2 细胞培养
激素非依赖型前列腺癌细胞株DU-145购于中科院细胞所。将细胞培养在含有10%进口胎牛血清,青、链霉素的 DMEM(Invitrogen,Carlsbad,CA,USA)细胞培养液中,37℃,5%CO2条件下培养,细胞呈现贴壁生长,用0.25%的胰酶进行消化和传代。
1.3 细胞形态学观察
DU-145 细胞经过 2.5,5,10,20 和 40μM 依立雄胺作用3天后,用普通倒置显微镜进行细胞形态学的观察。
1.4 黄酰罗丹明B法(SRB法)测定DU-145细胞生长曲线
DU-145细胞以每孔5X104接种于24孔板中,于CO2培养箱中常规培养,待细胞贴壁后,分别加入含有2.5,5,10,20 和 40μM 依立雄胺的 DMEM培养液,对照组用含0.5% 的无水乙醇 DMEM 培养液,从换液次日起,每天每个剂量组取3个平行孔进行实验,细胞计数求均值,连续7 d。参照SKehan的方法,细胞培养结束后,取出培养板,不除去培养液,每孔加入50%(质量/体积)的三氯乙酸(ACT)50 μL固定细胞。ACT的终浓度为10%,轻轻地加在每孔液面上,静置5 min后4℃冰箱中放置1h,培养板各孔用去离子水冲洗沉淀5遍,以去除ACT。甩干,空气干燥至无湿迹。每孔加0.4%(质量/体积)的SRB100 μL,室温放置10 min,弃去各孔内液体后用1%乙酸冲洗5遍,去除未结合的染料,空气中干燥后用pH为10.5,10 mmol/L unbuffered Tris base(三羟甲基胺基甲烷)150 μL溶解萃取,在平板振荡器上振荡10 min,在LP400酶标仪测定吸光度A 值,检测波长490 nm,540 nm,564 nm,630 nm,每波长测一A值,再加用参考波长630 nm再测其A值。A值=细胞孔A值-无细胞对照孔A值。取3复孔读数均值。
1.5 流式细胞仪测定依立雄胺对DU-145细胞的周期阻滞
将DU-145细胞接种于50 mL培养瓶中常规培养,待细胞贴壁后,分别加入含有不同浓度依立雄胺的DMEM培养液,对照组用含0.5% 的无水乙醇DMEM培养液,培养72 h后,用胰酶消化,PBS漂洗,调整细胞密度为1×109L-1,用70% 预冷乙醇吹打均匀,4℃固定12 h以上。PBS洗涤去乙醇,1 000 rpm,离心5 min,洗两遍。0.5 ml PBS重悬细胞,加入PI(碘化丙啶)和 RNaseA至终浓度50 μg/ml,37℃ 温浴30 min。用流式细胞仪测定周期
1.6 统计学分析
采用SPSS 15统计软件包进行统计分析,P<0.05为有统计学差异。
2 结果
2.1 细胞形态学观察
DU-145 细胞在 2.5,5,10 μM 依立雄胺作用 3 d后,没有观察到有明显的细胞形态学的变化,但在20 μM 和40 μM 的依立雄胺作用DU-145细胞3 d后,DU-145细胞由梭形变为圆形,继而皱缩,部分细胞悬浮于培养液中,少数细胞的细胞膜出现破裂。另外,发现依立雄胺对细胞增殖呈现浓度依赖性的抑制作用(见图1)。
2.2 依立雄胺对DU-145细胞生长的影响
实验结果如图2所示,经过依立雄胺处理过的细胞都受到不同程度的抑制作用,随着依立雄胺浓度的不断增加,这种抑制作用越来越明显,在20 μM和40 μM的依立雄胺作用DU-145细胞7 d后其细胞抑制率都达到了90%以上。
2.3 依立雄胺对DU-145细胞周期阻滞分析结果
用依立雄胺作用DU-145细胞72 h后,碘化丙啶染色后发现,依立雄胺对DU-145呈现明显的浓度依赖地周期阻滞作用,见图3。
3 讨论
5α-还原酶可以使得睾酮转化成活性更强的二氢睾酮[3]。5α-还原酶有两种亚型,每一种亚型都有单独基因编码[4]。Ⅰ型酶主要分布在人肝脏、皮肤、皮脂腺、睾丸和大多数毛囊中;Ⅱ型酶在包皮、胡须、头发毛囊和前列腺中[5]。Ⅱ型 5α-还原酶主要在前列腺组织的基质细胞、基底上皮细胞中表达[6]。非那雄胺可以竞争性抑制Ⅱ型5α-还原酶,对Ⅰ型5α-还原酶作用微弱。依立雄胺是一种新型的5α-还原酶抑制剂,在体外有较强的抑制Ⅱ型5α-还原酶活性的作用(Ki=25.1 nmol·L-1),从而有可能抑制前列腺癌的生长[7,8]。在本研究中已初步验证,依立雄胺能在较高浓度下体外抑制前列腺癌细胞的生长,其机制可能为依立雄胺抑制双氢睾酮(DHT)的生成[8]以及依立雄胺对DU-145细胞周期阻滞作用。Schafhauser等[9]在裸鼠的前列腺癌模型中给予裸小鼠口服25 mg/kg-1依立雄胺21天后,前列腺癌体积和PSA浓度均显著下降,但不如去势组的下降明显。在老年Beagle犬中,孙祖越等[10]亦报道依立雄胺能降低Beagle犬前列腺中PSA和DHT的表达水平。此外,依立雄胺能改变前列腺局部的一些生长因子水平,如胰岛素样生长因子、转化生长因子和表皮生长因子[11,12],因而也可能抑制细胞的生长。

图1 不同浓度依立雄胺对前列腺癌细胞株DU-145的抑制作用Fig 1 Inhibiting effect of different concentration of epristeride on human prostate carcinoma cell line DU-145

图2 不同浓度依立雄胺对前列腺癌细胞株DU-145增值的抑制率Fig 2 Inhibiting effect ratio of different concentration of epristeride on human prostate carcinoma cell line DU-145
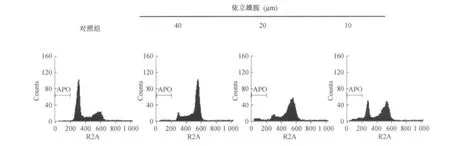
图3 不同浓度依立雄胺对前列腺癌细胞株DU-145的周期阻滞作用Fig 3 Cycle retardation of different concentration of epristeride on human prostate carcinoma cell line DU-145
Lamb 等[13]认为,依立雄胺对于 5α-还原酶活性较低的前列腺癌的抑制作用会更好,它能将DHT降低到与去势一样的水平。本实验的研究结果提示,依立雄胺对于已分化、未转移的前列腺癌,可能具有一定的的控制治疗作用。本研究对利用5α-还原酶在前列腺癌的预防和治疗等方面进行了一些初步探讨打下了实验基础,对依立雄胺等5α-还原酶抑制剂在预防以及治疗前列腺癌的机理方面将进行进一步深入地研究。
[1] Jemal AS,Rebecca Xu JW,Elizabeth.Cancer Statistics[J].CA CANCER J CLIN,2010,60(5):23.
[2] 刘振伟,项永兵,张薇,等.上海市区1973~1999年前列腺癌发病趋势分析[J].中国卫生统计,2003,20(6):335-337.
[3] 吴海涵,翁志梁,李湘斌,等.5α-还原酶抑制剂治疗对前列腺增生患者血清性激素水平的影响[J].中国男科学杂志,2007,21(3):44-46.
[4] Russell DW,Wilson JD.Steroid 5 alpha-reductase:two genes/two enzymes[J].Annu Rev Biochem,1994,63(1):25-61.
[5] 刘本,常忆凌,陈科力.5α还原酶作为天然药物筛选靶的研究进展[J].药物生物技术,2006,13(6):468-470.
[6] 王梦芝.良性前列腺增生症的药物治疗进展[J].当代医学,2010,16(14):24-26.
[7] 孙华君,刘少明.5α还原酶抑制剂临床研究进展[J].世界临床药物,2006,27(2):95-101.
[8] Zu-Yue Sun WZ,Jie Feng ZT.A convenient and rapid method to study enzymatic kinetics of steroid 5a-reductase inhibitors[J].Indian Journal of Pharmacology,1998,30(4):257-262.
[9] Schafhauser W EA,Kiihn R KH,Culig Z.Effect of epristeride and bicalutamide on human prostate cancer PCEW on the nude mouse mode[J].J Eur Urol,1998,34(3):252-253.
[10] Sun ZY,Feng J,Qi XD,et al.Reversible long-term toxicity of epristeride in beagle dogs[J].Toxicol Appl Pharmacol,1999,154(2):145-52.
[11] Wu SF,Sun HZ,Qi XD,et al.Effect of epristeride on the expression of IGF-1 and TGF-beta receptors in androgen-induced castrated rat prostate[J].Exp Biol Med(Maywood),2001,226(10):954-60.
[12] Wu SF,Sun HZ,Tu ZH,et al.Inhibition of cultured rat prostatic epithelial cell growth by epristeride in vitro[J].Acta Pharmacol Sin,2001,22(3):257-63.
[13] John C.Lamb JTI,Mark A.Levy RKJ.Response of rat and human prostatic cancers to the novel 5-reductase inhibitor[J].SK&F 105657.Prostate,1992,21(1):15-34.

