发酵液乳酸含量测定法中EDTA络合滴定钙指示剂的改进
明恒磊,于 颖,刘 杰,王尚龙,袁宁宁,刘全兰
(青岛科技大学化工学院,山东青岛 266042)
发酵液乳酸含量测定法中EDTA络合滴定钙指示剂的改进
明恒磊,于 颖,刘 杰,王尚龙,袁宁宁,刘全兰*
(青岛科技大学化工学院,山东青岛 266042)
乳酸是三大有机酸之一,其生产主要是生物发酵法和化学合成法。当前,乳酸的生产以生物发酵法为主。发酵生产过程中,乳酸含量的检测是个关键问题。乳酸含量的测定方法较多,其中EDTA定钙法因具有高灵敏性和易操作等优点而得以广泛应用。EDTA定钙法主要是通过钙黄绿素指示剂的黄绿色荧光在滴定前后的有和无进行乳酸测定。但该指示剂变色欠佳,滴定终点难以判断。本研究对EDTA定钙法的指示剂进行改进,即在钙黄绿素指示剂中添加入茜素溶液为衬色剂。改进的指示剂可提高显色反应的对比度,由滴定前的黄绿色荧光变为滴定后的红色,这使终点易于观察和判断,这将提高实验结果的准确度和精密度。实验确定了茜素作为钙黄绿素衬色剂的比例,即钙黄绿素和茜素的较佳混合比例为1∶0.275~1∶0.3(g∶g)。
乳酸,EDTA滴定,钙黄绿素,茜素
乳酸(lactic acid)分子式为C3H6O3,是三大有机酸之一,在自然界中主要以三种形式存在:D-乳酸(图1),L-乳酸(图2)和DL-乳酸。由于D-乳酸无法被人体所代谢,其应用领域受到了一定的限制;而L-乳酸可被人体消化,其在食品、医药和日化等领域有更加广泛的应用[1-3]。乳酸的生产主要是生物发酵法和化学合成法。生物发酵法发酵生产乳酸具有成本低、生产温度温和、能耗低且可以用于生产高光学纯度单一构型的乳酸等优点[4]。化学合成法因其原料具有毒性,且只能生产DL混合型乳酸,其应用日益受到限制。不仅如此,生物发酵法可利用可再生资源进行发酵,如工业废料、农作物秸秆等都可发酵生成乳酸。因此,国内外普遍以生物发酵法生产乳酸[4-5]。发酵生产过程中,乳酸含量的检测是个关键问题。乳酸含量的测定方法主要包括EDTA定钙法[6]、对羟基联苯法[7]、酶法[8]、高效液相色谱法[9]、反相高效液相色谱法[10]、气相色谱法[11]和毛细管电泳法[12]等,其中EDTA定钙法具有灵敏、简便和易于操作等特点,在实验室和工业化生产得到广泛应用[5-6]。该方法是以络合反应为基础测定乳酸含量,测定原理是发酵液中的乳酸与CaCO3形成乳酸钙后,用EDTA标准溶液滴定乳酸钙中的钙,通过发酵液中乳酸与钙定量反应的关系,间接计算出乳酸含量[5-6]。络合滴定钙的指示剂中,钙黄绿素灵敏度较高,多被选为EDTA定钙法测定发酵液乳酸含量的指示剂[5-6]。发酵液pH调至大于12后,钙黄绿素指示剂在滴定前的发酵液显黄绿色荧光,滴定终点为黄绿色荧光消失而呈现橙色[5,13]。但此指示剂变色欠佳,肉眼难以察觉痕量荧光[14]。为使滴淀终点变色敏锐,使分析结果准确可靠,本研究对络合滴定钙指示剂进行改进和优化。

图1 D-乳酸的结构式Fig.1 Mocular structure of D-lactic acid

图2 L-乳酸的结构式Fig.2 Mocular structure of L-lactic acid
1 材料与方法
1.1 材料与仪器
实验菌株为植物乳杆菌(Lactobacillus plantarum,菌株号1.2158) 购于中国科学院微生物所;葡萄糖、蛋白胨 购自北京奥博星生物技术有限责任公司;K2HPO4、CaCO3购自天津市巴斯夫化工有限公司;MgSO4·7H2O、MnSO4·H2O和NaOH 购自天津市博迪化工有限公司;CH3COONa 购自天津市广成化学试剂有限公司;EDTA·Na2购自国药集团化学试剂有限公司;钙黄绿素指示剂 购自天津市大茂化学试剂厂;茜素指示剂 购自南开大学化学实验厂;实验中所用试剂均为国产分析纯。
1.2 指示剂
1.2.1 钙黄绿素指示剂结构式和显色反应方式 钙黄绿素(calcein)的分子式为C30H26N2O13,结构式如图3。该试剂为橙黄色粉末,配成溶液后因pH的变化表现出一定的变色规律。pH<11时,指示剂本身具有黄绿色荧光,此荧光可为Cu、Fe、Bi、A l、Ni、Pb、Mn等金属离子所熄灭,但不为Cd、Zn所熄灭;pH>12时,指示剂本身没有荧光,而和Sr、Ca、Ba、A l络合呈黄绿色荧光,其中对Ca特别灵敏,可检出0.08μg的Ca[13]。

图3 钙黄绿素的结构式Fig.3 Mocular structure of calcein
1.2.2 茜素指示剂结构式和显色反应方式 茜素(alizarin)的分子式为C14H8O4,结构式如图4。该试剂为橙黄色或黄棕色粉末,其水溶液呈浅黄褐色,能与许多金属离子生成带色化合物,能与Zr、Th、Al、Ti、Be、Ca等离子形成显色反应[15]。茜素试剂在碱性溶液中呈玫瑰红色,本研究中茜素作为钙黄绿素的衬色指示剂。
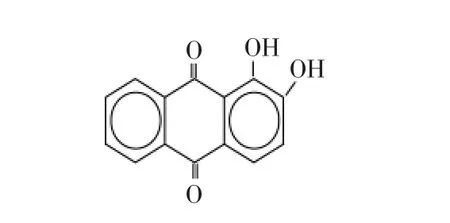
图4 茜素的结构式Fig.4 Mocular structure of alizarin
1.3 菌株培养与发酵
1.3.1 培养基 基础培养基(g/L)为MRS培养基[16]。发酵培养基(g/L)的组成为:葡萄糖为150,酵母粉为2,蛋白胨为10,K2HPO4为2,CH3COONa为5,MgSO4·7H2O为0.58,MnSO4·4H2O为0.25,pH为6.2~6.4,121℃灭菌15min后,加入10%已灭菌的CaCO3作为发酵产酸的中和剂[17]。
1.3.2 液体培养 标准菌株在MRS琼脂培养基活化后,挑取单菌落转至相应的液体培养基中,33℃,厌氧培养12h。
1.3.3 发酵培养 50m L三角瓶中装入20m L发酵培养基,液体培养物按10%的接种量接种到发酵培养基中,33℃,厌氧发酵。取发酵96h后的发酵液进行乳酸含量滴定。
1.4 EDTA络合滴定钙指示剂测定发酵液中乳酸含量
1.4.1 钙黄绿素为指示剂测定发酵液中乳酸钙(W1)
取发酵液5L,5000r/m in离心10m in,以除去菌体和碳酸钙沉淀。吸取上清液1m L置于洁净离心管中,加水50m L,加4m L浓度1mol/L NaOH以调节发酵液pH大于12,钙黄绿素指示剂0.02g,用浓度0.05mol/L EDTA·Na2溶液滴定至背光观察黄绿色荧光转变为橙色为止,并记录消耗掉的体积V(m L)[5-6]。
乳酸钙含量W1(mg)=218.2VC;
式中:V为滴定消耗EDTA·Na2的量(m L);C为EDTA·Na2的浓度(mg/m L)。
发酵液中乳酸(W2)的测定:按照乳酸钙和乳酸的摩尔比为1∶2,计算乳酸含量。

1.4.2 改进的EDTA络合滴定钙指示剂 因钙黄绿素为指示剂时,滴定终点的判断标准是黄绿色荧光消失转变为橙色,变色不明显,不便于观察。本实验添加适量的茜素溶液为其衬色指示剂。为达到钙黄绿素和茜素的最佳混合比例,本实验设计了7种混合比例。取茜素0.02g溶于1m L水中,从中取不同体积的茜素溶液与钙黄绿素进行混合(表1)。指示剂1的组成为钙黄绿素0.02g,茜素溶液250μL,即g(钙黄绿素)∶g(茜素)=1∶0.25;指示剂2的组成为钙黄绿素0.02g,茜素溶液275μL,即g(钙黄绿素)∶g(茜素)=1∶0.275;指示剂3的组成为钙黄绿素0.02g,茜素溶液300μL,即g(钙黄绿素)∶g(茜素)=1∶0.3;指示剂4的组成为钙黄绿素0.02g,茜素溶液325μL,即g(钙黄绿素)∶g(茜素)= 1∶0.325;指示剂5的组成为钙黄绿素0.02g,茜素溶液350μL,即g(钙黄绿素)∶g(茜素)=1∶0.35;指示剂6的组成为钙黄绿素0.02g,茜素溶液375μL,即g(钙黄绿素)∶g(茜素)=1∶0.375;指示剂7的组成为钙黄绿素0.02g,茜素溶液400μL,即g(钙黄绿素)∶g(茜素)=1∶0.4。
1.4.3 改进指示剂测定发酵液中乳酸含量 分取按
1.4.1离心后的上清发酵液1m L,放置于7个试管中。每个试管中依次加水50m L,加浓度1mol/L的NaOH溶液4m L,然后分别加入指示剂1、2、3、4、5、6和7,用浓度0.05mol/L EDTA·Na2溶液滴定,观察发酵液滴定前与滴定终点变色情况。

表1 钙黄绿素和茜素以不同比例混合形成的EDTA络合滴定钙指示剂Table 1 Indicators in EDTA titration analysis composed by different rations of calcein and alizarin
2 结果与讨论
2.1 改进的EDTA络合滴定钙指示剂
实验中茜素作为钙黄绿素的衬色指示剂,以探索EDTA定钙法测定发酵液中乳酸含量的较佳指示剂。实验中,没有茜素的钙黄绿素在发酵液中的黄绿色荧光特征,滴定后颜色转至为橙黄色。指示剂1的实验结果表明,茜素溶液加入量等于250μL时,滴定前,添加茜素的钙黄绿素在发酵液中的黄绿色荧光特征与没有茜素的钙黄绿素的黄绿色荧光特征相似,滴定后,终点转至为橙黄色,不易观察和确定荧光消失的终点。指示剂2和3的实验结果表明,茜素溶液加入量为275、300μL时,滴定前,添加茜素的钙黄绿素在发酵液中的黄绿色荧光特征与没有茜素的钙黄绿素的黄绿色荧光特征相似;滴定后,终点以绿色荧光消失转至明显红色,变色明显,易判断。指示剂4、5、6和7的实验结果表明,茜素溶液加入量大于325μL时,钙黄绿素在发酵液的黄绿色荧光特征变弱,这容易加大乳酸测定的误差。因而,茜素溶液的适宜加入量为275~300μL。若小于275μL,变色不明显,有少量残余荧光;大于300μL,滴定前溶液红色较深,掩盖住了荧光,目视观察效果不好。指示剂的滴定效果列于表2。因而,通过滴定前和滴定后显色变化的灵敏性,实验确定最佳的混合指示剂为指示剂2和3,即g(钙黄绿素)∶g(茜素)在1∶0.275~1∶0.3之间。

表2 EDTA络合滴定钙指示剂在发酵液滴定时和滴定终点的颜色变化Table 2 The color variation of the indicator in EDTA titration analysis of lactic acid
2.2 乳酸含量测定
采用EDTA定钙法,测试标准菌株植物乳杆菌1.0557培养96h后的发酵液中乳酸含量。测试时,平行重复3次,实验结果表明EDTA用量在不同指示剂中有所不同(表3)。仅钙黄绿素为指示剂时,EDTA用量为10.2m L;此时,肉眼判断为滴定终点,即发酵液中的黄绿色荧光变为橙色,但照相图片显示滴定终点时有荧光残留。指示剂2和3进行滴定时,EDTA用量为10.3m L;此时,肉眼判断为滴定终点,即发酵液中的黄绿色荧光变为红色,照相图片表明滴定终点时无荧光残留。指示剂4进行滴定时,由于指示剂中茜素含量较多而削弱了发酵液中的黄绿色荧光,这使滴定终点时EDTA用量为10.2m L;此时,发酵液中的黄绿色荧光变为红色,照相图片表明滴定终点时无荧光残留。

表3 不同指示剂在定钙法测发酵液中乳酸含量所用的EDTA量Table 3 The EDTA volume used by the different indicator at the end pointof titration
3 结论
实验结果表明,钙黄绿素和茜素组成的混合指示剂用于乳酸发酵液EDTA定钙法时,滴定终点变色明显,发酵液的黄绿色荧光消失转至明显红色,这使滴定终点易于判断,方便实验操作。茜素显色原理和实验现象表明茜素可络合Ca,这将减少钙黄绿素结合的Ca量而影响实验结果。为减小茜素造成的实验误差,对钙黄绿素和茜素组合的最佳比较进行探讨,实验结果表明钙黄绿素和茜素的最佳比例在1∶0.275~1∶0.3(g∶g)间,是较佳混合指示剂。滴定结果表明,合适比例的钙黄绿素和茜素混合指示剂,既不影响滴定前的黄绿色荧光,又让滴定终点显出红色的明显颜色变化。因而,本文结果表明仅用钙黄绿素为指示剂时影响终点颜色的判定,这可能导致终点滞后和终点提前等问题;钙黄绿素和茜素按比例形成的混合物可作为测定乳酸发酵液钙含量的最佳指示剂,终点颜色由黄绿色变化为红色,颜色鲜艳,变色敏锐,这将能够快速、准确和简便地测定发酵液乳酸含量。
[1]Hang Y D,Hamamci H,Woodam E E.Production of L(+)-Lactic acid by Rhizopus oryzae immobilized in calcium alginate gels[J].Biotechnology Lett,1989,11(2):119-120.
[2]崔琴,贠建民,张丽,等.甘南州牧区优良乳酸菌耐受特性的研究[J].食品工业科技,2010,31(3):216-219.
[3]Sudheer K S,Ahmed SU,Pandey A.Metabolic engineering approaches for lactic acid production[J].Process Biochemistry,2006,41(5):991-1000.
[4]Wang Q H,Narita JY,Xie W M,et al.Effects of anaerobic/ aerobic incubation and storage temperature on preservation and deodorization of kitchen garbage[J].Bioresource Technology,2002,84(3):213-220.
[5]金其荣,张继民,徐勤.有机酸发酵工艺学[M].北京:中国轻工业出版,1989:339-408.
[6]郑志,姜绍通,潘丽军.EDTA定钙法测定发酵液中乳酸含量的探讨[J].食品科学,2003,24(3):102-105.
[7]梁琼,鲁明波,卢正东,等.对羟基联苯法定量测定发酵液中的乳酸[J].食品科学,2008,29(6):357-360.
[8]柳畅先,吴士钧.酶法测定乳酸[J].分析实验室,2005,24(9):75-77.
[9]白冬梅,赵学明,胡宗定.高效液相色谱手性流动相添加剂分离乳酸对映体[J].分析化学,2001,29(4):413-415.
[10]卢定强,徐蓓,李晖,等.反相高效液相色谱法同时测定乳酸及乳酸甲酯[J].精细化工,2007,24(2):206-208.
[11]吕九琢,徐亚贤,徐金龙.气相色谱法测定发酵法乳酸产品中乳酸及有机杂质[J].北京石油化工学院学报,2003,11(3):46-50.
[12]陈正行.电位分析法测定乳酸的含量[J].无锡轻工业学院学报,1994,13(3):270-272.
[13]张荣华,王秀梅,胡春燕.钙黄绿素在络合滴定中的应用[J].山西大学学报:自然科学版,1996,19(2):165-168.
[14]尹立君.络合滴定钙指示剂的选择[J].化学分析计量,2007,16(4):71.
[15]冯兰宾,袁铁彪.化妆品生产工艺[M].北京:中国轻工业出版社,1986:113.
[16]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[17]王旭明,王群会,任南琪,等.厨房垃圾中高效乳酸细菌的分离筛选及其发酵性能的研究[J].高技术通讯,2004(10):75-79.
Im proved indicators in EDTA titration analysis of lactic acid in fermented broth
M ING Heng-lei,YU Ying,LIU Jie,WANG Shang-long,YUAN Ning-ning,LIU Quan-lan*
(College of Chemical Engineering,Qingdao University of Science&Technology,Qingdao 266042,China)
EDTA titration was a main method for the determ ination of lactic acid in fermented b roth.The color variation of calcein was used to confirm the end point of titration,which is that the original yellow-green fluorescence shifted to the orange color at the end point of EDTA titration.However,the color variation was not sharp,whichmade some obscurity in confirm ing the end pointof titration.To imp rove the color variation degree,alizarin was m ixed together w ith calcein in a p roportion in this study;and the color variation d isp layed an obvious shift,which exp ressed by the fact that the original yellow-green fluorescence was turned into the obvious red color at the end point of titration.The results suggested that the im p roved ind icatormade from the m ixture of alizarin and calcein was a better ind icator,because the color variation of end point was more sensitive;the best p roportion of calcein to alizarin was 1∶0.275~1∶0.3(g∶g).
lactic acid;EDTA titration;calcein;alizarin
TS207.3
A
1002-0306(2012)09-0387-04
2011-08-25 *通讯联系人
明恒磊(1987-),男,硕士研究生,主要从事微生物种质资源和发酵工艺研究。
国家十二五科技支撑计划项目(2011BAD17B04);国家海洋局海洋生物活性物质与现代分析技术重点实验室资助(MBSMAT-2010-05)。

