有机相酶法制备溶血磷脂工艺
孙清瑞,张东杰*,刘志明,鹿保鑫,王 琴,张清荣
(黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
有机相酶法制备溶血磷脂工艺
孙清瑞,张东杰*,刘志明,鹿保鑫,王 琴,张清荣
(黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
以大豆浓缩磷脂为原料,通过响应面分析法研究有机相酶法制备溶血磷脂的工艺条件,得出溶血磷脂酸值与影响因素间的回归模型,根据模型进行工艺参数优化。同时,用红外光谱法和高效液相色谱法对所得磷脂进行分析。结果表明,在正己烷有机相中利用磷脂酶A1制备溶血磷脂的最佳工艺参数:反应温度50℃、反应时间13h、加酶量4%、加水量17%、磷脂质量浓度24g/100mL,该条件下磷脂酸值为73.8mg KOH/g。该脱油溶血磷脂中磷脂酰胆碱和1-酰基-溶血磷脂酰胆碱含量分别为6.79%和4.45%。
溶血磷脂;磷脂;磷脂酶A1;响应面分析法
大豆磷脂除具有生理活性外,还具有乳化、增溶、润湿等性能,被广泛应用于食品、医药、化妆品等领域[1]。溶血磷脂是仅含有一个脂肪酰基的磷脂[2-8],引起国内外学者的广泛关注。从化学结构上看,溶血磷脂保留了普通磷脂的双亲两性结构,更在一定程度上改变了由于亲水亲油平衡值(hydrophil and lipophile balance,HLB)偏低而致普通磷脂应用范围受限制的状况[9]。同时溶血磷脂的一些特殊性能亦引起生理药理学家的极大兴趣,因此极具开发价值[10-12]。在有机相中进行酶促反应具有以下优点[13]:1)微生物不易存活;2)反应物不易变质;3)可以更好的保持酶活;4)有机溶剂的沸点较低,方便脱溶。磷脂酶A1(lectiase ultra)是一种羧酸酯水解酶,经基因改造的米曲霉深层发酵而得的,其基因供体为尖孢镰刀霉和棉状嗜热丝孢菌,因此具有酶源广的优点。它能催化磷脂水解生成2-酰基-溶血磷脂和脂肪酸,但2-酰基-溶血磷脂会部分发生酰基位移生成1-酰基-溶血磷脂。
在有机相中利用磷脂酶A1催化大豆浓缩磷脂水解制备溶血磷脂,国内尚未见文献报道。本实验进行磷脂酸值比较以探讨适宜的反应条件,并对溶血磷脂进行红外光谱和高效液相色谱分析,以期为开发大豆磷脂深加工产品提供基础数据。
1 材料与方法
1.1 材料
大豆浓缩磷脂 九三粮油工业集团;磷脂酶A1(lectiase ultra,酶比活力为9800U/mL) 丹麦Novo公司;正己烷、石油醚、无水乙醇(均为分析纯) 天津市科密欧试剂有限公司;氢氧化钾(分析纯) 天津市大茂试剂厂。标准品1,2-二棕榈酰-Sn-甘油-3-磷脂酰胆碱(PC)、1-棕榈酰-Sn-甘油-3-磷脂酰胆碱(1-LPC) 美国Sigma公司。
1.2 仪器与设备
Spectrum GX2000傅里叶变换红外光谱仪 美国PerkinElmer公司;1200S液相色谱仪 美国Agilent公司;HA121-50-01超临界萃取设备 南通华安超临界萃取有限公司;DF-1集热式搅拌器 金坛虹盛仪器厂;RE-52A旋转蒸发器 上海亚荣仪器厂;TD4A离心机长沙英泰仪器厂。
1.3 酶解磷脂及脱油溶血磷脂的制备
用正己烷将适量的浓缩磷脂溶解,控制一定的磷脂质量浓度、加酶量、反应时间、加水量(pH6的醋酸-醋酸钠缓冲溶液),反应温度50℃,于集热式搅拌器中(200r/min)反应,反应液经离心(4000r/min)和旋转蒸发(50℃,30min)脱溶后得到产品,用氢氧化钾无水乙醇标准溶液测其酸值。
将在优化条件下得到的酶解磷脂经脱溶后,再经超临界CO2流体萃取得到脱油溶血磷脂(萃取条件为萃取温度52℃、萃取压力35MPa、萃取时间5.4h)。
1.4 磷脂酸值测定[14]
参照AOCS Ja6-55的方法测定。
1.5 单因素分析试验设计
选取磷脂质量浓度、反应时间、加水量、加酶量4因素,以酸值为磷脂水解程度评价指标进行试验。
1.6 响应面分析试验设计
在单因素试验基础上,选取磷脂质量浓度、反应时间、加水量、加酶量4因素,以酸值为响应值,设计响应面试验(表1),研究制备溶血磷脂的最佳工艺参数。

表1 响应面试验设计因素水平表Table 1 Factors and their levels tested in response surface analysis
1.7 溶血磷脂的红外光谱分析
用傅里叶变换红外光谱仪分析溶血磷脂官能团结构。金属陶瓷棒光源,中红外碲镉汞(MCT)检测器,测定范围为370~4000cm-1,分辨率为4cm-1,扫描次数为4次。
1.8 脱油溶血磷脂的液相色谱分析[15]
参照GB/T 22506—2008《酶改性磷脂中1-和2-溶血磷脂酰胆碱的测定》中方法。所用色谱柱为Agilent ZORBAX-NH2(250mm×4.6mm,5μm)。
2 结果与分析
2.1 单因素分析试验
2.1.1 反应时间对磷脂水解的影响
控制反应条件:反应温度50℃、磷脂质量浓度20g/100mL、加水量100%、加酶量5%,结果如图1所示。随着反应时间的增加,酶和磷脂结合几率增大,反应生成脂肪酸逐渐增多,但该条件下,16h后,反应体系基本处于平衡状态,酸值增加不明显。但以浓缩磷脂的相对平均分子质量800计算,加之其起始酸价,完全生成溶血磷脂的酸值应为80mg KOH/g左右。在此研究体系中,考虑到该酶可能进一步催化1-酰基-溶血磷脂水解生成其完全脱酰基产物,从而水解产物酸值可能远超过80mg KOH/g,因此其他单因素试验反应时间选为24h。
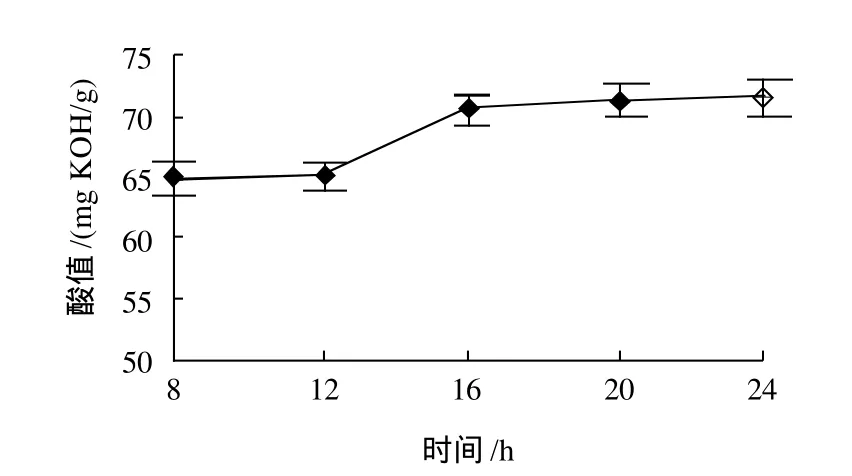
图1 反应时间对磷脂水解的影响Fig.1 Effect of reaction time on phospholipid hydrolysis
2.1.2 加酶量对磷脂水解的影响
控制反应条件:反应温度50℃、磷脂质量浓度20g/100mL、加水量100%、反应时间24h,结果如图2所示。加酶量1%~3%时,酸值有显著的变化。而加酶量3%~9%时,酸值的增加趋势较前一范围相对平缓一些。可能是由于初始时加酶量少,酶不能充分催化底物,当加酶量增加,酶与底物的接触机率增加,酸值变化较快。而加酶量达到一定值时,反应达到平衡状态。
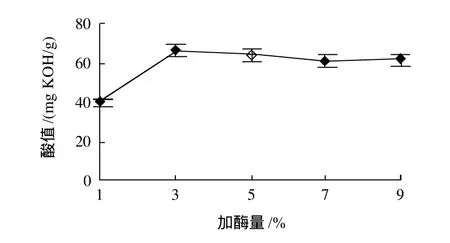
图2 加酶量对磷脂水解的影响Fig.2 Effects of enzyme dosage on phospholipid hydrolysis
2.1.3 磷脂质量浓度对磷脂水解的影响
控制反应条件为反应温度50℃、加水量100%、加酶量5%、反应时间24h,结果如图3所示。磷脂质量浓度15~25g/100mL时,水解产物的酸值显著增加。而当磷脂质量浓度达到25g/100mL以后,酸值开始下降。可能原因是在较低的磷脂质量浓度下,反应体系易于分散均匀,酶分子与磷脂分子易于接触,反应程度较好。随着磷脂质量浓度的增大,磷脂分散困难,所以其酸值随着磷脂质量浓度的增大而降低。

图3 磷脂质量浓度对磷脂水解的影响Fig.3 Effect of substrate concentration on phospholipid hydrolysis
2.1.4 加水量对磷脂水解的影响
控制反应条件为反应温度50℃、磷脂质量浓度20g/100mL、加酶量5%、反应时间24h,结果如图4所示。加水量10%~20%时,酸值上升,而后随加水量增加酸值降低。可能原因是酶水解过程中,一方面,由于酶的反应需要水的参与,以维持体系中磷脂酶的活性。当水量过大时,将降低有机相的局部酶浓度,导致酸值逐渐降低。
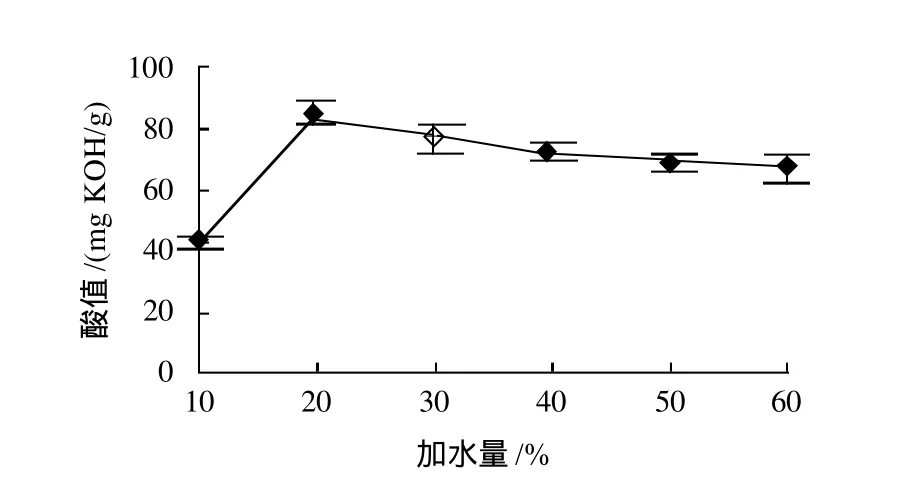
图4 加水量对磷脂水解的影响Fig.4 Effect of water content on phospholipid hydrolysis
2.2 响应面分析试验
根据表1的试验设计,按照预定的反应条件,对大豆浓缩磷脂进行酶解反应,响应面试验结果见表2。据表2试验结果,以酸值为响应值(Y),经Design Expert 6.0统计软件进行分析,依据编码因素得到的回归方程为:Y=71.10-0.65A-2.14B+2.80C+10.88D-3.40A2+0.77B2-2.03C2-2.56D2+1.16AB+3.58AC+1.51AD-1.57BC-2.40BD-0.25CD。
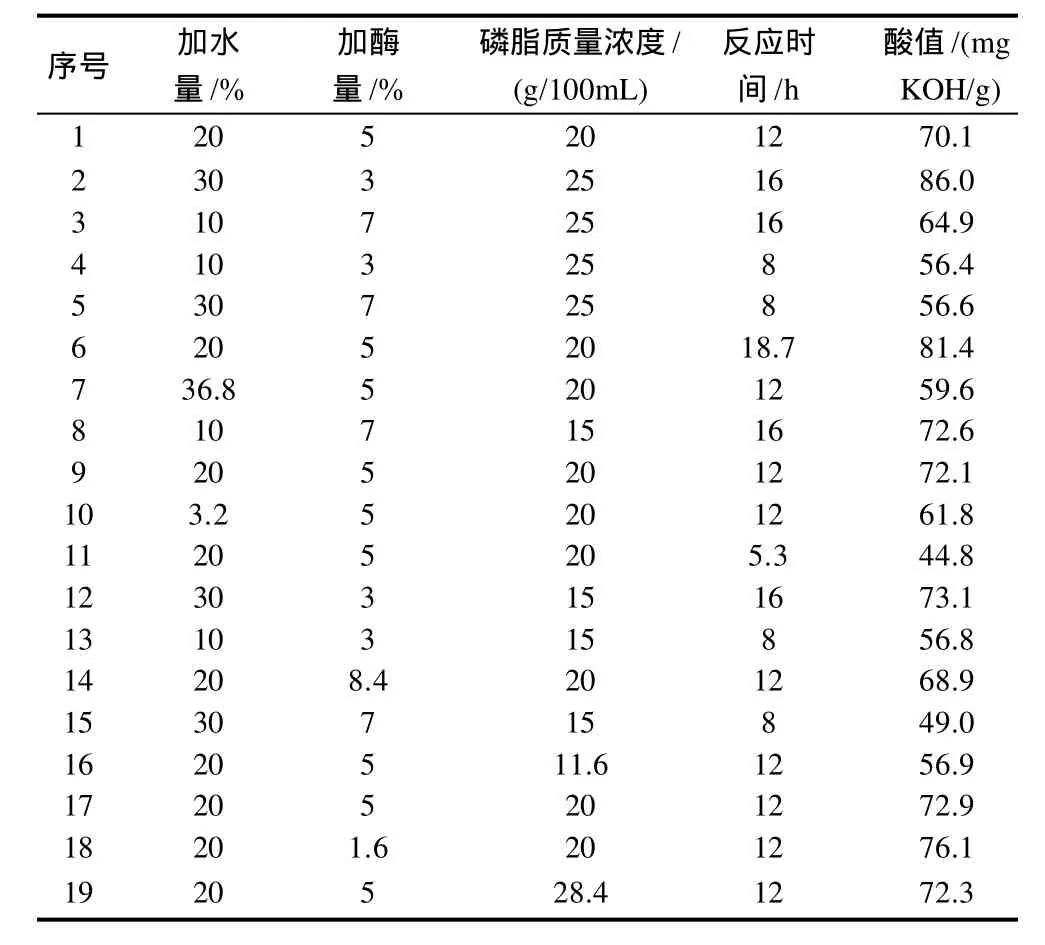
表2 响应面分析试验设计及结果Table 2 Experimental design and results for response surface analysis
该模型的可靠性分析可从方差分析和确定系数两方面考虑。对表2试验结果进行方差分析(表3),模型的P值小于0.05,所以回归模型显著,模型确定系数为R2=0.9799,失拟项P=0.0973>0.05,表明失拟不显著,该模型稳定。在试验设计范围内,可以对制备溶血磷脂条件进行有效的预测和分析。
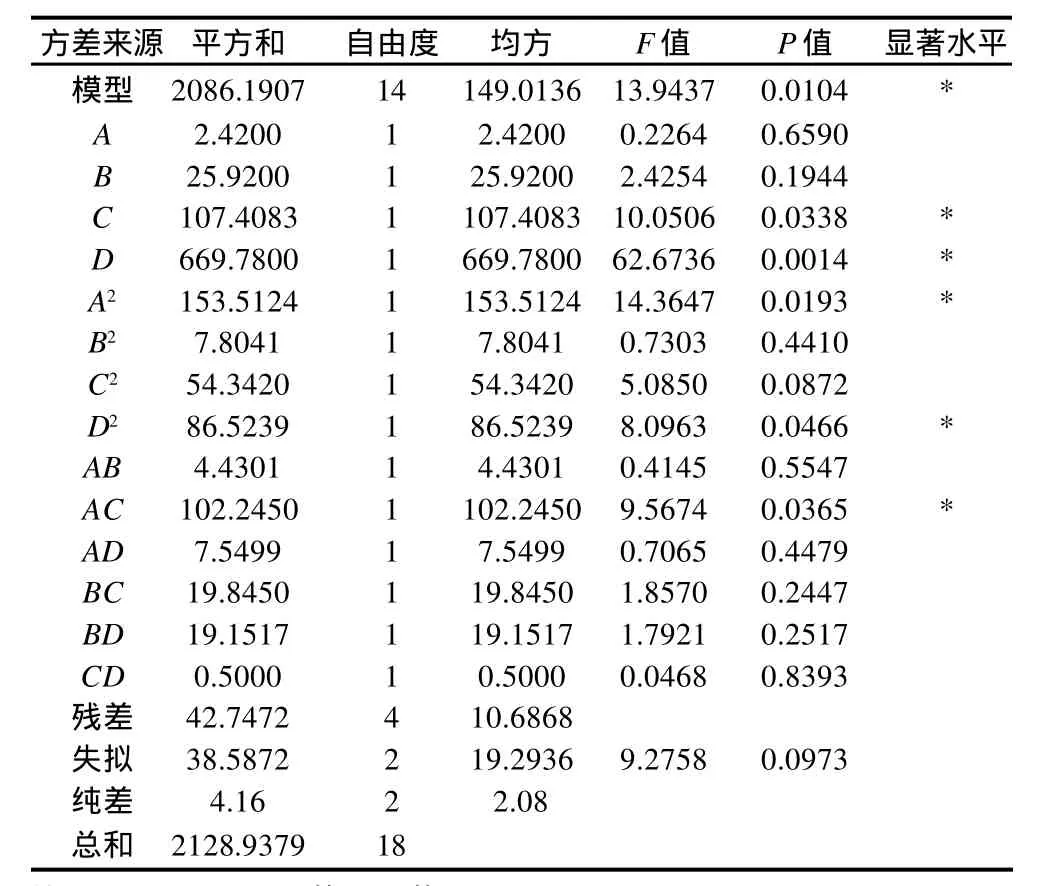
表3 回归模型方差分析Table 3 Analysis of variance for the fitted regression equation
由表3可知,在一次项中反应时间和磷脂质量浓度,二次项中加水量的平方、反应时间的平方及加水量×磷脂质量浓度对酸值影响显著。依据回归模型可以预测在反应温度50℃、反应时间13h、磷脂质量浓度24g/100mL、加酶量4%、加水量17%条件下,溶血磷脂酸值最高可达75.8mg KOH/g。在该预测条件下验证得溶血磷脂酸值为73.8mg KOH/g,与理论预测值相比,相对误差小于5%。预测值与试验值之间良好的拟合性证实了该模型的有效性。
2.3 溶血磷脂的红外光谱分析
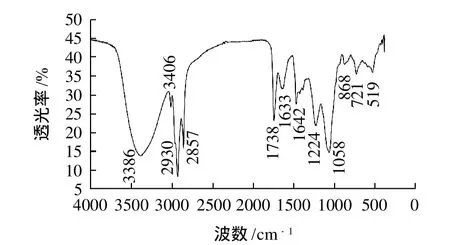
图5 溶血磷脂红外光谱图Fig.5 FTIR spectra of lysophospholipids
溶血磷脂的定性分析采用红外光谱法,其谱图见图5。参照陈斌斌等[16]在水相中制备的溶血磷脂红外光谱图,分析可知3386cm-1为—OH的伸缩振动峰;2930cm-1和2857cm-1为甲基、亚甲基C—H的伸缩振动峰;1738cm-1是—CO—O—中酯羰基C=O伸缩振动引起;1224cm-1和1058cm-1分别是P=O伸缩振动峰和P—O—C的伸缩振动峰。以上特征与溶血磷脂结构相符。
2.4 脱油溶血磷脂的液相色谱分析

图6 标准品PC和1-LPC液相色谱图Fig.6 HPLC chromatogram of PC and 1-LPC standards
由图6可知,1,2-二棕榈酰-Sn-甘油-3-磷脂酰胆碱(PC)和1-棕榈酰-Sn-甘油-3-磷脂酰胆碱(1-LPC)的出峰时间分别为6.895、11.062min。图7为脱油溶血磷脂液相色谱图。由外标法(其中PC标准曲线方程为y=67666x-7807,R2=0.9885;1-LPC标准曲线方程为y=51651x-2482,R2=0.9873)计算得该脱油溶血磷脂中磷脂酰胆碱和1-酰基-溶血磷脂酰胆碱含量分别为6.79%和4.45%,表明利用磷脂酶A1酶解浓缩磷脂所生成的2-酰基-溶血磷脂酰胆碱发生了酰基位移。
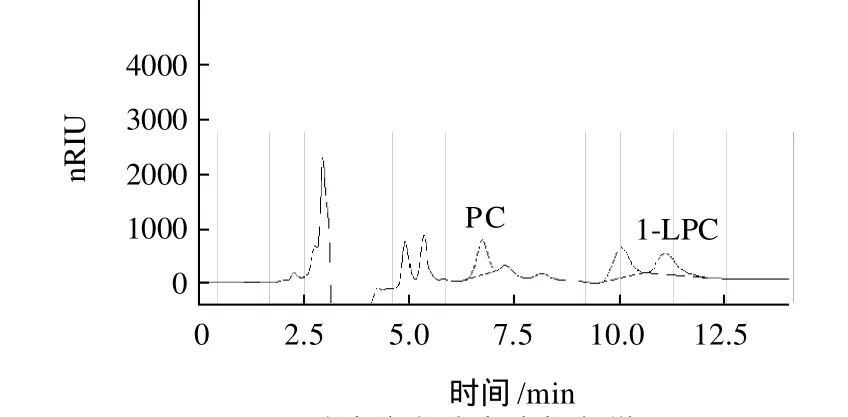
图7 脱油溶血磷脂液相色谱图Fig.7 HPLC chromatogram of defatted lysophospholipids
3 结 论
在正己烷有机相中,磷脂酶A1催化大豆浓缩磷脂水解制备溶血磷脂的最佳工艺参数为反应温度50℃、反应时间13h、加酶量4%、加水量17%、磷脂质量浓度24g/100mL,该条件下磷脂酸值为73.8mg KOH/g。该脱油溶血磷脂中磷脂酰胆碱和1-酰基-溶血磷脂酰胆碱含量分别为6.79%和4.45%。
[1]PENG Lifeng, XU Xuebing, MU Huiling, et al. Production of structured phospholipids by lipase-catalyzed acidolysis: optimization using response surface methodology[J]. Enzyme and Microbial Technology 2002,31(4): 523-532.
[2]VIKBJERG A F, MU Huiling, XU Xuebing. Parameters affecting incorporation and by-product formation during the production of structured phospholipids by lipase-catalyzed acidolysis in solvent-free system[J]. J Mol Cat B, 2005, 36(1/6): 14-21.
[3]VIKBJERG A F, MU Huiling, XU Xuebing. Elucidation of acyl migration during lipase-catalyzed production of structured phospholipids[J]. J Am Oil Chem Soc, 2006, 83(7): 609-614.
[4]HAAS M J, SCOTT K, JANSSEN G. Enzymatic phophatidylcholine hydrolysis in organic solvents: an examination of selected commercially available lipase[J]. J Am Oil Chem Soc, 1994, 71(5): 483-490.
[5]KIM J, LEE C, OH J, et al. Production of egg yolk lysolecithin with immobilized phospholipaseA2[J]. Enzyme and Microbial Technology,2001 29(10): 587-592.
[6]KIM I, GARCIA H S, CHARLES G, et al. Synthesis of structured phosphatidylcholine containingn-3 PUFA residues via acidolysis mediated by immobilized phospholipase A1[J]. J Am Oil Chem Soc, 2010,87(11): 1293-1299.
[7]王迎新, 迟玉杰. 蛋黄磷脂酶解进程的测定[J]. 食品科学, 2009, 30(7): 114-117.
[8]KIM J H A , KIM B G. Lipase-catalyzed synthesis of lysophophatidylcholine using organic cosolvent for in situ water activity control[J]. J Am Oil Chem Soc, 2000, 77(7): 791-797.
[9]刘晔, 裘爱泳. 溶血磷脂的性能研究[J]. 中国油脂, 1999, 24(5): 48-50.
[10]SAUBHIK S , WANG Zeneng, RUSSELL T, et al. Biology of LPA in health and disease[J]. Seminars in Cell and Developmental Biology,2004, 15(5): 503-512.
[11]KERN R, JOSELEAU-PETIT D, MADHAB K, et al. Chattopadhyay chaperone-like properties of lysophospholipids[J]. Biochemical and Biophysical Research Communications 2001, 289(5): 1268-1274.
[12]RAYNAL P, MONTAGNER A, DANCE M, et al. Lysophospholipids and cancer: current status and perspectives[J]. Pathologie Biologie,2005, 53(1): 57-62.
[13]罗贵民, 曹淑桂, 张今. 酶工程[M]. 北京: 化学工业出版社, 2002: 17-18.
[14]郑州工程学院油脂化学教研室. 油脂分析方法[M]. 郑州: 郑州工程学院出版社, 1996: 171-172.
[15]GB/T 22506—2008酶改性磷脂中1-和2-溶血磷脂酰胆碱的测定[S]. 北京: 中国标准出版社, 2009.
[16]陈斌斌, 谷克仁. 水相体系中磷脂酶A1改性大豆磷脂的研究[D]. 郑州: 河南工业大学, 2010.
Enzymatic Hydrolysis of Phospholipids for Preparing Lysophospholipids in Organic Phase
SUN Qing-rui,ZHANG Dong-jie*,LIU Zhi-ming,LU Bao-xin,WANG Qin,ZHANG Qing-rong
(College of Food, Heilongjiang Bayi Agricultural University, Daqing 163319, China)
This study deals with the optimization of process conditions for the hydrolysis of phospholipids with phospholipase A1in hexane for preparing lysophospholipids using response surface methodology. A regression model for acid value of lysophospholipids was established with respect to four hydrolysis parameters. Meanwhile, lysophospholipids were analyzed by infrared spectroscopy and high performance liquid chromatography. The optimal process parameters for preparing lysophospholipids were determined as 50 ℃ of temperature, 13 h of reaction time, 4% of phospholipase A1, 17% of water, and 0.24 g/mL of substrate concentration. The acid value and the contents of phophatidylcholine and 1-acyl-lysophophatidylcholine in the obtained lysophospholipids were 73.8 mg KOH/g, 6.79% and 4.45%, respectively.
lysophospholipids;phospholipids;phospholipase A1;response surface methodology (RSM)
TS229
A
1002-6630(2012)18-0123-04
2011-07-21
黑龙江省农垦总局科技攻关项目(HNKXIV-02-07)
孙清瑞(1976—),男,讲师,硕士,研究方向为食品加工技术与资源利用。E-mail:sqr16@163.com
*通信作者:张东杰(1966—),男,教授,博士,研究方向为农产品加工与贮藏。E-mail:zdj66@yahoo.com.cn

